miR-100-5p下调mTOR抑制前列腺癌细胞的增殖、迁移与侵袭
2020-06-06李苏亮袁小华闫红林西安医学院第一附属医院输血科西安70077西安医学院第一附属医院消化内科通讯作者mailyanhonglin66663com
叶 芸,李苏亮,袁小华,刘 冰,相 莲,闫红林(西安医学院第一附属医院输血科,西安 70077;西安医学院第一附属医院消化内科;通讯作者,E-mail:yanhonglin666@63.com)
最新统计数据显示,2016年美国前列腺癌新发病161 360例,占男性肿瘤新发病例19%;死亡人数26 730例,占男性肿瘤死亡病例8%[1]。随着我国人口老龄化的发展以及饮食结构的改变,前列腺癌的发病率逐年升高[2]。前列腺癌在全世界范围内已成为备受关注的公共健康问题。microRNA(miRNA)是一类由21-24个核苷酸组成的高度保守的非编码单链RNA,通过与靶基因不完全或完全互补结合从而调控靶基因的表达,在机体基因调控网络中发挥着重要的作用[3,4]。近年来研究发现miRNA作为癌基因或抑癌基因在恶性肿瘤发生进展中发挥重要作用[5]。大量研究证实miRNA在前列腺癌发生及发展中表达失调,且前列腺癌患者与正常人群之间存在差异表达[6,7]。miR-100-5p是miRNA家族重要成员之一,位于染色体11q24.1上,呈高度保守性。miR-100-5p在包括前列腺癌在内许多恶性肿瘤中表达异常[8],参与肿瘤细胞的增殖、迁移及侵袭等生物学行为,但作用机制尚不明确。本研究拟观察miR-100-5p在前列腺癌细胞系中的表达变化以及其对细胞增殖、迁移及侵袭能力的影响,并探讨其作用机制。
1 材料与方法
1.1 主要试剂
miR-100-5p mimics、阴性对照NC-mimics(购自广州锐博生物公司),Trizol试剂、LipofectamineTM2000购自美国Invitrogen公司,RNA逆转录试剂盒、qRT-PCR试剂盒购自大连宝生生物公司,Transwell小室购自美国Corning公司,iBlot半干电转印试剂盒购自Invitrogen公司,兔抗人单克隆抗体mTOR及GAPDH购自Abcam公司。
1.2 细胞系
人前列腺癌细胞LNCaP和人前列腺上皮细胞RWPE-1购自ATCC(Manassas, VA, USA)。RWPE-1细胞使用含有L-谷氨酰胺的F12K细胞培养基(Gibco BRL Co. Ltd., USA);LNCaP细胞使用 Roswell Park Memorial Institute-1640培养基(HyClone, Logan, UT, USA)。所有培养基均补充青霉素100 U/ml和链霉素100 U/ml(HyClone, Logan, UT, USA)和10% exosomes-free FBS(Gibco BRL Co. Ltd., USA)。均置于37 ℃,5% CO2的饱和湿度恒温箱中常规培养,细胞用0.05% EDTA消化传代,取生长状态良好的对数生长期细胞进行后续实验。
1.3 qRT-PCR检测miR-100-5p及mTOR的表达
按照TRIzol试剂说明书提取前列腺癌细胞LNCaP的总RNA,鉴定纯度和含量后,逆转录合成cDNA。cDNA合成参照逆转录试剂盒说明书操作。以cDNA为模板,按照qRT-PCR试剂盒说明书配置反应体系进行PCR反应,miR-100-5p基因PCR反应条件:94 ℃ 2 min;40个循环(94 ℃ 20 s,55 ℃ 30 s);mTOR基因PCR反应条件:94 ℃ 2 min;40个循环(94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s)。miR-100-5p以U6作为内参基因,mTOR以GAPDH作为内参基因,相对表达水平采用2-ΔΔCt法计算,实验重复3次。
1.4 细胞转染
取对数生长期LNCaP细胞分为NC-mimics组和miR-100-5p mimics组,接种于6孔细胞培养板,常规调节下培养,细胞融合度达60%-70%时进行细胞转染操作。严格按LipofectamineTM2000说明书操作分别将NC-mimics和miR-100-5p mimics转染至LNCaP细胞,转染后24 h,qRT-PCR检测miR-100-5p的表达,确定转染效率后再进行后续细胞实验。
1.5 CCK-8检测细胞的增殖活性
收集转染后的细胞按5 000/孔的密度分别种于96孔板,每组设3个复孔,每24 h加入10 μl CCK-8反应液37 ℃继续孵育,在Multiskan FC酶标仪上测定450 nm波长处各孔不同时点的吸光度(OD)值,绘制增殖曲线。
1.6 细胞划痕实验检测细胞迁移能力
取转染后24 h的各组细胞,接种培养于6孔板中,孔板底部预先画好标记线,待细胞长到完全融合后,用10 μl的灭菌枪头垂直培养孔底面中央用力划直线沿直线划痕,PBS冲洗2次后继续培养,记录划痕后0 h和24 h显微镜划痕愈合情况,划痕愈合率(%)=[(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度]×100%,实验重复3次。
1.7 Transwell侵袭实验
基质胶均匀涂抹Transwell小室上室,过夜成膜。次日收集转染24 h的LNCaP细胞以无血清培养基重悬制备单细胞悬液,取200 μl含2×105个细胞的单细胞悬液加入Transwell小室上室,小室下室加入500 μl含10%胎牛血清的DMEM培养基,继续培养24 h后取出Transwell小室,棉签轻轻擦弃小室上室的细胞,4%多聚甲醛固定,染色,风干,显微镜下观察,并随机取5个高倍视野计算穿膜细胞数。实验重复3次。
1.8 Western blot检测mTOR的表达
取对数生长期LNCaP细胞,常规提取细胞总蛋白,以BCA法定量蛋白浓度。每个样本取200 μl样品,10% SDS-PAGE分离,将电泳产物转至PVDF膜,5%封闭液4 ℃封闭1 h后,TBS缓冲液漂洗3遍,加入一抗mTOR和GAPDH(1∶1 000),4 ℃孵育过夜,TBS缓冲液漂洗3遍,加入二抗(1∶5 000),室温孵育45 min后,ECL显影液显影,Quality One软件分析条带灰度,以mTOR与GAPDH灰度的比值表示相对表达量。实验重复3次。
1.9 统计学方法
SPSS 20.0进行数据分析,计量资料以均数±标准差表示,采用Mann-WhitneyU检验分析非参数数据;P<0.05为差异有统计学意义。
2 结果
2.1 转染前后miR-100-5p在LNCaP和RWPE-1细胞中的表达
转染前qRT-PCR结果显示miR-100-5p在前列腺癌细胞LNCaP的表达水平较RWPE-1细胞低(P<0.01,见图1A)。miR-100-5p mimics转染后LNCaP细胞中miR-100-5p的表达明显高于NC-mimics组(P<0.01,见图1),表明miR-100-5p mimics转染效率较高。

与各自对照组相比较,**P<0.01
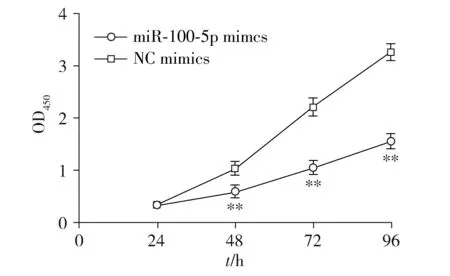
2.2 转染后LNCaP细胞的增殖活性
CCK-8增殖实验显示LNCaP细胞转染mimics组48,72,96 h时OD值明显低于NC-mimics组(P<0.01,见图2)。
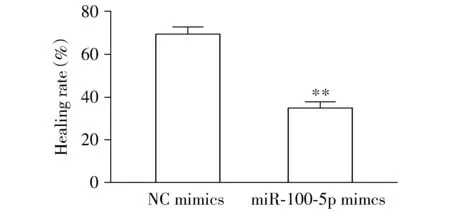
2.3 转染后LNCaP细胞的迁移能力
与NC-mimics组比较,miR-100-5p mimics组转染后细胞的划痕愈合率明显下降(P<0.01,见图3,4),提示转染后LNCaP细胞的迁移能力明显降低。
2.4 转染后LNCaP细胞的侵袭能力
Transwell侵袭实验结果显示,miR-100-5p mimics组穿膜细胞数明显低于NC-mimics组(P<0.01,见图5),提示转染后细胞的侵袭能力明显下降。
2.5 生物学信息法预测miR-100-5p的靶基因
应用生物学信息法预测miR-100-5p可能靶基因,查阅miRand(http://www.microrna.org),预测mTOR可能是miR-100-5p的作用靶基因,miR-100-5p与mTOR的3′UTR区存在种子序列互补的结合位点(见图6)。
与NC-mimics组比较,**P<0.01
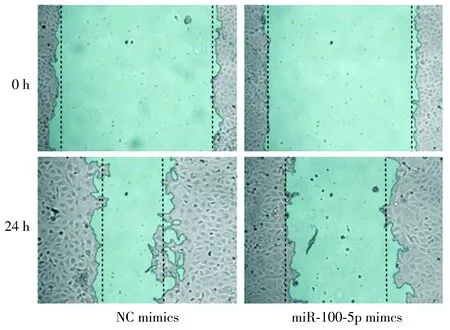
图3 细胞划痕实验检测细胞的迁移能力Figure 3 Cell migration ability detected by cell scratch experiment
与NC-mimics组相比较,**P<0.01
2.6 转染后LNCaP细胞的mTOR mRNA和蛋白的表达
qRT-PCR结果显示miR-100-5p mimics转染LNCaP细胞mTOR mRNA的表达明显低于转染NC-mimics细胞(P<0.01,见图7)。Western blot 显示100-5p mimics转染后LNCaP细胞mTOR 蛋白的表达明显低于转染NC-mimics细胞(P<0.01,见图7)。

图5 转染后LNCaP细胞侵袭能力的改变Figure 5 Invasion ability of cells detected by Transwell invasion assay

图6 miR-100-5p与mTOR的3′UTR区 的结合序列Figure 6 The binding sequence of miR-100-5p with the 3′UTR region of mTOR

图7 转染后LNCaP细胞中mTOR mRNA和蛋白水平的表达Figure 7 Expression of mTOR mRNA and protein in LNCaP cells after transfected with miR-100-5p mimics
3 讨论
miRNA是一类19-24 nt左右的ncRNA。miRNA可与多个靶mRNA3′UTR结合并调控基因表达,导致靶基因异常表达[9,10]。miRNA的异常表达与肿瘤的发生发展存在关联,研究证实miRNA在肿瘤组织中差异性表达,可以作为肿瘤早期检测、分型及预后的生物标志物[11,12]。研究发现miR-100-5p等在前列腺癌中表达下调,被认为是抑癌基因在前列腺癌的发生进展中发挥重要作用[13]。有报道称,miR-100-5p的缺失导致AGO2表达水平上调,进而发生癌细胞的迁移、侵袭、EMT,从而促进前列腺癌的转移[14]。本研究通过qRT-PCR检测前列腺癌细胞系LNCaP和人正常前列腺上皮细胞系RWPE-1中miR-100-5p的表达,miR-100-5p在LNCaP细胞中表达明显降低,提示miR-100-5p在前列腺癌的发生发展中可能也起着抑癌基因的作用。细胞无限增殖、侵袭与转移是恶性肿瘤的基本生物学特性,在对多种恶性肿瘤的研究中均发现miR-100-5p能够抑制肿瘤细胞的增殖、迁移及侵袭等肿瘤生物学行为[15,16]。
为了进一步研究miR-100-5p对LNCaP细胞增殖、侵袭和迁移能力的影响,通过脂质体转染法将miR-100-5p mimics转染至LNCaP细胞,成功上调细胞中miR-100-5p的表达;CCK-8增殖实验、细胞划痕实验和Transwell侵袭实验结果显示miR-100-5p的上调能够明显抑制肿瘤细胞的增殖活性、迁移和侵袭能力,进一步证实miR-100-5p作为抑癌基因能够抑制PCa的进展。
miR-100-5p抑制肿瘤细胞增殖、侵袭及迁移能力的下游分子通路尚不完全明确,为了研究miR-100-5p调控LNCaP细胞的下游靶基因,应用生物学信息法预测mTOR可能是miR-100-5p的作用靶基因,因为miR-100-5p与mTOR的3′UTR区存在种子序列互补的结合位点。mTOR是一种丝氨酸/苏氨酸蛋白激酶,其通过调控蛋白质合成参与生理进程和病理反应,并与癌症的发病机制有关[17]。mTOR信号通路主要调控参与肿瘤发生发展的细胞增殖和代谢,是仅次于p53通路的人类癌症中第二大通路[18]。本研究中,应用qRT-PCR和Western blot发现,上调LNCaP细胞中miR-100-5p表达后,细胞中mTOR mRNA和蛋白的表达水平明显下降,提示miR-100-5p在前列腺癌的发生发展中的作用与靶向调控mTOR基因有关,上调miR-100-5p的表达能够明显抑制mTOR基因的表达。mTOR 是自噬信号通路中的主要靶标,在细胞生长、增殖、分化、细胞周期调控等方面起重要作用。基于本研究结果推测miR-100-5p可能通过靶向mTOR诱导肿瘤细胞的自噬。
综上所述,本研究结果表明,miR-100-5p在前列腺癌细胞系LNCaP中低表达,且miR-100-5p能够抑制LNCaP细胞的增殖、迁移及侵袭能力,其机制与下调mTOR基因的表达有关,可能成为未来PCa靶向治疗的分子靶点。
