沉默SOX4抑制骨肉瘤细胞的生长和转移
2020-06-06史纪元查鹭婷刘安生西安市儿童医院血液肿瘤科西安70003陕西省人民医院骨科通讯作者mailShiJYsy63com
傅 蔷,史纪元,赵 婷,查鹭婷,刘安生(西安市儿童医院血液肿瘤科,西安 70003;陕西省人民医院骨科;通讯作者,E-mail:ShiJYsy@63.com)
骨肉瘤(osteosarcoma,OS)是最常见的原发性恶性骨肿瘤,青少年具有较高的发病率[1,2]。新辅助化疗的使用虽然明显增加了骨肉瘤患者的5年生存率,但骨肉瘤患者的预后仍十分凶险[3],因此,需要探索抑制肿瘤转移的新疗法。性别决定区Y框蛋白4(SOX4)是一种47 kD蛋白,包含3个可区分的结构域,即高迁移率基团(HMG)DNA结合结构域(DBD)、富含甘氨酸的结构域和富含丝氨酸的结构域[4-7]。DBD与TCF/LEF转录因子家族有关,并具有促进细胞凋亡的功能[8]。SOX4通过其HMG域与包含7 bp DNA基序AACAAAG的靶基因结合,从而在转录水平上激活靶基因[9]。大量研究证明,SOX4在胚胎发育、细胞生长和分化中起重要作用[4-7]。近年来,SOX4基因在肿瘤发生中的作用越来越受到重视,并发现该基因在包括食道癌、肝癌、乳腺癌和非小细胞肺癌在内的多种人类恶性肿瘤中过表达,并且与患者的预后明显相关[10-12]。然而,目前尚未确定人骨肉瘤中SOX4表达水平与患者预后的关系。本研究推测骨肉瘤中可能存在SOX4的异常表达,并且SOX4可能在骨肉瘤进展中发挥作用。因此,本研究旨在揭示SOX4与人骨肉瘤患者临床病理指标之间的关系,探讨SOX4在体内外对人骨肉瘤细胞生长和转移的调控机制。
1 材料与方法
1.1 病例样本收集
收集2016-01~2018-12西安市儿童医院血液肿瘤科确诊的30例骨肉瘤患者的手术活检骨肉瘤样本,患者先前均未进行任何化放疗及药物治疗。观察骨肉瘤患者SOX4表达与临床指标的关系。
1.2 骨肉瘤组织中SOX4的免疫组化染色
将石蜡包埋的骨肉瘤组织切片在60 ℃热处理1 h,二甲苯脱蜡,梯度乙醇(100%-50%)水化,然后用pH 6.0的0.01 mol/L柠檬酸盐缓冲液进行抗原修复。用含0.3% H2O2的甲醇抑制内源性过氧化物酶活性30 min。将切片与SOX4一抗(英国Abcam公司)在4 ℃孵育过夜。然后在37 ℃下与生物素化的二抗(英国Abcam公司)孵育1 h。切片用二氨基联苯胺(DAB,艾美捷科技有限公司)显色。阳性细胞被染为棕色和深棕色,阴性细胞为淡黄色或未染色。随机选择5个载玻片区域计算阳性细胞百分比。将大于50%细胞阳性染色的样本定义为阳性,否则为阴性。
1.3 细胞培养
人骨肉瘤细胞系Saos-2和人成骨细胞hFOB 1.19购自中国科学院典型培养物保藏委员会细胞库。细胞均在添加10%胎牛血清(美国Invitrogen公司)、青霉素(100 U/ml)和链霉素(100 mg/ml,美国Invitrogen公司)的Dulbecco改良的Eagle培养基(DMEM,美国Invitrogen公司)中培养。培养条件:5% CO2,33.5 ℃。
1.4 SOX4-shRNA细胞转染
由上海吉凯基因化学技术有限公司合成SOX4短发夹RNA(SOX4-shRNA),并将其克隆到pGFP-V-RS逆转录病毒载体中。pGFP-V-RS-SOX4-shRNA序列为:AGCCCTCGAACTCAAAGCACGCCTCAGGC,阴性对照shRNA(pGFP-V-RS-NC-shRNA)序列为:GCAAGTAACTAGCCACCAGGATCTATACT。将细胞接种在24孔板,每个孔中的细胞生长至80%融合后,按照制造商的说明,用Lipofectamine 2000(美国Invitrogen公司)将shRNA转染细胞48 h。
Annexin Ⅴ/PI分析显示,与NC-shRNA组相比,SOX4敲低组细胞凋亡率明显增加(1.54%±0.18%vs23.37%±3.19%,P<0.001,见图4)。为了进一步研究SOX4基因沉默对骨肉瘤细胞凋亡的诱导机制,本研究检测了敲低SOX4对细胞凋亡相关蛋白的影响。研究结果显示,与NC-shRNA组相比,SOX4敲低组骨肉瘤细胞中促凋亡蛋白Bax和P53的蛋白表达水平显著升高(均P<0.001),分别升高了3.54±3.04倍和3.11±0.19倍,而抗凋亡蛋白Bcl-2的蛋白表达水平显著降低(降低了78.86%±5.67%,P<0.001,见图5)。
1.5 RT-PCR检测细胞中SOX4 mRNA水平
使用Trizol试剂(美国Invitrogen公司)提取细胞总RNA。使用SYBR Premix Ex Taq试剂盒(日本TaKaRa公司)和ABI 7500型定量PCR仪(美国Applied Biosystems公司)进行RT-PCR。引物序列如下。SOX4正向:5′-CTAGCCATGTGACATGGATGATTTT-3′,SOX4反向:5′-CGCATATGTACACATGGCGTGTGTGA-3′;GAPDH正向:5′-GGGATCTACGTACACACCTGTGCCG-3′,GAPDH反向:5′-GTTGTGCCTAGGGACCATATACCCA-3′。PCR条件为95 ℃ 60 s,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共循环40 次。使用GAPDH作为内参基因,并根据2-ΔΔCt法计算SOX4 mRNA的相对表达量。
1.6 Western blot检测细胞中SOX4、Bax、P53、Bcl-2、MMP2、MMP9和Fibronectin的蛋白水平
伤口愈合实验显示,在培养48 h时,与NC-shRNA组相比,SOX4敲低组细胞的伤口面积明显升高(升高了76.87%±6.72%,P=0.009,见图6A)。基质胶侵袭实验显示,与对照细胞相比,SOX4敲低组的细胞侵袭数明显降低(降低了58.53%±5.44%,P<0.001,见图6B)。
1.7 Cell Counting Kit-8检测细胞增殖
使用PE Annexin Ⅴ细胞凋亡检测试剂盒(美国BD Bioscience公司)进行细胞凋亡测定。将细胞在PBS中洗涤3次,重悬于300 μl结合缓冲液中。分别将Annexin Ⅴ和碘化丙啶(PI)添加到溶液中,涡旋振荡,黑暗中孵育20 min。加入结合缓冲液并通过流式细胞术分析细胞。
1.8 流式细胞术检测细胞凋亡
通过Cell Counting Kit-8(CCK-8,东仁化学科技(上海)有限公司)细胞增殖测定法测定骨肉瘤细胞的增殖能力。按照10 000个/孔的密度将细胞接种在96孔板,在无血清培养基中37 ℃下孵育24 h。将20 μl CCK-8溶液添加到每个孔中,然后将细胞在37 ℃下孵育,使用酶标仪检测450 nm处的光密度值(OD)。
王莽史建国三年(公元11年)河水在魏郡元城(今河北大名东)以上决口,洪水泛滥了近六十年,到东汉明帝永平十二年(公元69年),经过王景治河后,出现了一条新河道,即《水经注》以及唐代《元和郡县志》里的黄河。这条黄河已较西汉大河偏东,经今黄河和马颊河之间至利津入海。这条大河稳定了六百多年,其间当然也有多次决口,但无大的改流。直到唐朝末年开始在河口段有部分河段改道。[10](邹逸麟,1980,黄河下游河道变迁及其影响概述)宋朝初年,棣州(今山东惠民、滨县一带)境内“河势高民屋殆逾丈”。
1.9 伤口愈合实验评估细胞的迁移能力
实心球投掷项目一直在初中体育课田径部分占有很重要的地位,尤其是作为体育中考的重要项目,虽然是选择性项目,但仍然越来越多地被学生、家长所关注,成为近些年中考体育的重点关注项目。就原地双手向前投掷实心球而言,是发展上肢肌肉的速度力量和爆发力、全身用力素质、腰腹背肌力量以及身体灵活性、协调性的运动项目。对于上肢肌肉的速度力量、快速爆发用力要求较高;对于腰腹背肌的收展用力要求较高;对于全身的灵活协调用力要求较高;对于自身的动作控制力要求较高。
1.10 BioCoat Matrigel测定细胞侵袭能力
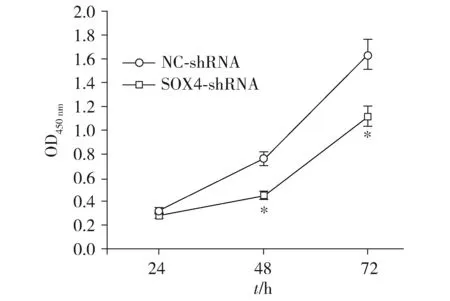
转染携带SOX4-shRNA的pGFP-V-RS病毒载体后,Saos-2细胞系中SOX4的mRNA和蛋白表达分别降低了75.09%±6.42%和78.94%±7.11%(均P<0.001,见图2)。CCK-8检测显示,与NC-shRNA组相比,SOX4敲低组在细胞培养48 h和72 h时细胞增殖能力显著降低(分别降低了40.78%±3.70%和31.71%±2.09%,P=0.004和P=0.002,见图3)。
将细胞接种在6孔板中并培养直至90%融合。使用20 μl移液器尖头将单层细胞划出伤口。在细胞培养48 h时用新鲜培养基将板洗涤1次以除去未黏附的细胞,然后拍照计算伤口愈合程度。
随着数字网络化技术的发展,图书馆的管理模式、服务功能也发生了巨大变化,从单一的静默阅读服务,发展成为团队研讨,为双创发展提供共享学习空间。为此,图书馆办馆方针任务也要随之调整,要打造特色空间、智慧空间,整合文献资源,建设特色资源,提高馆藏利用率,处理好传统文献存储空间与特色共享学习空间的相互依存、相互促进的关系。这也是我们特色建馆的关键。
1.11 小鼠异种移植肿瘤模型的建立
将1×106个用SOX4-shRNA或NC-shRNA转染的Saos-2细胞悬浮在200 μl PBS中,分别皮下注射到SPF级6周龄雌性BALB/c裸鼠的背部(n=10),裸鼠由陕西省人民医院动物实验中心[SYXK(陕)2016-006]提供。定期测量肿瘤体积,肿瘤体积=0.5×长度×宽度2。第4周处死小鼠并分离肿瘤组织,然后固定在甲醛中进行组织病理学分析。
1.12 统计学分析
使用SPSS22.0软件进行统计分析。结果表示为平均值±标准差。两组间比较使用双尾t检验,多组间比较使用单因素方差分析(One-ANOVA)及事后LSD检验。P<0.05表示差异具有统计学意义。
从以上几个实例可以看出,岩矿石标本电性参数测量结果的可靠程度与测量采用方法、方式关系不大,主要取决于标本的采集、加工及测量过程,据此,本人总结了以下几点认识:
2 结果
2.1 SOX4在骨肉瘤组织和细胞系中的表达
RT-PCR和Western blot结果显示,人骨肉瘤细胞系Saos-2中SOX4的mRNA和蛋白表达水平显著高于和人成骨细胞hFOB 1.19(分别升高了3.23±0.42倍和3.76±0.38倍,均P<0.001)。此外,骨肉瘤组织中SOX4存在较高比例的阳性表达(SOX4阳性细胞比例大于50%,见图1)。SOX4的阳性表达与患者TNM分期和远处转移有关,即高TNM分期或发生远处转移患者的骨肉瘤组织中SOX4的阳性率更高。SOX4的阳性表达与年龄、性别和肿瘤大小无明显相关性(见表1)。
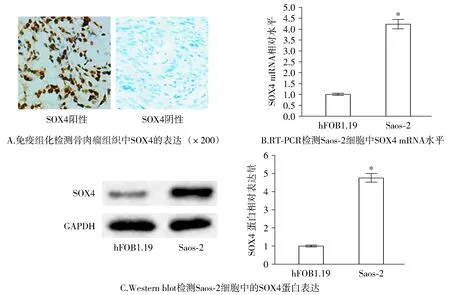
与hFOB1.19细胞比较,*P<0.05
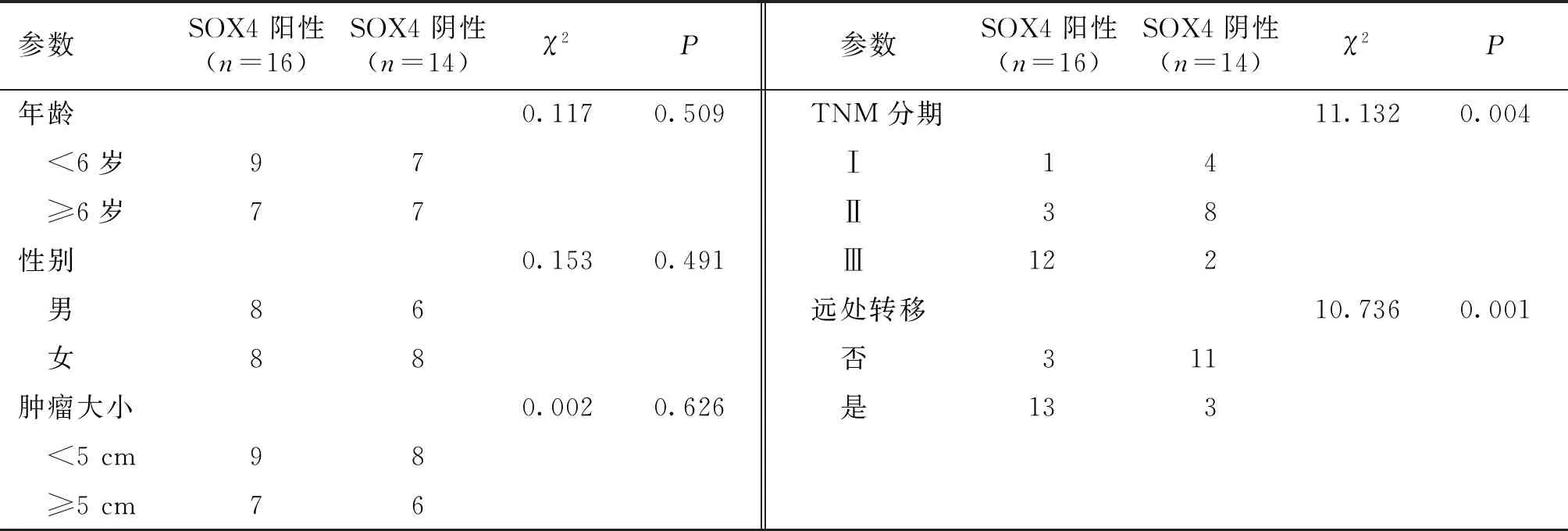
表1 骨肉瘤患者SOX4表达与临床指标的关系 (例)Table 1 Relationships between SOX4 expression and clinical parameters in patients with osteosarcoma (cases)
2.2 下调SOX4对骨肉瘤细胞增殖的影响
使用BioCoat Matrigel进行细胞侵袭测定(美国BD Bioscience公司)。将1×105个细胞悬浮在无血清的DMEM上室中,下室为含有10% FBS的完整培养基。细胞在37 ℃孵育24 h,将细胞用0.5%结晶紫染色并在倒置显微镜下(×100)拍照。随机选择5个视野计算平均侵袭细胞数。

与NC-shRNA比较,*P<0.05
与NC-shRNA比较,*P<0.05
2.3 下调SOX4对骨肉瘤细胞凋亡的影响
结晶设备与蒸汽单元设备类似,在其单元后接闪蒸罐。固液分离后,所产生的结晶盐含有大量的杂质,其回收利用的成本高于普通工业盐的生产成本。加大结晶单元的提纯技术,若能实现多种结晶盐的高纯度分离,将成为燃煤电厂的第二经济增长点。
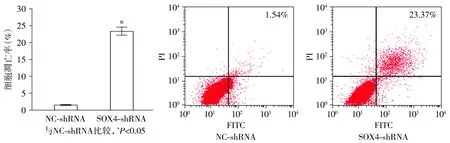
图4 流式细胞术检测下调SOX4对骨肉瘤细胞凋亡的影响Figure 4 Effect of down-regulating SOX4 on osteosarcoma cell apoptosis detected by flow cytometry
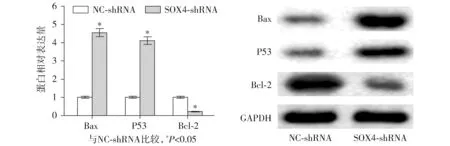
图5 Western blot检测下调SOX4对细胞凋亡相关蛋白表达的影响Figure 5 Effect of down-regulation of SOX4 on apoptosis-related protein expression by Western blot
2.4 下调SOX4对骨肉瘤细胞迁移和侵袭的影响
使用冰RIPA裂解液[中科瑞泰(北京)生物科技有限公司]对细胞进行裂解。将细胞裂解液在4 ℃下于10 000 r/min离心15 min,收集上清液用于蛋白质浓度测定。在10%SDS-PAGE凝胶上分离总蛋白,并转移到硝酸纤维素膜(美国Millipore公司)。将膜用5%脱脂牛奶封闭1 h,然后与一抗在4 ℃下孵育过夜。使用的一抗包括SOX4(1∶500稀释,美国Santa Cruz公司)、Bax(1∶1 000稀释,美国Cell Signaling Technology公司)、P53(1∶500稀释,美国Santa Cruz公司)、Bcl-2(1∶1 500稀释,英国Abcam公司)、MMP2(1∶1 000稀释,美国Cell Signaling Technology公司)、MMP9(1∶1 000稀释,美国Cell Signaling Technology公司)、Fibronectin 1(1∶3 000稀释,英国Abcam公司)和GAPDH(1∶1 000稀释,英国Abcam公司)。然后将膜在TBST溶液中洗涤3次,每次15 min,然后与辣根过氧化物酶标记的二抗室温孵育2 h(北京博奥森生物技术有限公司)。使用超敏ECL化学发光试剂盒(碧云天生物技术研究所)进行显影。GAPDH作为内参。

与NC-shRNA比较,*P<0.05
本研究检测了敲低SOX4对骨肉瘤细胞中肿瘤转移相关蛋白表达的影响,研究显示,与NC-shRNA组相比,SOX4敲低组细胞中MMP2、MMP9和Fibronectin 1蛋白表达显著降低(均P<0.001,见图7),依次降低了67.13%±6.09%,83.04%±7.76%,71.79%±6.21%。
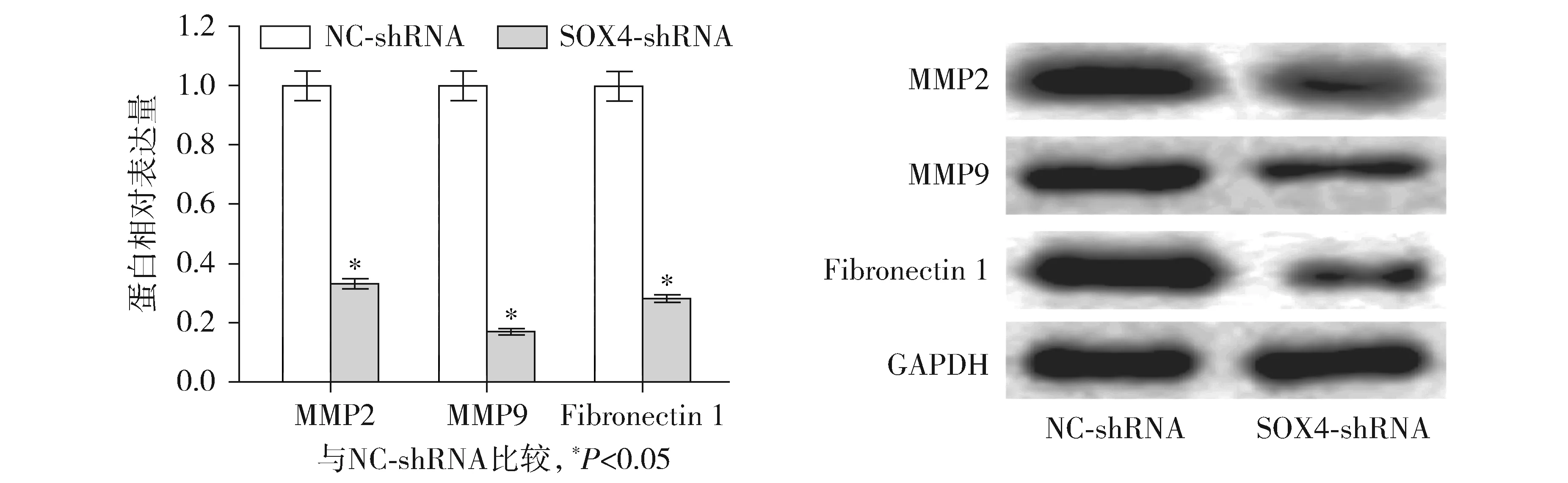
图7 Western blot检测下调SOX4对肿瘤转移相关蛋白表达的影响Figure 7 Effect of down-regulation of SOX4 on tumor metastasis-related protein expression by Western blot
2.5 下调SOX4对异种移植肿瘤模型小鼠肿瘤生成的影响
异种移植肿瘤模型实验显示,与接种对照细胞的小鼠相比,接种了SOX4敲低的细胞的小鼠肿瘤体积在生长21 d和28 d时显著降低(P=0.012和P<0.001,见图8),分别降低了49.33%±5.12%和50.21%±4.78%。
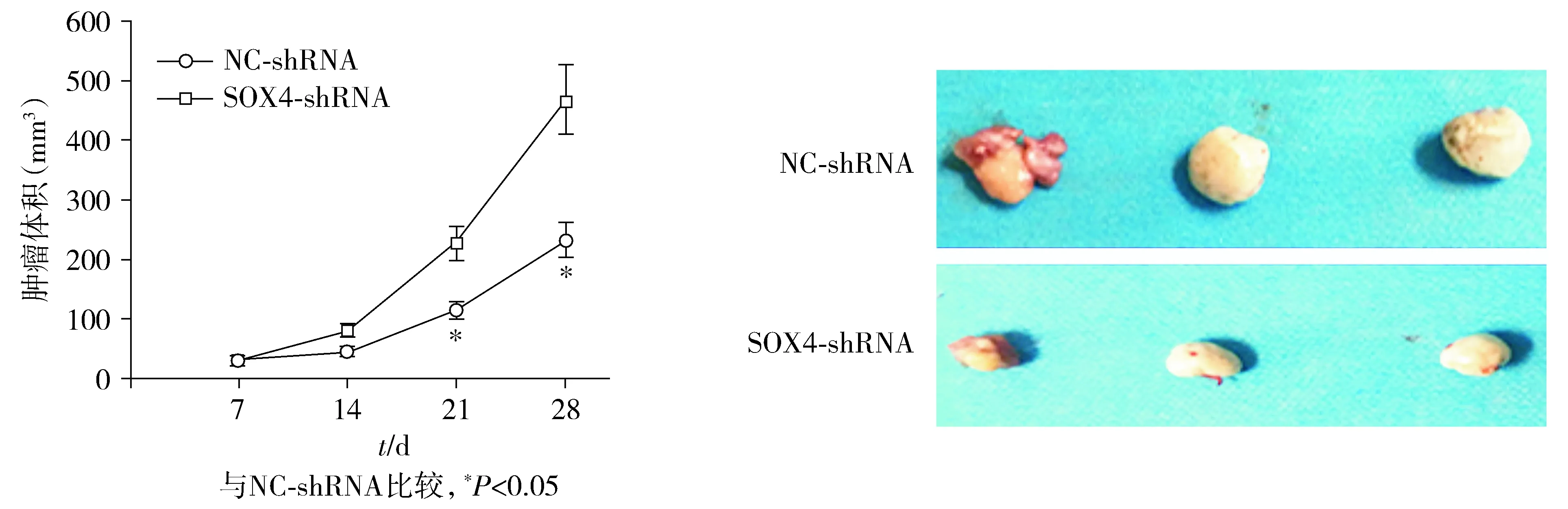
图8 下调SOX4对异种移植肿瘤模型小鼠肿瘤体积的影响Figure 8 Effect of down-regulation of SOX4 on tumor volume in xenograft tumor model mice
3 讨论
SOX4是一种具有多种生物学功能的转录因子,SOX4基因编码474个氨基酸组成的蛋白质,也是一种单外显子基因,大量研究证明SOX4在胚胎发育、细胞生长和分化中起重要作用[4-7]。近年来,SOX4基因在肿瘤发生中的作用越来越受到学者的重视。目前,有学者已经在非小细胞肺癌、乳腺癌、膀胱癌、卵巢癌、结直肠癌、前列腺癌、血液系统恶性肿瘤等多种人类恶性肿瘤中发现了SOX4的异常表达,并且SOX4的异常表达与肿瘤特性和患者预后明显相关,SOX4的高表达是患者不良预后的生物标志物[13-16]。据报道,在胃癌组织中, SOX4表达与肿瘤细胞浸润、血管浸润、淋巴结转移和远处转移有关。生存分析表明,高表达SOX4的患者的无病生存期短于低表达的患者[17]。目前,尚未确定人骨肉瘤中SOX4表达水平的预后意义。本研究结果显示,人骨肉瘤组织和细胞系中SOX4的表达水平显著升高,并且SOX4的高表达与TNM分期和远处转移有关,TNM分期越高或发生远处转移的患者的SOX4普遍高表达。上述结果说明,在成骨细胞恶性转化过程中SOX4被上调并在骨肉瘤中发挥致癌作用,SOX4的异常上调可能促进了骨肉瘤恶性表型。因此,SOX4可作为骨肉瘤判断预后的潜在分子生物标志物。
本研究通过转染携带SOX4-shRNA的pGFP-V-RS病毒载体敲低了Saos-2细胞系中SOX4的mRNA和蛋白表达。进一步研究显示,敲低SOX4后显著抑制了骨肉瘤细胞的增殖,并促进了细胞凋亡。一些研究表明,SOX4主要通过抑制细胞凋亡来促进肿瘤发生[18]。SOX4通过阻断Mdm2介导的P53降解并促进p300/CBP/P53复合物形成诱导凋亡,抑制肿瘤发生[19]。在肺癌细胞H1299中,SOX4通过增加PUMA表达并以非P53依赖性的方式诱导细胞凋亡[20]。SOX4的抑制凋亡作用主要是通过Caspase-3依赖性途径引起的[21]。Bcl-2家族成员在细胞凋亡过程中发挥非常重要的作用,该家族可分为两大类,一类具有抗凋亡作用,包括Bcl-2、Bcl-XL等;另一类具有促凋亡作用,包括Bax、Bak等。Bax/Bcl-2的比例是决定细胞凋亡的关键因素。Bax基因编码的Bax蛋白可与Bcl-2形成异二聚体,并抑制Bcl-2的功能。p53是一种肿瘤抑制基因,其在大多数恶性肿瘤中均存在基因突变。p53基因编码的蛋白质控制细胞周期的启动,当基因发生突变后,由于蛋白空间构象的改变导致其失去了对细胞生长、凋亡和DNA修复的调控作用。此外,p53可以上调Bax的表达并下调Bcl-2的表达。本研究结果显示,敲低SOX4显著上调了促凋亡蛋白Bax和P53的蛋白表达水平,并下调了抗凋亡蛋白Bcl-2的蛋白表达水平。提示在骨肉瘤细胞中,SOX4对细胞凋亡的调控作用是通过Bax、P53和Bcl-2介导的。
图6为传感器系统红外光源HSL5-115-S的驱动电路。单片机通过DAC转换提供频率为0.5 Hz,占空比为50%的脉冲方波,经过LM358放大,用来控制低压MOS场效应管2N7002的通断。
远处转移一直是治疗骨肉瘤的主要难题,其机制涉及肿瘤细胞的迁移、侵袭、上皮间质转化等过程[22,23]。多项研究发现高SOX4水平与肿瘤复发、远处转移、侵袭性和血管生成之间存在相关性[24,25]。本研究结果显示,敲低SOX4显著抑制了骨肉瘤细胞的迁移和侵袭能力。MMP2、MMP9和Fibronectin 1均是与恶性肿瘤转移相关的基因。MMP-2 和MMP-9 是基质金属蛋白酶(MMPs)家族的成员,也是目前为止发现的与肿瘤转移最为密切的细胞外基质降解酶[26]。MMP-9具有调节微循环和血管生成的作用,其可通过促进血管内皮生长因子VEGF的表达来促进血管生成,从而导致恶性肿瘤的高转移性。Fibronectin 1是一种广泛存在于多种组织和细胞中的高分子糖蛋白,具有调控细胞迁移、黏附及组织修复的功能,Fibronectin 1可通过与多种整合素结合来增加肿瘤细胞的侵袭性[27]。本研究结果显示,敲低SOX4显著下调了骨肉瘤细胞中的MMP2、MMP9和Fibronectin 1蛋白表达。上述结果提示敲低SOX4对骨肉瘤肿瘤转移的抑制作用可能通过MMP2、MMP9和Fibronectin 1来介导。
本研究通过体外异种移植肿瘤模型实验证实了敲低SOX4对肿瘤生长的抑制作用。总之,本研究表明SOX4在骨肉瘤患者中异常高表达,并且与不良预后有关。抑制SOX4的表达可抑制肿瘤细胞的增殖和转移能力,并诱导细胞凋亡。靶向抑制SOX4有望成为骨肉瘤治疗的新疗法。
