靶向HER-2多模态纳米探针的制备及性能研究
2020-06-06安改丽陈小龙陕西省人民医院肿瘤内科西安70068陕西省人民医院影像科陕西省人民医院教学科通讯作者mailviking6com
安改丽,刘 屹,喻 凤,陈小龙,郭 维(陕西省人民医院肿瘤内科,西安 70068;陕西省人民医院影像科;陕西省人民医院教学科;通讯作者,E-mail:viking6@6.com)
文献中已有学者设计合成了HER2靶向探针,用于不同成像模式下HER2阳性肿瘤的成像,包括使用不同的放射性标记物(18F、89Zr、68Ga)进行PET显像[5-8],用SPIO颗粒进行MRI显像[9,10]。也有学者设计了多模态分子探针用于显示EGFR阳性肿瘤[10,11],检测肿瘤血管生成[12-14],或评价抗癌药物运送效率[12],但迄今为止,适用于HER2阳性乳腺癌PET-CT/MRI显像的多模态探针尚未见报道。本研究在文献基础上,拟合成多模态HER2靶向探针,使其能够应用于PET-CT及MRI两种影像学模式,使肿瘤细胞表面HER2受体特异性显影,达到无创检测HER2的目的,使HER2阳性乳腺癌能够被早期、快速、特异性地诊断。
1 材料与方法
1.1 材料
人乳腺癌细胞株SK-BR3(购自上海生科院细胞资源中心);超顺磁性氧化铁纳米颗粒(SPIO)(中科雷鸣北京有限公司);PAA(美国Sigma公司);Herceptin(罗氏制药有限公司);噻唑兰(MTT,美国Sigma公司);二甲基亚砜(DMSO,上海浩然生物技术有限公司);4%多聚甲醛(北京鼎国昌盛生物技术有限公司);RPMI-1640(美国GIBCO公司);胎牛血清(美国GIBCO公司)。
1.2 多模态HER2纳米靶向探针的制备
1.2.1 SPIO-Herceptin的制备 参照文献[10,11],使用高热分解法合成生物相容性SPIO,并用聚丙烯酸(polyacrylic acid,PAA)对其进行表面功能化修饰,过程如下:
称取NaOH于100 ml三口瓶中,加入20 ml三乙二醇。磁力搅拌,通氩气(Ar2)15 min后,加热到120 ℃并保持10 min,然后将温度保持在70 ℃待用。取适量PAA和FeCl3于100 ml三口瓶中,加入20 ml三乙二醇。在机械搅拌的条件下通Ar215 min,加热升温至220 ℃,然后加入4 ml NaOH溶液,反应1 h后,冷却至室温。通过乙醇洗涤和磁分离进行提纯,真空干燥,得到SPIO-PAA。将SPIO-PAA与Herceptin进行化学偶联,合成SPIO-Herceptin,分装于EP管内,4 ℃保存。
1.2.2 SPIO-Herceptin-NOTA-AI18F的制备 参照文献[10,11],将适量p-SCN-Bn-NOTA加入到SPIO-Herceptin溶液中,室温反应10 h,通过水洗涤和磁分离进行提纯,得到SPIO-Herceptin-NOTA。将2 mmol/L AlCl3和2 mmol/L K18F溶液混合,将SPIO-Herceptin-NOTA加入到上述溶液中,37 ℃孵化30 min,通过水洗涤和磁分离进行提纯,得到SPIO-herceptin-NOTA-AI18F。PBS缓冲液对所提纯物进行洗脱,每0.5 ml洗脱液收集1管,共20管。同法制备不含SPIO微球的Herceptin-NOTA-AI18F作对照。PBS设定为空白对照。
1.3 SPIO-PAA的一般特征检测
1.3.1 理化性质检测 使用超纯水溶解制备好的SPIO-PAA,目测法来观察其溶液颜色及透明度,取适量样品并使用标准pH试纸测定pH值。
1.3.2 透射电镜检测形态 取适量SPIO-PAA并充分研磨,使用乙醇作为分散剂,超声分散后取2 μl悬浮液滴于铜网上,自然干燥后通过高分辨透射电子显微镜(TEM)观察纳米颗粒的大小及形态。
1.3.3 动态光散射仪检测 分别取1%SPIO-PAA及SPIO-herceptin-NOTA-AI18F水溶液,加入石英比色皿中,在波长633 nm的He/Ne激光下对样品进行扫描测定。
1.3.4 SPIO-herceptin-NOTA-AI18F磁性分析 取10 μg SPIO-herceptin-NOTA-AI18F装入长约7 mm的棉签管中,两端封口后于振动样品磁强记样仓中逐步增加磁场强度,观察磁化曲线,记录数据,计算磁饱和强度和剩磁。
1.3.5 SPIO-herceptin-NOTA-AI18F脂水分配系数测定 SPIO-herceptin-NOTA-AI18F的亲水性程度采用脂水分配系数来评估。分别取0.5 ml的正辛醇和PBS缓冲液,充分混匀,取10 μl SPIO-herceptin-NOTA-AI18F加入装有上述混合液的EP管中,室温下振荡3-5 min,1 500 r/min离心5 min。分别在上(有机相,正辛醇)下(水相,PBS)相中各取0.1 ml作为一个样品,共3个样品。放射性活度通过全自动γ放射免疫计数仪来测定,另取空管进行背景值计数,计算脂水分配系数。
1.3.6 SPIO-herceptin-NOTA-AI18F体外稳定性试验 在装有100 μl PBS的EP管中加入新鲜制备的SPIO-herceptin-NOTA-AI18F溶液,置于37 ℃冰箱中,分别于1,2,3,4 h后取出,Radio-TLC法测定其放射化学纯度,评估其在PBS中的稳定性。同法操作流程评估其在胎牛血清中的稳定性。
1.4 细胞培养及荷瘤小鼠模型构建
人乳腺癌细胞SK-BR3在添加10%胎牛血清和1%的青霉素-链霉素的RPMI-1640培养基,37 ℃、5% CO2的环境中培养。选取雌性无胸腺裸鼠16只,4-6周龄,体质量在20 g左右,分为实验组(HER2阳性)和对照组(HER2阴性),每组8只,依次编号和标记;无菌条件下,取含有SK-BR3细胞的细胞悬液100 μl(含3×106个细胞)分别接种于实验组每只裸鼠右前肢背侧皮下,接种1周后用于后续动物实验。
1.5 MTT法检测纳米颗粒对细胞增殖的影响
将SPIO-herceptin-NOTA-AI18F纳米颗粒配制为如下浓度:200.0,100.0,50.0,25.0,12.5,6.25,3.2 mg/L,加入含SK-BR3细胞培养液中培养48 h,后加入MTT 20 μl,继续培养4 h,加入100 μl DMSO,酶标仪测定吸光度值(A),阴性对照组单纯加入培养液,分别计算细胞相对增殖率(RGR)。
1.6 体外细胞特异性结合实验
选对数生长期的SK-BR3细胞,设置4个时间点组(30 min,1 h,2 h和4 h),每组在EP管中装有400 μl含有1%BSA的RPMI-1640培养液及计数为2×105个SK-BR3乳腺癌细胞。每管中加入SPIO-herceptin-NOTA-AI18F溶液50 μl。震荡1 min,37 ℃水浴箱中培养。分别在预设的4个时间节点取出相应的细胞培养管,加入500 μl预冷的PBS,800 r/min离心5 min,弃上清,PBS洗涤两遍,γ计数仪测量每管的放射性计数,计算不同时间点的细胞结合率,细胞结合率=(反应管计数-本底计数)/标准管计数×100%。
1.7 荷瘤鼠的体内分布
荷瘤鼠尾静脉注射一定剂量SPIO-herceptin-NOTA-AI18F,4 h后取血,断颈处死。取适量肿瘤组织、肺、心脏、肝、胃、脾脏、肠管、肾、股骨、肌肉,生理盐水清洗干净后称重,衰减校正后分别计算各个标本单位组织中放射性计数与注入总放射性计数的比例(%ID/g)。
1.8 统计学分析
采用SPSS 19.0软件进行统计学分析,结果使用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 SPIO-PAA和SPIO-herceptin-NOTA-AI18F的形态及物理性质
本研究成功构建靶向HER-2的多模态纳米分子探针,合成的SPIO-PAA可溶于超纯净水中,pH值约为6.5。高分辨透射电子显微镜(TEM)下观察到该纳米颗粒大小均一,分散性良好,随机选取100个SPIO-PAA颗粒并计算其核心粒径,绘制如下直方图,该纳米颗粒的核心粒径集中于14-16 nm(见图1)。动态光散仪测得的SPIO-PAA及SPIO-herceptin-NOTA-AI18F的平均水合径粒分别为46.8 nm和54.35 nm(见图2)。
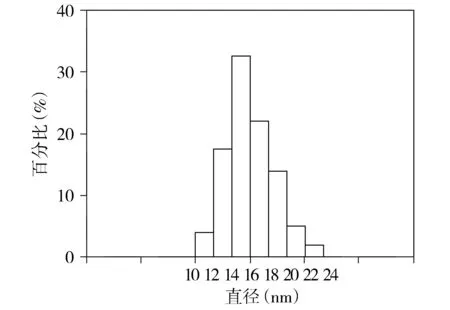
图1 TEM所示SPIO-PAA颗粒粒径分布图Figure 1 The particle size distribution of SPIO-PAA by TEM

图2 动态光散射仪结果Figure 2 The average hydrodynamic sizes of SPIO-PAA and SPIO-herceptin-NOTA-AI18F measured by dynamic optical dispersive instrument
2.2 SPIO-herceptin-NOTA-AI18F纳米颗粒的磁性分析
外加磁场为0时,测试的纳米颗粒几乎没有剩磁,随着外部磁场强度的不断增大,其磁化强度也不断增大;当外加磁场强度达到1 800 Oe时,纳米颗粒的磁化强度增速趋于平缓,逐渐达到饱和状态(见图3)。经测试,SPIO-herceptin-NOTA-AI18F的饱和磁化强度为50.38 emu/g,与文献报道的结果相近,说明该材料具有超顺磁性,具备成为MRI显影剂的潜力。
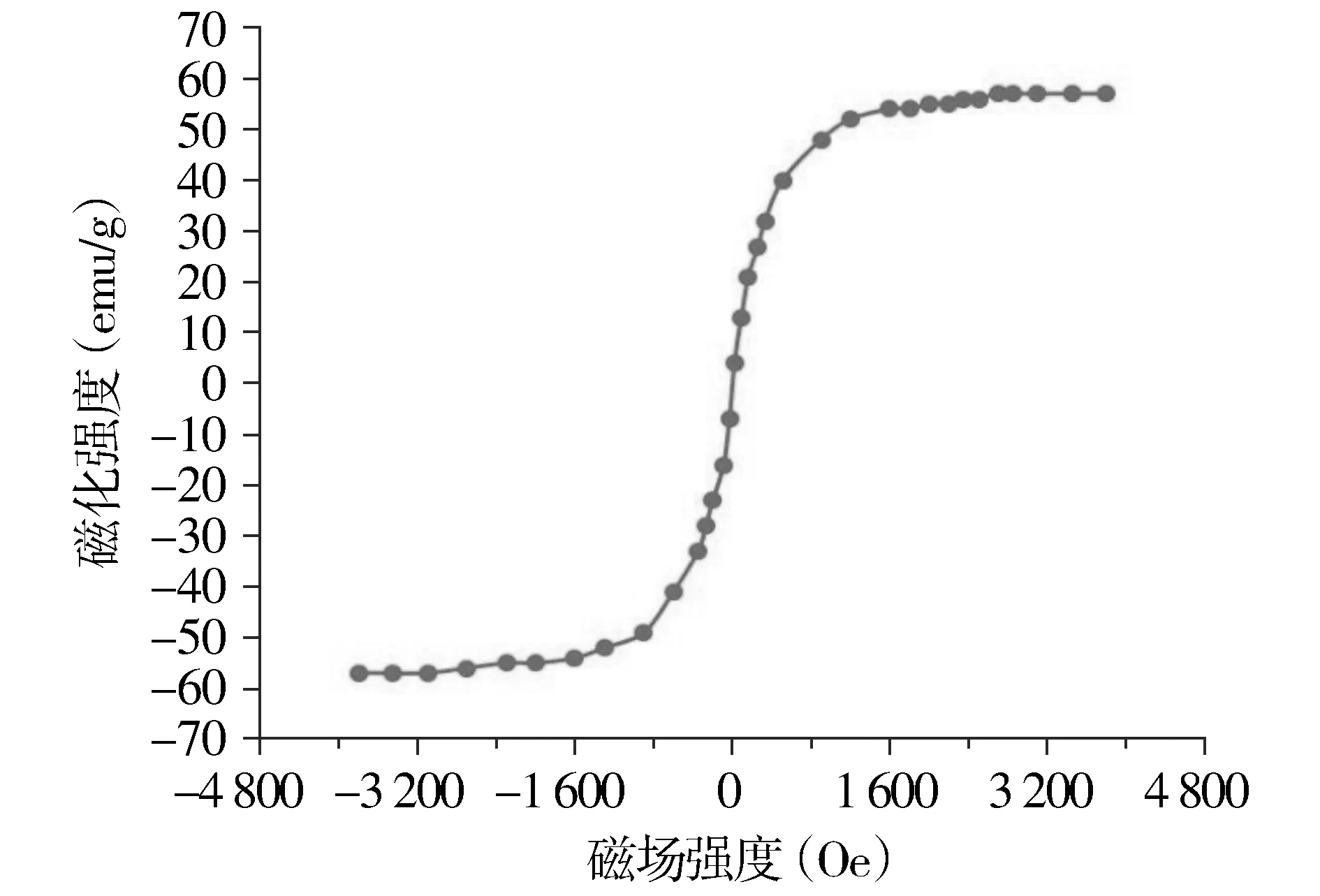
图3 SPIO-Herceptin-NOTA-AI18F的磁滞回曲线Figure 3 The saturation magnetization of SPIO-Herceptin-NOTA-AI18F
2.3 SPIO-herceptin-NOTA-AI18F脂水分配系数测定
经计算,SPIO-Herceptin-NOTA-AI18F的LogP=log[(正辛醇相γ计数-背景平均γ计数)/(PBS相γ计数-背景平均γ计数)]=-2.58±0.21(见表1),说明此探针呈现明显的亲水性。

表1 SPIO-herceptin-NOTA-AI18F的脂水分配系数Table 1 Fat water distribution coefficient of SPIO-herceptin-NOTA-AI18F
2.4 SPIO-herceptin-NOTA-AI18F体外稳定性分析
在恒温条件下(37 ℃),SPIO-herceptin-NOTA-AI18F在PBS缓冲液中孵育4 h放化纯度在75%左右,在胎牛血清中孵育4 h放化纯度在80%左右(见图4),说明SPIO-herceptin-NOTA-AI18F在体外孵育4 h基本是稳定存在的。其中,PBS缓冲液是模拟活体内碱性微环境,胎牛血清是模拟活体内的血液环境。
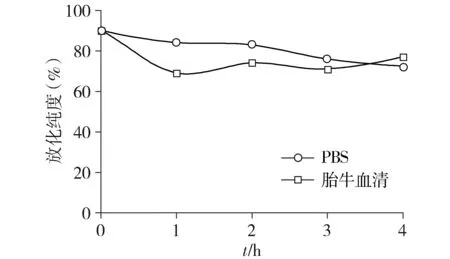
图4 SPIO-Herceptin-NOTA-AI18F在PBS及胎牛血清中的稳定性Figure 4 The stability of SPIO-Herceptin-NOTA-AI18F in PBS and fetal bovine serum
2.5 SPIO-herceptin-NOTA-AI18F对SK-BR3细胞增殖的影响
不同浓度(200.0,100.0,50.0,25.0,12.5,6.25,3.2 mg/L)的SPIO-herceptin-NOTA-AI18F与乳腺癌细胞作用后,细胞相对增殖率(RGR)分别为(99.28±13.21)%,(99.19±11.35)%,(99.03±12.57)%,(95.28±12.29)%,(94.29±12.46)%,(91.78±14.34)%,(90.27±13.18)%(见图5),提示该纳米颗粒对乳腺癌SK-BR3细胞毒性小。
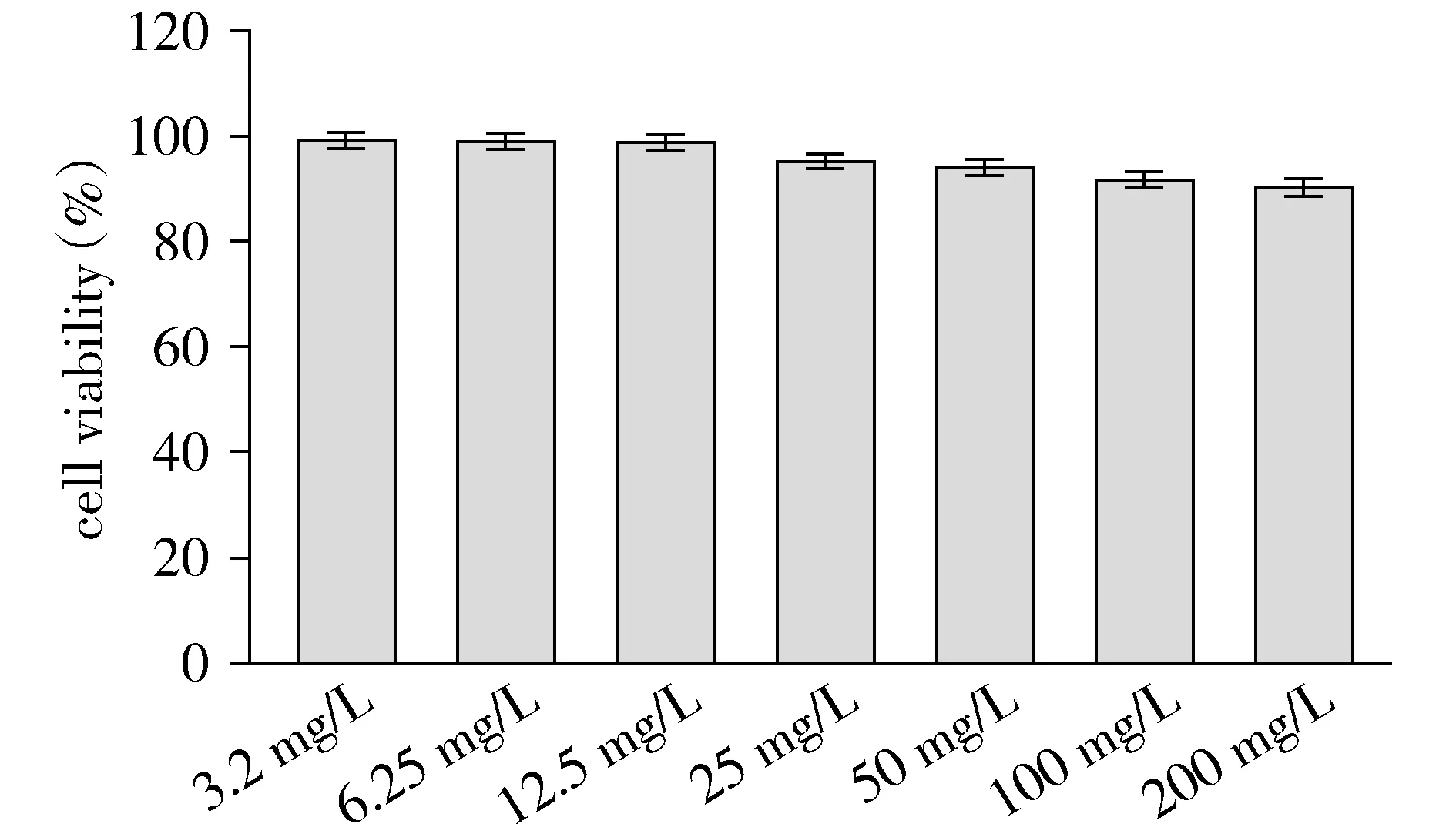
图5 不同浓度SPIO-herceptin-NOTA-AI18F对SK-BR3细胞的毒性作用Figure 5 Toxic effects of SPIO-herceptin-NOTA-AI18F on SK-BR3 cells
2.6 SPIO-herceptin-NOTA-AI18F与SK-BR3细胞特异性结合
SPIO-herceptin-NOTA-AI18F与SK-BR3细胞的结合呈时间依赖性,符合抗原-抗体结合的反应规律,其结合率在30 min时为(7.10±0.30)%,1 h时为(12.30±1.37)%,2 h时为(15.02±2.09)%,4 h时为(18.02±1.84)%(见图6)。
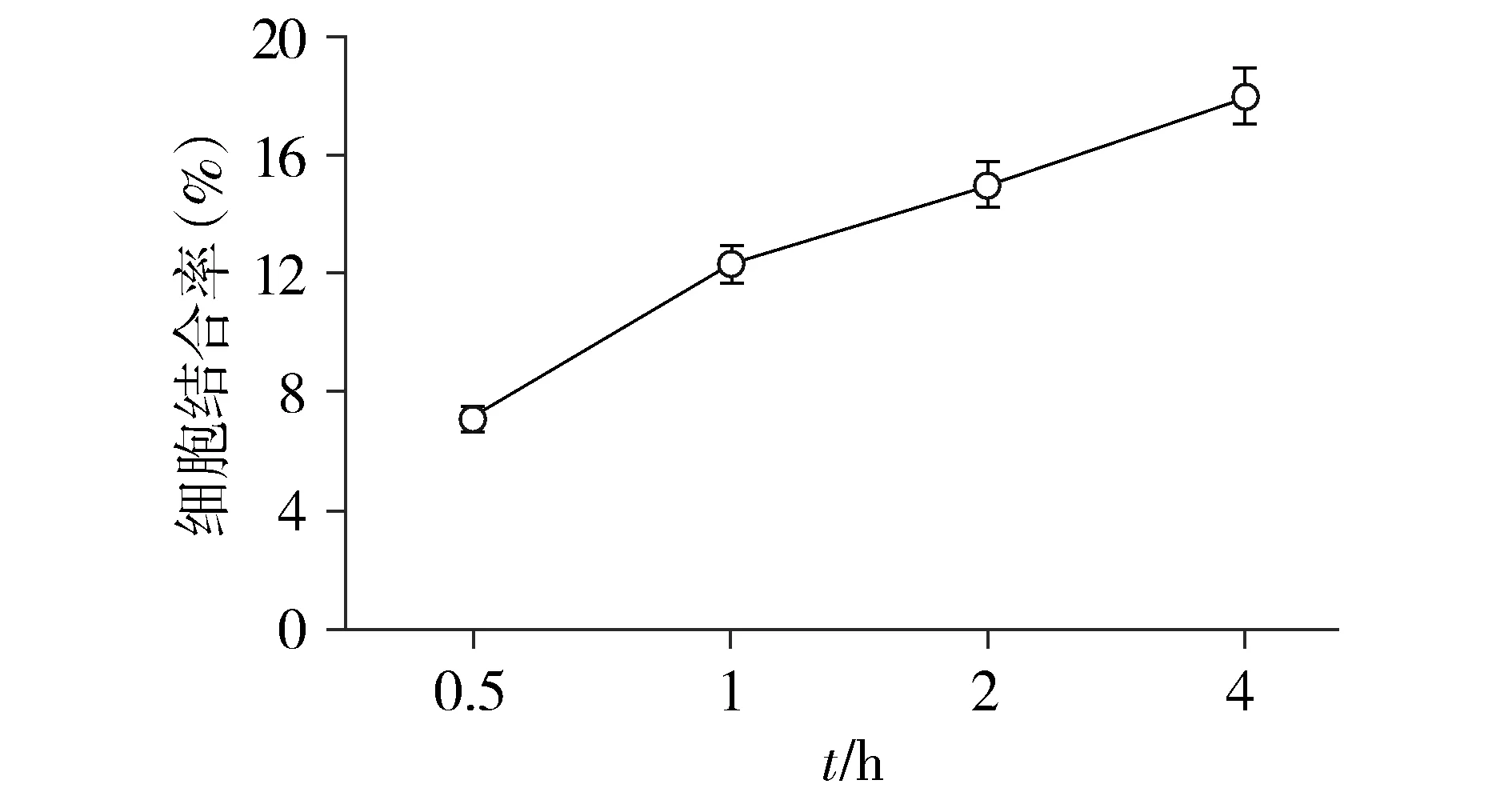
图6 SK-BR3细胞与SPIO-herceptin-NOTA-AI18F共培养不同时间结合率的变化Figure 6 Changes of the binding rate between the cells and the nanoprobes after coculture for different time
2.7 SPIO-herceptin-NOTA-AI18F在荷瘤小鼠体内的生物分布
尾静脉注射SPIO-herceptin-NOTA-AI18F后,该纳米颗粒主要分布在肿瘤组织、血液、肝脏、肾脏和脾脏,肌肉、骨骼中摄取较少。随着时间的延长,各组织器官的放射性逐渐降低,下降最快的是血液,其次为肝脏和肾脏,主要经肝脏代谢,肾脏排泄,10 min时该纳米颗粒的放射性计数在肝脏为(18±0.76)%ID/g、肾脏为(6.5±0.61)%ID/g,48 h时上述器官的放射性均明显下降,肝脏为(3±0.43%ID/g,肾脏为(1.2±0.02)%ID/g,分别降低了83.86%和81.53%(图7)。
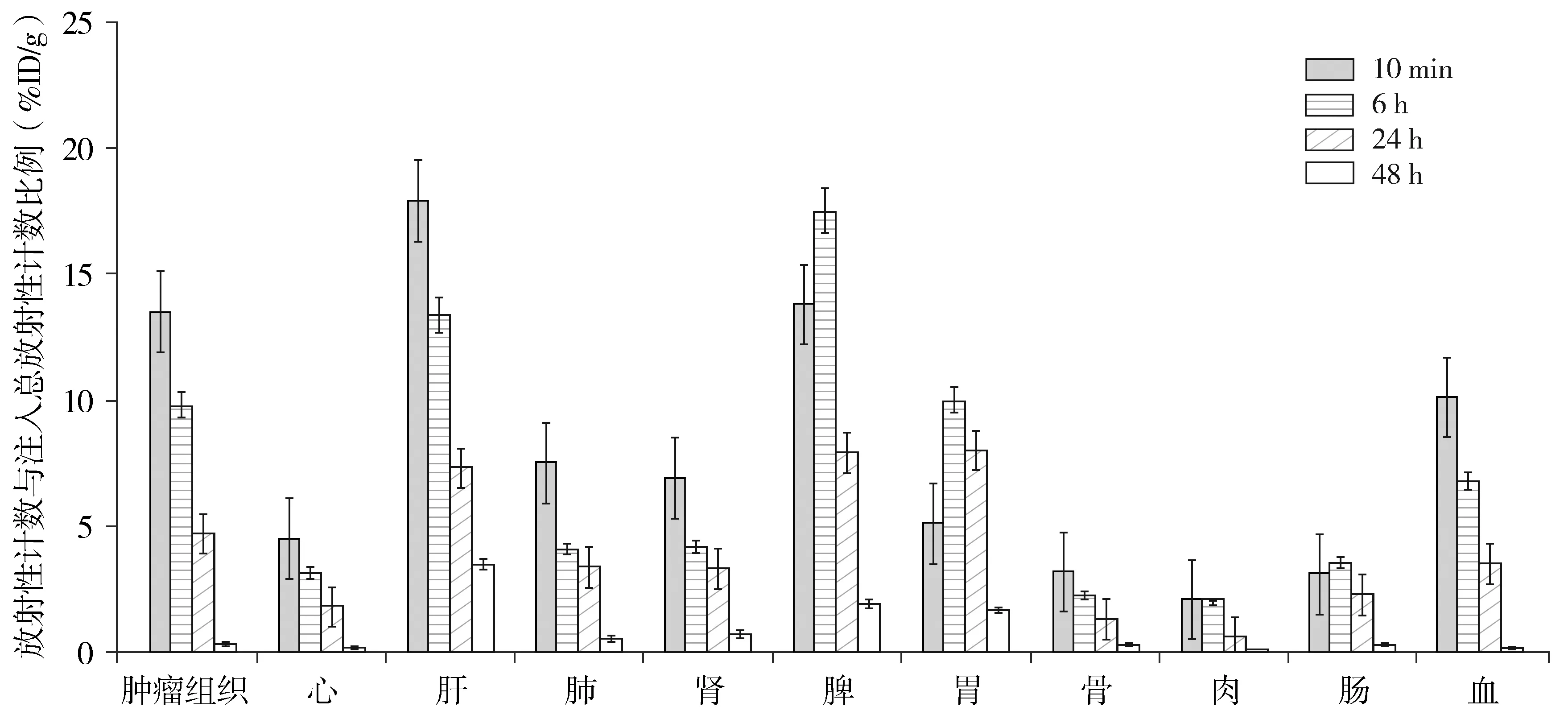
图7 SPIO-herceptin-NOTA-AI18F在荷瘤小鼠体内的生物学分布Figure 7 Biological distribution of SPIO-herceptin-NOTA-AI18F in tumor-bearing mice
3 讨论
纳米科技近年来在生物诊断、靶向药物传递、基因治疗等方面发挥了重要作用,其在分子影像研究中具有独特的优势:首先纳米颗粒(NPs)体积小(比正常细胞小2-4个数量级),能够在其表面进行多种配体功能化,提高对受体的靶向识别能力,实现分子特异性成像;其次纳米颗粒表面积与体积比较大,可与其他对比剂通过化学键结合,为实现多模态成像提供了平台。超顺磁性氧化铁纳米颗粒(SPIONs)是临床医学研究上目前应用较多的纳米材料之一,SPIO-NPs直径小(60-150 nm),穿透力强,具有良好的生物相容性、稳定性及生物降解性,代谢后进入正常血浆铁池,且弛豫率为同样条件下钆离子的7-10倍,在低浓度条件下即能够形成T2WI阴性信号对比,已成为广泛应用的MR分子成像标记物[10,12-14]。文献中分子探针常用的放射性标记物为64Cu、18F、68Ga、89Zr[5-8,14,15]等,其中18F是临床最常用的PET-CT显像剂,对回旋加速器能量要求低,容易获得,且产率较高,其半衰期只有110 min,体内代谢快,适合作为分子探针进行核素显像;赫赛汀是抗HER2的单克隆抗体,能够实现与肿瘤细胞表面HER2受体特异性结合,因此能够作为载体,将探针导向靶点。本研究通过特定的系列化学反应,最终得到18F标记的HER2靶向磁性纳米颗粒SPIO-herceptin-NOTA-AI18F,其具有良好的理化性质和超顺磁性,满足PET/CT和磁共振双模态检查的需求。18F标记后具有较高的放射化学纯度和良好的稳定性。体外实验显示,该纳米颗粒与SK-BR3细胞膜上特异性抗原有高度亲和力,荷瘤小鼠体内实验显示放射性主要浓聚于肝脏和脾脏,说明该探针主要为肝脾摄取,随时间延长,放射性摄取在10 min后达到峰值,其后逐渐下降,其在体内的代谢及排泄与文献报道一致[16-18],这些特征符合抗体在活体内的分布及代谢规律,为后续体内分子影像学研究提供物质基础。HER2靶向纳米探针基础上进行的多模态分子成像将能够活体检测HER2表达水平,有助于临床实现HER2阳性乳腺癌的术前无创性诊断,从而早期评价预后,为患者创造最佳治疗时机。
