敲低TM4SF1通过靶向PI3K/AKT通路抑制鼻咽癌细胞转移
2020-06-06华中科技大学同济医学院附属梨园医院血液科武汉430077华中科技大学同济医学院附属梨园医院肿瘤科通讯作者maildoctorwbhusteducn
陈 慧,魏 柏(华中科技大学同济医学院附属梨园医院血液科,武汉 430077;华中科技大学同济医学院附属梨园医院肿瘤科;通讯作者,E-mail:doctorwb@hust.edu.cn)
鼻咽癌(nasopharyngeal carcinoma,NPC)是头颈部最常见的恶性肿瘤,2013年中国新诊断NPC的患者人数约为42 100[1]。鼻咽癌是起源于鼻咽部黏膜上皮的鳞状细胞癌,放疗是鼻咽癌的主要治疗方法,可大大提高患者5年生存率[2]。但是鼻咽癌具有很高的转移潜能,常常导致治疗失败,同时也是鼻咽癌死亡的主要原因,更好地了解鼻咽癌的转移机制对于其治疗至关重要。鼻咽癌与环境因素、遗传因素、EB病毒感染有关,此外,癌基因与抑癌基因的相互作用失衡也是鼻咽癌的主要发生机制之一。四跨膜蛋白家族成员1(transmembrane 4 L6 family member 1,TM4SF1)是一种细胞膜蛋白,也被称为肿瘤相关抗原L6,是一个22 kD大小的四次跨膜蛋白[3]。TM4SF1已经在多种肿瘤中被发现异常高表达[4-6]。此外,TM4SF1在肺癌、胰腺癌和肝癌也被证明能够促进肿瘤的转移能力[6-8],但TM4SF1是否与鼻咽癌转移相关尚不明确。因此,本研究通过在鼻咽癌细胞系HONE1特异性地敲低TM4SF1,观察TM4SF1是否能够影响鼻咽癌的转移能力,并进一步探讨其作用机制,以期为鼻咽癌的临床治疗提供一定帮助。
1 材料与方法
1.1 细胞及主要试剂
HONE1细胞系购自ATCC公司,siRNA购自上海吉玛制药技术有限公司,TM4SF1、AKT、p-AKT、E-cad、N-cad、Vimentin和MMP2抗体购自美国CST公司,LipofectamineTM2000购自美国Invitrogen公司,MK2206购自美国selleck公司,Transwell小室购自美国Corning公司。
1.2 细胞培养及转染
在含有10%胎牛血清的RPMI-1640培养基中培养HONE1细胞,在转染前将细胞接种于6孔板中,当细胞融合度达到50%左右时,取4 μl的LipofectamineTM2000与5 μl siRNA溶于200 μl的Opti-MEM中孵育10 min,加入6孔板中,孵育48 h,收集细胞进行后续实验。siTM4SF1序列为5′-GCGATGCTTTCTTCTGTATTT-3′。
1.3 分组与处理
为了探讨TM4SF1敲低对HONE1细胞的影响,将HONE1细胞分为正常对照组和TM4SF1敲低组,按照上述转染步骤分别转染siNC和siTM4SF1,然后通过Wstern blot和PCR检测两组TM4SF1表达及转移能力。
为了进一步探讨TM4SF1是否通过AKT调控HONE1细胞的转移,将HONE1细胞分为3组:一组不做处理为正常对照组,一组只加AKT特异性抑制剂MK2206为MK2206组,一组同时加siTM4SF1及MK2206为siTM4SF1+MK2206组。然后通过Transwell实验检测HONE1细胞的转移能力。
1.4 实时荧光定量PCR检测mRNA表达
将细胞置于1 ml Trizol试剂中室温裂解5 min,细胞完全裂解后室温12 000 r/min离心5 min,弃沉淀,加入200 μl氯仿上下震荡混匀后室温放置15 min,4 ℃,12 000 r/min离心15 min。吸取上层水相于新离心管中,加入500 μl异丙醇混匀室温放置10 min,4 ℃,12 000 r/min离心10 min,弃上清,加入75%乙醇,4 ℃,8 000 r/min离心5 min,置于通风橱晾干后所得白色沉淀即为RNA。使用DEPC水溶解RNA后用分光光度计检测其浓度和纯度。随后用1 μg总RNA逆转录合成cDNA,按20 μl体系进行qRT-PCR。反应条件为:95 ℃ 10 min,95 ℃ 15 s、60 ℃ 60 s,共48个循环;95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s。用GAPDH基因作为内参,每组样品重复3次。TM4SF1-F:5′-CAGCCCTTGGCTTAGCAGA-3′,TM4SF1-R:5′-CCACAATGCTTGGGTTCA-3′。
1.5 Transwell实验检测细胞转移能力
将Transwell小室放在24孔板中,下层装有0.6 ml的含10%胎牛血清的RPMI-1640培养基,并将4×104个HONE1细胞溶于0.2 ml无血清培养基中,并接种在上室中,37 ℃孵育24 h,将细胞用4%多聚甲醛固定40 min,随后并用结晶紫染色40 min并拍照。
1.6 划痕实验检测细胞转移能力
将1 000个细胞接种在6孔板中。当细胞融合达到100%时,用200 μl枪头划擦细胞。用PBS洗涤,将细胞在不含胎牛血清的培养基中培养24 h,用显微镜拍摄细胞。
1.7 Western blot检测转移相关蛋白表达
使用RIPA细胞裂解液将HONE1细胞在冰上裂解30 min。4 ℃、14 000g离心10 min,收集上清液。BCA法测量蛋白质浓度。SDS-PAGE凝胶分离蛋白质提取物,并转印到PVDF膜上。将膜在含有5%脱脂牛奶中封闭2 h,并分别与TM4SF1(1∶1 000)、E-Cad(1∶1 000)、N-Cad(1∶1 000)、Vimentin(1∶1 000)、MMP2(1∶1 000)、t-AKT(1∶1 000)、p-AKT(1∶1 000)及GAPDH(1∶1 000)等一抗4 ℃孵育过夜,随后分别与兔二抗及鼠二抗(1∶1 000)室温孵育2 h。用ECL显影液对条带进行显影。
1.8 统计学分析
使用SPSS 19.0进行统计分析,数据均采用均数±标准差表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 转染siTM4SF1对HONE1细胞中TM4SF1蛋白和mRNA表达的影响
与对照组相比,转染siTM4SF1后,HONE1细胞中TM4SF1在蛋白水平显著降低(80.31±3.11)%,mRNA水平降低(85.13±3.59)%,并且差异均具有统计学意义(P<0.05,见图1)。这表明siTM4SF1能够在HONE1细胞内特异性敲低TM4SF1。

与NC组比较,*P<0.05
2.2 敲低TM4SF1对HONE1细胞转移能力的影响
Transwell实验和划痕实验结果显示,与对照组相比,敲低TM4SF1后HONE1细胞的转移能力分别下降(32.79±5.74)%和(34.01±5.31)%,并且差异均具有统计学意义(P<0.05,见图2)。以上结果表明敲低TM4SF1能够抑制HONE1细胞的转移能力。
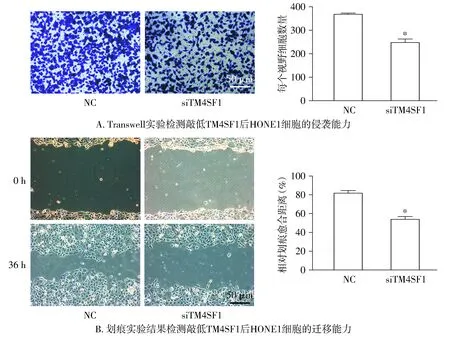
与NC组比较,*P<0.05
2.3 敲低TM4SF1对HONE1细胞中转移相关蛋白的影响
通过Western blot检测转移相关蛋白,与对照组相比,siTM4SF1组转移相关蛋白N-cad、Vimentin、MMP2蛋白水平分别下降(52.53±4.82)%,(38.15±2.23)%,(30.32±4.17)%,E-cad蛋白水平明显升高(76.24±6.29)%,差异均具有统计学意义(P<0.05,见图3)。
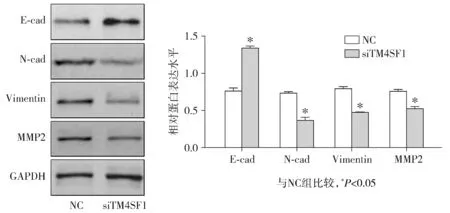
图3 敲低TM4SF1对HONE1细胞中转移相关蛋白的影响Figure 3 The effect of knockdown of TM4SF1 on the metastasis-related proteins
2.4 敲低TM4SF1对PI3K/AKT信号通路的影响
Western blot实验显示,与对照组比较,siTM4SF1组的p-AKT蛋白水平明显下降(73.17±8.24)%,差异具有统计学意义(P<0.05),同时t-AKT蛋白水平没有统计学差异(P>0.05,见图4)。
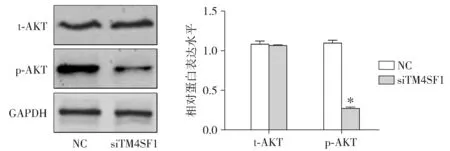
与NC组比较,*P<0.05
2.5 MK2206对HONE1细胞转移能力的影响
用100 nmol/L的MK2206和siTM4SF1处理HONE1细胞后,Transwell实验显示,与对照组比较,MK2206组HONE1细胞的转移能力明显下降(64.53±5.38)%,此外siTM4SF1+MK2206组相比MK2206组的转移能力进一步下降为(36.33±4.89)%,差异具有统计学意义(P<0.05,见图5)。
3 讨论
TM4SF1蛋白主要表达于细胞膜和细胞内囊泡,其基因定位于染色体3q21-3q25[8]。有研究表明,TM4SF1能够与肌球蛋白10和β-肌动蛋白相互作用,从而调节细胞伪足的形成以介导细胞运动和定向迁移[9]。TM4SF1被证明与胰腺癌中吉西他滨的化疗敏感性相关[10],同时,TM4SF1能够影响膀胱癌和胰腺癌等癌症的转移能力[11],这些研究表明,TM4SF1在肿瘤的转移过程中起着至关重要的作用。
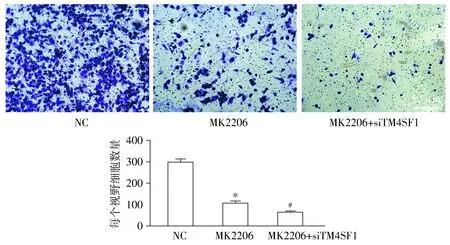
与NC组比较,*P<0.05;与MK2206组比较,#P<0.05
AKT是一种蛋白激酶,在细胞内有着许多AKT的底物,AKT通过调节各种底物的活性能够影响细胞增殖、转移、存活和代谢等相关功能[12]。在所有实体肿瘤中几乎都能观察到AKT的过度激活[13],同时,在小鼠模型中已经证明AKT的过度激活能够导致肿瘤的发生[14]。AKT的激活受到基因突变和磷酸化、乙酰化和泛素化等各种翻译后修饰调节[15]。已经有研究证明,TM4SF1能够通过AKT通路促进肺癌的肺癌和乳腺癌的转移能力[16,17]。但是TM4SF1在鼻咽癌转移中的作用尚未有过报道。
本研究通过Transwell实验证明,敲低TM4SF1后能够显著抑制HONE1的细胞转移能力,同时,E-cad、N-cad、Vimentin及MMP2等蛋白水平也能被TM4SF1敲低明显改变。由于E-cad及N-cad蛋白的变化为上皮间质转化过程的重要指标[18],这意味着TM4SF1可能通过上皮间质转化途径影响HONE1细胞的转移能力。此外,本研究证明TM4SF1的敲低能够显著降低AKT磷酸化的水平,由于AKT的磷酸化决定AKT是否能够被激活,因此TM4SF1的敲低能够明显抑制HONE1细胞中AKT的激活,有文献报道AKT的激活可以促进上皮间质转化过程从而影响细胞的转移能力[19]。为进一步证明AKT在本研究的作用,使用AKT特异性抑制剂MK2206处理细胞,结果证明MK2206能够协同增加TM4SF1对HONE1细胞转移能力的抑制。
综上所述,本研究证明敲低TM4SF1能够通过抑制AKT的激活从而抑制HONE1细胞的转移能力,这提示TM4SF1可能在鼻咽癌的转移中起到重要作用,或许可以作为鼻咽癌临床治疗的一个重要靶标。
