诱导人胚胎干细胞向子宫内膜样细胞分化的初步研究
2020-06-05郭杉袁涛刘英
郭杉,袁涛,刘英
近年干细胞相关治疗方法是子宫内膜修复研究领域的新兴热点。在众多种类的干细胞中,人胚胎干细胞分化潜能最为全面,具有极高的研究价值。有动物实验表明,将人胚胎干细胞分化成的子宫内膜样细胞接种于子宫内膜损伤的小鼠体内,小鼠子宫中有分化后的细胞存活,内膜损伤得到修复[1]。但是,现有报道的将人胚胎干细胞向子宫内膜样细胞分化方法中,目的细胞获得率低(约为16.9%),给后续的体内移植带来一定困难[2-3]。本研究使用无饲养层培养的人胚胎干细胞,分别通过共培养诱导法和细胞因子诱导法向子宫内膜样细胞分化,寻找更为高效可靠的分化方法,为后续深入研究奠定基础。
1 材料与方法
1.1 研究材料
1.1.1 干细胞来源人胚胎干细胞购自北京赛贝生物技术有限公司,为h1干细胞系。
1.1.2 主要试剂DMEM/F12、青链霉素、胎牛血清(FBS)、0.25%胰酶-EDTA、磷酸盐缓冲液(PBS)及胶原酶Ⅳ均购自美国Gibco 公司;PSCeasy 人多潜能干细胞铺底工作液、PSCeasyⅡ人多潜能干细胞基础培养基、PSCeasy人多潜能干细胞消化液均购自北京赛贝生物技术有限公司;转化生长因子α(TGF-α)、上皮生长因子(EGF)、血小板源性生长因子-BB(PDGF-BB)均购自美国Peprotech公司;β雌二醇(β-E2)购自美国Sigma公司;鼠抗人细胞角蛋白18抗体购自美国Cell Signaling Technology公司;兔抗人波形蛋白抗体购自英国Abcam公司;dylight594羊抗小鼠抗体、dylight649羊抗小鼠抗体、dylight488羊抗兔抗体均购自美国Earthox公司;4%多聚甲醛购自北京索莱宝科技有限公司;聚乙二醇辛基苯基醚(tritonX-100)购自美国Invitrogen公司;固定缓冲液、通透缓冲液Ⅲ均购自美国BD公司。
1.1.3 主要仪器及耗材TDL-40B离心机(无锡市瑞江分析仪器有限公司);C6流式细胞仪(美国BD公司);移液枪(德国Eppendorf公司);CO2培养箱(美国Thermo公司);超净台(上海博讯实业有限公司医疗设备厂);显微镜(日本OLYMPUS公司);水浴锅(北京市长风仪器仪表公司);冻存管、15 mL和50 mL离心管、6 cm和10 cm细胞培养皿均购自丹麦NUNC公司;6孔板细胞培养皿及Transwell-膜嵌套3412均购自美国Corning公司。
1.2 研究方法
1.2.1 子宫内膜细胞组织获取及原代培养选取在2018年2—10月于首都医科大学附属北京妇产医院(我院)生殖中心行子宫内膜诊刮术患者的无病变子宫内膜。纳入标准:①有正常排卵性月经周期;②3个月内无宫腔操作及激素服用史。本研究已获得我院医学伦理委员会审核批准,并获得患者的知情同意。参照本实验室既往使用的方法[4],将诊刮取得的子宫内膜组织迅速放入4 ℃预冷含有0.5%青链霉素和DMEM/F12培养液的15 mL无菌离心管中,转移至实验室。350×g离心5 min后,于超净台中弃上清,将组织移入6 cm无菌培养皿中,用无菌眼科剪剪碎成1 mm3块状,PBS冲洗后移入15 mL离心管,向管内加入约为组织块体积3倍的0.1%胶原酶Ⅳ,充分吹打后置于37 ℃孵箱中消化30 min,每10 min吹打1次。加入等量培养液终止消化,依次过100 μm和40 μm滤网后,将含有内膜细胞的滤液收集于新的离心管中,350×g离心5 min,此次的细胞沉淀为进一步纯化的子宫内膜间质细胞。将细胞沉淀用含有10%FBS的DMEM/F12培养液重悬计数后,以1×105/cm2的密度接种于10 cm细胞培养皿中,置于37 ℃、5%CO2孵箱中培养。24 h后于倒置相差显微镜下观察细胞形态、密度及生长状态。每天换液至细胞达到80%~90%融合,使用0.25%胰酶-EDTA进行传代,传代至第2~3代以后通过免疫荧光实验检测细胞纯度,并根据需要将细胞接种于Transwell嵌套中备诱导分化用。
1.2.2 人胚胎干细胞无饲养层培养将4 mL PSCeasy人多潜能干细胞铺底工作液(含基质胶)加入6 cm细胞培养皿中,置于孵箱中至少孵育4 h。复苏冻存的人胚胎干细胞,适量PSCeasy培养液重悬后,取出孵箱中提前铺底的培养皿,吸弃多余的铺底工作液,以1×105/cm2的密度接种于培养皿中。24 h后观察细胞形态及复苏情况。
1.2.3 共培养法及细胞因子法诱导分化将实验需要的6孔板提前做好铺底处理过夜。吸弃人胚胎干细胞培养皿中的培养液,加入2 mL PSCeasy人多潜能干细胞消化液,置于孵箱中37 ℃消化2 min 30 s后取出,弃上清,加入适量PSCeasy培养液吹打,按1∶10比例将人胚胎干细胞接种于预先铺底的6孔板中。24 h后于倒置相差显微镜下观察细胞生长状态,然后分组进行诱导分化。①共培养组:在6孔板中加入Transwell嵌套,并接种6×104个子宫内膜间质细胞。在6孔板底部和Transwell嵌套中各加入2 mL分化培养基(10 ng/mL EGF、10 ng/mL PDGF-BB、10 ng/mL TGF-α、1×10-7mol/L β-E2及含10%FBS的DMEM/F12培养液);②细胞因子组:在6孔板的每孔中加入2 mL分化培养基(成分同共培养组);③对照组:在6孔板的每孔中加入2 mL子宫内膜细胞培养基(DMEM/F12+10%FBS)。3组均每天换液,在第4天用0.25%胰酶-EDTA消化传代。
1.2.4 细胞形态记录、免疫荧光染色及流式细胞学实验分析子宫内膜间质细胞于第2~3代进行免疫荧光实验检测细胞角蛋白18及波形蛋白表达情况。将子宫内膜间质细胞接种于激光共聚焦皿中,4%多聚甲醛固定10 min,PBS清洗,0.1%tritonX-100通透20 min后,加入10%FBS封闭后,4 ℃孵育1∶500稀释的兔抗人波形蛋白抗体和鼠抗人细胞角蛋白18抗体过夜,同时设置阴性对照,4 ℃孵育PBS过夜。第2天洗净一抗,孵育1∶200稀释的羊抗兔二抗1 h,封片后于荧光显微镜下观察结果。另外,诱导分化的3组细胞于第4天拍照记录倒置相差显微镜下观测的形态,经0.25%胰酶-EDTA消化传代后,于第7天再次拍照记录形态,第8天收细胞进行流式细胞学实验分析其分化效率。将分化的细胞消化成单细胞后,经固定缓冲液37 ℃固定12 min,通透缓冲液Ⅲ冰上通透30 min后,于冰上孵育1∶500稀释的兔抗人波形蛋白抗体和鼠抗人细胞角蛋白18抗体1 h,PBS洗净后再孵育1∶200稀释的羊抗兔二抗30 min,洗净重悬于流式管中上机分析。
1.3 统计学方法 采用SPSS 16.0软件进行统计分析。定量资料用均数±标准差(x±s)表示,3组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜间质细胞形态和免疫荧光染色 光镜下可见子宫内膜间质细胞呈长梭状贴壁生长(见图1A)。经免疫荧光染色,培养的子宫内膜细胞波形蛋白表达阳性,细胞角蛋白18表达阴性,证实为间质细胞(见图2)。
2.2 人胚胎干细胞分化的细胞形态改变 光镜下可见未分化的人胚胎干细胞呈克隆贴壁生长(见图1B),高倍镜下见细胞呈圆形,体积小,细胞核大(见图1C)。分化后第4天3组细胞的形态均发生改变,诱导分化的细胞呈多角状,边缘不规则,核质比变小(见图1D~1F)。传代后,分化第7天共培养组和细胞因子组的细胞呈长梭状,核质比变小(见图1G、图1H);对照组细胞则形态不一,有的呈类圆形,有的呈类梭形(见图1I)。
2.3 人胚胎干细胞的分化效率 经流式细胞术检测,共培养组和细胞因子组诱导分化第8天的细胞波形蛋白表达均为阴性,部分细胞角蛋白18表达阳性,分化率分别为(55.63±10.29)%和(13.9±0.26)%,差异有统计学意义(n=3,P=0.000)(见图3A、图3B),提示人胚胎干细胞部分向子宫内膜上皮细胞方向分化。对照组(89.40±11.41)%的细胞波形蛋白、细胞角蛋白18表达均呈阳性,未见定向分化(见图3C)。共培养组、细胞因子组及对照组(4.29±3.54)%的细胞向子宫内膜上皮细胞方向分化率比较,差异有统计学意义(n=3,F=56.590,P=0.000)。
3 讨论
人胚胎干细胞因其全能的分化潜能及强大的自我更新能力一直广受科学界的关注[5]。自Thomson等[6]于1998年从囊胚内细胞团中成功分离以来,其培养方式起初为动物细胞来源的饲养层培养。随着学者们的进一步研究,维持人胚胎干细胞干性的相关蛋白被分离提纯,以基质胶为代表的无饲养层培养逐渐成为主流培养方式[7]。与饲养层培养法相比,无饲养层培养法操作简捷,降低了在长时间培养过程中细胞的污染风险。而且,此前饲养层培养法的饲养层细胞多为经丝裂霉素处理的小鼠胚胎成纤维细胞(MEF)[8]。饲养层细胞的动物源性为人胚胎干细胞异体移植带来了一定的风险与困难。目前,无饲养层培养法可使体外培养的人胚胎干细胞保持未分化状态并实现有效扩增,避免了动物源性污染,已有学者将无饲养层培养的人胚胎干细胞向心肌细胞[9]和视网膜色素上皮细胞[10]分化。本实验采取的无饲养层培养法既能保持胚胎干细胞的干性,也有利于细胞的后续有效分化。
关于人胚胎干细胞向子宫内膜样细胞诱导分化方案中,分化所需时间、分化后形成的细胞种类以及细胞分化率均有不同。有研究将自主建系的人胚胎干细胞系置于小鼠MEF饲养层细胞上培养,采用拟胚体悬浮法、细胞因子法及共培养法3种方法诱导分化,21 d后经流式细胞学检测发现共培养组分化效率最高,有16.9%的细胞角蛋白表达阳性,波形蛋白阴性[2]。而另一研究使用共培养法将其自主建系的人胚胎干细胞置于小鼠MEF饲养层细胞上分化5周,免疫荧光染色结果显示约80%的细胞角蛋白表达阳性,15%的细胞波形蛋白表达阳性[1]。本研究中,在细胞因子的协同作用下,共培养组8 d后即有约55.63%的细胞分化为子宫内膜上皮样细胞,显著地缩短了分化时间,提高了分化效率,进而为后续的研究打下良好的实验基础。分化效率的提高可能受以下两方面因素的影响:①动物源性饲养层细胞的存在有利于人胚胎干细胞干性的维持,但不利于人胚胎干细胞的分化。本研究中的培养方法是无饲养层培养,所以更利于分化;②传代操作可避免人胚胎干细胞在分化过程中与饲养层细胞或铺底层长时间接触,有助于人胚胎干细胞快速分化。本实验的分化方案虽然显著提高了分化效率,但也存在不足之处,培养体系中仍有动物源性成分存在(如FBS),今后的分化方案可以在本研究基础上进一步改进,使用人源性血清(如人脐带血清)代替FBS,从而避免动物源性成分的影响,使临床应用成为可能。
本研究证明,在与子宫内膜间质细胞共培养的条件下,无饲养层法培养的人胚胎干细胞向子宫内膜上皮方向分化。细胞分化方向的不同可能受培养环境中添加的细胞因子种类的影响。Yu等[2]研究添加的细胞因子为β-E2、EGF、TGF-α及PDGF-BB,子宫内膜间质细胞与hESCs共培养21 d后,16.9%的细胞分化为子宫内膜上皮样细胞。本实验添加的细胞因子种类及浓度与之相同,第8天时55.63%细胞分化为子宫内膜上皮样细胞。而Song等[1]研究添加的细胞因子为β-E2、EGF及PDGF-BB,共培养5周后,80%的细胞向子宫内膜上皮细胞分化,15%的细胞向子宫内膜间质细胞分化。在生理状态下,EGF、TGF-α及PDGF-BB均作用于人子宫内膜上皮和间质细胞,促进细胞增殖,而每种因子在分化过程中对分化方向的影响及作用目前尚未明确,应在后续实验中深入探讨。
总之,在与子宫内膜间质细胞共培养及细胞因子的共同作用下,无饲养层培养的人胚胎干细胞可在较短时间内高效向子宫内膜上皮细胞方向分化,为后续实验提供了较为理想的分化方案。

图1 各组细胞培养形态
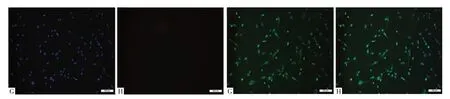
图2 子宫内膜间质细胞免疫荧光染色

图3 流式细胞学实验检测各组细胞分化率
