高角蛋白含量的角蛋白/PEO纳米纤维的制备及其性能表征
2016-02-05翟培羽雷通达王永恒曹福源
刘 雍,翟培羽,雷通达,王永恒,曹福源,范 杰
(1.天津工业大学 纺织学院,天津 300387;2.华北理工大学 冀唐学院医学实验中心,河北 唐山 063300)
高角蛋白含量的角蛋白/PEO纳米纤维的制备及其性能表征
刘 雍1,翟培羽1,雷通达1,王永恒2,曹福源2,范 杰1
(1.天津工业大学 纺织学院,天津 300387;2.华北理工大学 冀唐学院医学实验中心,河北 唐山 063300)
为探索以水为溶剂、由非交联改性角蛋白制备高角蛋白含量的角蛋白/PEO纳米纤维材料的方法,采用2-巯基乙醇/尿素/十二烷基硫酸钠混合体系提取高黏度人发角蛋白,将其与聚氧化乙烯(PEO)以不同质量分数混合,通过静电纺丝技术制备人发角蛋白/PEO纳米纤维并研究了其性能.结果表明:以巯基乙醇为还原剂提取的人发角蛋白溶液黏度较高,可以显著提高高比例角蛋白/PEO共混纺丝液的可纺性,制备的角蛋白/ PEO纳米纤维的最大质量分数可达到80/20;随着角蛋白含量增加,纳米纤维平均直径逐渐减小,直径分布变窄,平均直径从310 nm(角蛋白/PEO=30/70)减小到82 nm(角蛋白/PEO=90/10);共混纳米纤维光谱中,酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带的吸收峰强度均逐渐增大,PEO在1 092.86 cm-1处的吸收峰强度逐渐减弱,角蛋白质量分数达到80%时,PEO在960 cm-1和841 cm-1处的吸收峰消失;角蛋白能够阻碍PEO的结晶过程,并使PEO的熔融峰向高温偏移,同时PEO能够阻止角蛋白的自组装而形成更为稳定的二级结构,从而提高了共混纳米纤维的热性能.
人发角蛋白;聚氧化乙烯(PEO);纳米纤维;角蛋白含量
角蛋白是一种来源于羊毛、人发、羽毛、蹄、角的天然纤维状蛋白,具有良好的生物相容性和生物降解性,在过滤材料[1]、生物医用材料[2]等领域广为应用.但由于角蛋白难以单独纺丝,通常用于与其他天然或合成高聚物共混纺丝[3].提取角蛋白的方法有机械法[4]、氧化法[5]、还原法[6]、酸碱法[7]和离子液体法[8]等,目前国内外以还原法为主.2-巯基乙醇是一种常见的还原剂,能够有针对性的破坏角蛋白分子间的二硫键,达到溶解角蛋白的目的[9].
聚氧化乙烯(PEO)是一种具有水溶性和热塑性的线性高分子聚合物,它同时具有良好的生物相容性和可纺性,可用于与天然高分子材料共混制备生物纳米纤维材料.Aluigi等[10]采用亚硫酸氢盐还原剂提取角蛋白,以水为溶剂与PEO混合,通过静电纺丝方法制备角蛋白/PEO纳米纤维,角蛋白/PEO的最高质量比为70/30.Xing等[11]采用碘乙酸对2-巯基乙醇提取的角蛋白进行改性后与PEO共混于三氟乙酸中,制备出角蛋白/PEO质量比90/10的纳米纤维.本课题组[12]通过采用乙二醇二缩水甘油醚交联改性偏重亚硫酸钠提取的角蛋白,制备出角蛋白/PEO质量比为90/10的纳米纤维,并采用氧气交联法获得非水溶性的纳米纤维膜.
虽然采用有机溶剂作为纺丝溶剂和交联改性能够提高角蛋白/PEO纳米纤维中角蛋白的含量,但有机溶剂会造成环境污染,交联改性使得工艺复杂化及成本提高.因此,本文从改变蛋白提取的方法入手,选用2-巯基乙醇作为还原剂制备高黏度的人发角蛋白溶液,提高高角蛋白含量的角蛋白/PEO纺丝液的可纺性,采用未经交联处理的角蛋白与PEO共混,以水为溶剂,通过静电纺丝技术制备出了角蛋白/PEO质量比为80/20,具有良好形貌特征的角蛋白/PEO复合纳米纤维.将同类方法制备的角蛋白/PEO复合纳米纤维中角蛋白的比例由70%提高到80%.
1 实验部分
1.1 材料与仪器
所用原材料包括:人发纤维(理发店随机收集);PEO,Wt=40 ku.石油醚,尿素,天津市赢达稀贵化学试剂厂产品;十二烷基硫酸钠,天津市光复精细化工研究所产品;2-巯基乙醇,广东滃江化学试剂有限公司产品;氢氧化钠,天津市风船化学试剂科技有限公司产品.各试剂均为分析纯.
所用仪器包括:DXES-01型全自动静电纺丝机,上海东翔纳米科技有限公司产品;JJ-1型增力电动搅拌器,天津市华仪鑫达仪器仪表有限公司产品;HH-4型恒温水浴锅,金坛市科兴仪器厂产品;TGL-20M型离心机,湖南科技有限公司产品;RE-2000B型旋转蒸发仪,巩义市英峪高科仪器厂产品;SHZ-D(Ⅲ)型循环水真空泵,巩义市英峪高科仪器厂产品;DW-N33-1ACFO型高压直流电源,天津市东文高压电源厂产品;CVO-100-901型马尔文旋转流变仪,英国马尔文仪器有限公司产品;TM-1000台式扫描电子显微镜,日本日立公司产品;Nicolet iS10傅里叶变换红外光谱仪,美国Nicolet公司产品,D8DISCOVER GADDS型X射线衍射仪,美国BRUKER AXS公司产品.
1.2 人发角蛋白的提取
(1)人发预处理:将人发纤维剪成5~10 mm的小段,用石油醚浸泡人发30 min左右去除纤维表面的杂质及油脂,随后用蒸馏水洗净残留的石油醚,自然晾干备用.
(2)还原法溶解人发纤维:取一定量的2-巯基乙醇、十二烷基硫酸钠(SDS)、尿素加入到200 mL的去离子水中,搅拌溶解后,用1 mol/L的氢氧化钠调节至pH=9后,加入一定量的人发纤维在65℃的恒温水浴锅中搅拌反应12 h.
(3)角蛋白的提取.过滤得到角蛋白的粗溶液,将其在含有0.1%2-巯基乙醇的去离子水中透析36 h,透析袋截留分子质量为8~1.4 ku),每12 h换一次水.透析后,通过离心去除沉淀物质得到角蛋白澄清溶液,而后再用旋转蒸发仪浓缩得到高黏度的角蛋白溶液.
1.3 静电纺丝
(1)纺丝液的制备:为了探究PEO含量对溶液纺丝性能的影响,先称取一定量的角蛋白浓溶液,然后按照角蛋白/PED质量比为30/70、40/60、50/50、60/40、70/30、80/20及90/10将PEO粉末加入到称量好的角蛋白溶液中进行共混,密封条件下搅拌至PEO粉末完全溶解.
(2)纳米纤维膜的制备.将不同混纺比的人发角蛋白/PEO混合纺丝液分别吸入到5 mL的注射器(针头规格:20号平头)中,将注射器固定在微量注射泵上,选择纺丝参数电压20 kV,接收距离15 cm,灌注量0.5 mL/h制备纳米纤维.纺丝过程中将铝箔固定在滚筒上进行接收.
1.4 表征方法
(1) 纺丝液的流变性能.采用CVO-100-901型马尔文旋转流变仪,直径为40 mm、锥角为2°的锥板,测试不同质量比角蛋白/PEO混合纺丝液的流变性能.剪切率测试范围0~100 s-1,温度25℃.
(2)纤维外观形貌:采用TM-1000台式扫描电子显微镜观察各共混纳米纤维的形貌.利用图像分析软件Image-Pro Plus 6.0对纳米纤维的直径进行测量和统计.
(3)傅里叶红外光谱分析:采用Nicolet iS10傅里叶变换红外光谱仪对不同质量比的角蛋白/PEO纳米纤维膜的红外光谱进行测试,波长范围4 000~400 cm-1.所有样品在测试前放入真空干燥箱中进行干燥处理.
(4)X—射线衍射分析:采用D8DISCOVER with GADDS型X射线衍射仪对纳米纤维膜的X射线衍射光谱进行测试.测试条件:氮气保护,Cu靶(λ=0.154 6 nm),扫描范围2θ=5°~40°,测试电压40 kV,电流40 mA,扫描速率8°/min.
(5)差示扫描量热分析:采用DSC 200 F3型差示扫描量热仪测试纳米纤维的热性能.测试条件:氮气保护,升温范围20~350℃,升温速率10℃/min.
2 结果与讨论
2.1 角蛋白溶液及纺丝液流变性能的表征
分别对以2—巯基乙醇和偏重亚硫酸钠提取的角蛋白进行流变性能测试,2种角蛋白溶液的质量分数均为12%,测试结果如图1所示.
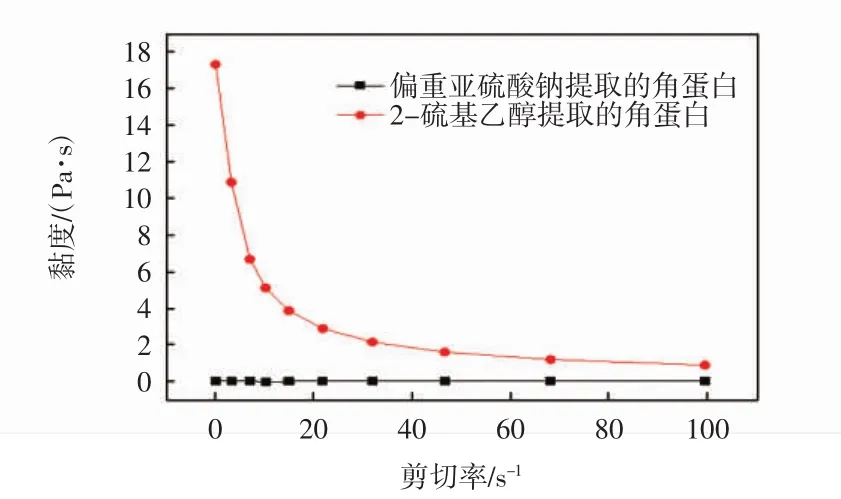
图1 不同还原剂提取的角蛋白的黏度对比Fig.1 Viscosity comparison of keratin extracted with different reducing agents
由图1可以明显看出,2—巯基乙醇提取的角蛋白溶液具有明显的剪切稀化现象,溶液的黏度随着剪切率的增大显著降低;偏重亚硫酸钠提取的角蛋白的黏度很稳定,随剪切率的增大几乎没有变化.巯基乙醇提取的角蛋白的黏度明显大于偏重亚硫酸钠提取的角蛋白的黏度.
测试溶质质量分数为12.5%时的不同角蛋白/PEO共混比例纺丝液的流变性能,结果如图2所示.

图2 不同角蛋白/PEO混合比纺丝液的黏度Fig.2 Viscosity of keratin/PEO blended solution with different keratin/PEO ratios
纺丝液黏度是影响静电纺纳米纤维形貌的重要因素[13-14].图2表明,不同混化角蛋白/PEO共混纺丝液的黏度都随着剪切速率的增大而降低,这是由于剪切率较大时剪切应力大于分子之间的缠结力[10].混合溶液的流变性能随着2种组分含量的变化而变化,PEO含量相对较高时,纺丝液的黏度较高,溶液的剪切稀化现象明显,随着混合溶液中PEO含量的降低,剪切稀化现象慢慢变弱后消失.
2.2 纤维形貌及纤维直径分布
不同质量比角蛋白/PEO纳米纤维及直径分布情况如图3,纳米纤维的直径与角蛋白含量的关系如图4.
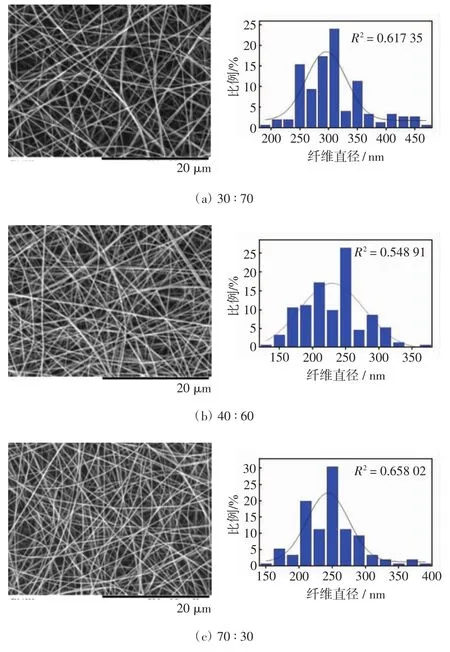
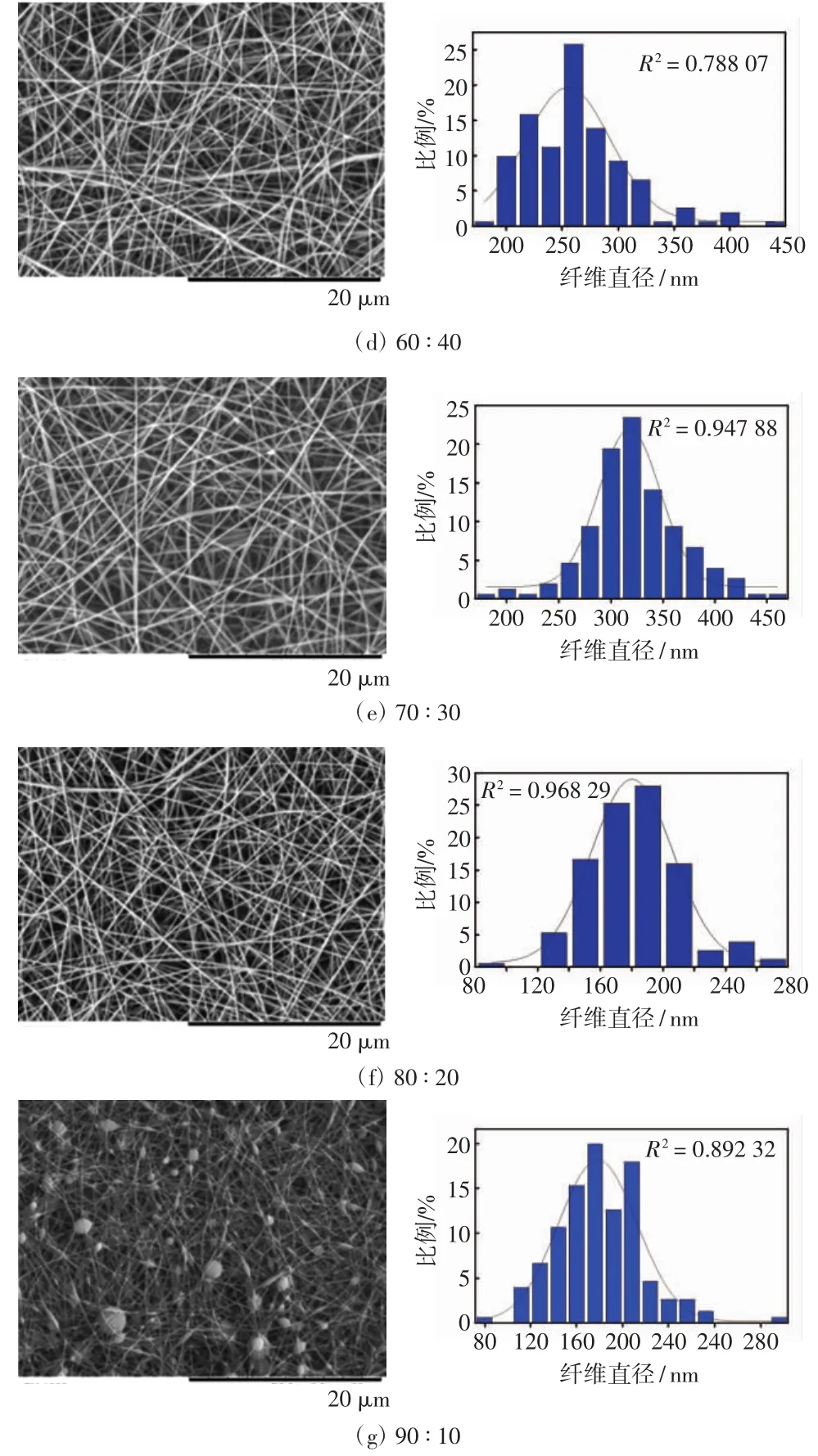
图3 不同比例角蛋白/PEO共混纳米纤维的电镜图片及直径分布图Fig.3 SEM micrograph and diameter distributions of keratin/PEO blend nanofibers

图4 角蛋白/PEO纳米纤维的直径与角蛋白质量分数的关系图Fig.4 Keratin/PEO blend ratio in solution vs nanofiber diameter
由图3可以看出,当纺丝液中角蛋白的质量比在30%~80%范围内时,能够获得形貌特征良好的纳米纤维,这是由于PEO的含量较高,PEO黏度大,其加入可有效提高共混纺丝液的可纺性.当角蛋白质量分数提高到90%时,获得的纳米纤维带有大量的串珠,串珠之间的纳米纤维是光滑、连续的,这是由于角蛋白的可纺性差,PEO含量较低时难以改变共混纺丝液的可纺性.从直径分布图上来看,随着角蛋白比例的提高,纳米纤维直径的分布越来越窄,即纳米纤维的均匀度越来越高.
从图4可以看到,随着角蛋白/PEO质量比的提高,纳米纤维的平均直径和标准偏差逐渐减小,平均直径由310 nm减小到82 nm.当角蛋白/PEO的比例为90/10时,纤维直径最小且分布较均匀(串珠部分除外).这是因为随着人发角蛋白/PEO混合溶液中角蛋白含量的增加,纺丝液的黏度降低,分子间的离散程度增大而使分子之间的纠缠力减弱,在静电纺丝过程中施加相同电压情况下携带的电荷量增加,纺丝液在电场的作用下容易被电离而产生拉伸,从而形成较细的纳米纤维.
因此,共混纺丝液中PEO含量的下降使得纺丝液的黏度降低,可纺性下降.但由于巯基乙醇提取所得的角蛋白黏度较大,因此能够在非交联改性条件下获得角蛋白的最高质量分数为80%,具有良好形貌特征的角蛋白/PEO纳米纤维.
2.3 傅里叶红外光谱分析
人发纤维和人发角蛋白粉末的红外光谱如图5所示.

图5 人发纤维和角蛋白的粉末红外光谱Fig.5 FTIR spectra of human hair and keratin
由图5的红外光谱可以看出,人发纤维和提取的角蛋白粉末都出现了多肽链的基本单位——肽键(—CONH—)引起的特征吸收带,都具有明显的酰胺A带、酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带的特征吸收峰,说明这两者的红外光谱属于典型的蛋白质谱图[15],同时也说明在溶解的过程中,角蛋白的大分子结构没有发生明显的改变.
人发纤维在酰胺A带3 269 cm-1处的吸收峰是由N—H键伸缩振动与酰胺Ⅱ带第一倍频共振引起的;酰胺Ⅰ带1 635 cm-1处出现的尖锐吸收峰是由C—O键伸缩振动引起的.酰胺Ⅱ带N—H弯曲振动和C—H伸缩振动吸收峰位于1 516 cm-1处;酰胺Ⅲ带1 231 cm-1处的吸收峰是由C—N伸缩振动和N—H面内弯曲振动交替组合产生的,也有部分来源于C=O的弯曲振动和C—C的伸缩振动[16].
与人发纤维相比,角蛋白粉末的谱图在各个特征吸收峰的强度都有所增加,说明各个特征吸收带的振动强度变大,角蛋白处于较高的能量级.角蛋白在酰胺Ⅰ带的特征峰向高波数偏移,说明角蛋白二级结构产生了一定程度的变化.酰胺Ⅱ带的吸收峰稍有移动,这可能是头发在溶解过程中,二硫键的破坏与重建及角蛋白空间结构的变化,导致C—H伸缩振动和N—H的弯曲振动发生变化.
此外,角蛋白粉末在1 052 cm-1处出现新的较为尖锐的吸收峰,表明角蛋白粉末中存在一定量的胱氨酸氧化物[17].
由图5可知,人发纤维在2 960 cm-1处较为弱的吸收峰是由CH3(CH2)中C—H的对称和不对称伸缩振动产生的,而在角蛋白粉末的红外光谱图中,此峰向低波长2 924 cm-1处移动,同时该吸收峰的强度得到了加强.这是由于在人发纤维溶解过程中角蛋白分子的双硫键(—CH2—S—S—CH2—)被拆开,C—H的极性增强使振动谱带移向低波长[18].
对不同混纺比的角蛋白/PEO纳米纤维膜进行红外光谱测试,结果如图6所示.

图6 人发角蛋白/PEO共混纳米纤维的红外光谱Fig.6 FTIR spectra of keratin/PEO blend nanofibers
由图6的红外光谱可以看出,PEO粉末在小于1 500 cm-1波数部分出现了典型的指纹区,其中最明显的吸收峰是位于1 144.62 cm-1、1 092.86 cm-1和1 059.93 cm-1处的三重峰,该峰是由PEO分子链中的C—O—C伸缩振动引起的[19],其中以1092.86cm-1处的吸收峰强度最大.960 cm-1和841 cm-1处的吸收峰与PEO的平面结构有关,1 240 cm-1处的过渡峰对应螺旋构象[20].
在角蛋白/PEO共混纳米纤维的红外光谱中,包含了PEO和人发角蛋白2种物质的特征吸收峰.当PEO含量较高时,角蛋白酰胺Ⅲ带的吸收峰很弱.随着角蛋白比例的增加,共混纳米纤维光谱中,酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带的吸收峰强度均逐渐增大,PEO在1 092.86 cm-1处的吸收峰强度逐渐减弱.角蛋白质量分数达到80%时,PEO在960和841 cm-1处的吸收峰消失.
值得注意的是,随着角蛋白比例的增加,角蛋白/ PEO纳米纤维在酰胺A带3 286 cm-1左右的吸收峰向低波数处移动,并变宽变强.
2.4 X-射线衍射分析
图7所示为人发角蛋白/PEO共混纳米纤维的X-射线衍射图.
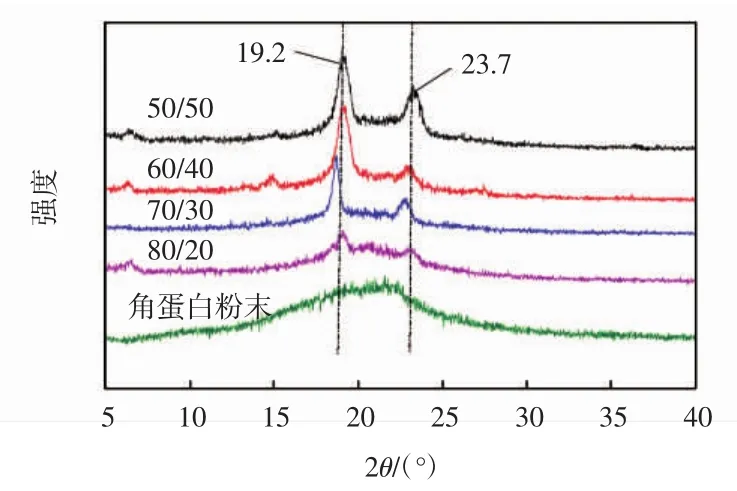
图7 不同比例人发角蛋白/PEO共混纳米纤维的XRD图像Fig.7 X-ray diffraction of keratin powders and keratin/PEO blend nanofibers with different ratioes
由图7可以看出,人发角蛋白粉末在2θ为9.5°附近有一个很弱的衍射峰,对应α-螺旋结构,20.5°附近有一个较强的衍射峰,对应β-折叠结晶结构.有文献表明[21],PEO粉末在19.2°和23.7°处存在2个极强的衍射峰.角蛋白/PEO共混纳米纤维的衍射图中对应于α-螺旋结构的衍射峰消失,而对应于角蛋白β-折叠结晶结构的衍射峰随角蛋白含量增加逐渐增强;同时,PEO的衍射峰强度逐渐减弱.当PEO含量很高时,纳米纤维膜的衍射图像以PEO型为主;随着角蛋白含量增加,衍射图像由PEO型转向角蛋白型.
2.5 差示扫描量热分析
图8所示为人发角蛋白/PEO共混纳米纤维的DSC曲线.
由文献[22]可知,PEO的熔融发生在60.7~71.5℃,故图8中的吸热峰对应PEO结晶相的熔融峰.由图8可以看出,随着PEO含量的减少,PEO的熔融峰逐渐降低,同时,熔融温度逐渐升高,PEO质量分数为50%时的熔融温度为64℃,质量分数为40%时的熔融温度为62℃,质量分数为30%时的熔融温度为61℃.当PEO含量很低时,PEO的熔融峰基本消失,说明角蛋白的存在阻碍了PEO的结晶过程.100℃左右较小的吸热峰为样品中水分的蒸发所致.250℃附近的转变峰为α-螺旋变性峰[23];277℃左右的吸热峰对应β-折叠结构的变性[24].
由图8还可以看出,随着PEO含量的增加,β-折叠结构的变性温度向高温处移动,说明PEO能够打破角蛋白的自组装结构形成结构更为稳定的二级结构,即提高混合纳米纤维膜的热稳定性.

图8 不同比例人发角蛋白/PEO共混纳米纤维的DSC曲线Fig.8 DSC curses for human hair keratin/PEO blended nanofibers with different ratioes
3 结论
(1)采用2-巯基乙醇还原法提取的人发角蛋白溶液具有较高的黏度,能在非交联改性条件下,以水为溶剂与PEO共混制备共混纳米纤维.当角蛋白/PEO共混比例为80∶20时,角蛋白/PEO共混纳米纤维具有良好的形貌特征.
(2)共混纺丝液的黏度随着角蛋白含量的增加而降低,纺丝液由非牛顿流体特征转变为牛顿流体特征,剪切稀化现象消失.
(3)角蛋白/PEO共混纳米纤维的直径随角蛋白含量增加逐渐减小,直径分布变窄,标准偏差降低,纤维的均匀度提高.纳米纤维的平均直径从310 nm(角蛋白/PEO=30/70)逐渐减小到82 nm(角蛋白/PEO= 90/10).
(4)随着角蛋白比例的增加,纳米纤维红外光谱中角蛋白酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带的吸收峰强度均逐渐增大,而PEO在1 092.86 cm-1处的吸收峰强度逐渐减弱,共混纳米纤维膜在3 286 cm-1左右的吸收峰向低波数处移动,并变宽变强.
(5)角蛋白/PEO共混纳米纤维的结晶结构随角蛋白含量的增加由PEO型向角蛋白型转变.
(6)角蛋白能够阻碍PEO的结晶过程,并使PEO的熔融峰向高温偏移;同时,PEO的加入能够打破角蛋白的自组装结构形成结构更为稳定的二级结构,从而提高了混合纳米纤维膜的热稳定性.
[1]BARHATE R S,LOONG C K,RAMAKRISHNA S.Preparation and characterization of nanofibrous filtering media[J]. Journal ofMembrane Science,2006,283(1/2):209-218.
[2]DEITZEL J M,KOSIK W,MCKNIGHT S H,et al.Electrospinningofpolymernanofibers with specific surface chemistry[J]. Polymer,2002,43(3):1025-1029.
[3]ROUSE J G,VAN DYKE M E.A review ofkeratin-based biomat-erials for biomedical applications[J].Materials,2010,3(2):999-1014.
[4]陈莹,王宇新.角蛋白及其提取[J].材料导报,2002,16(12):65-67. CHEN Y,WANG Y X.Keratin and extraction[J].Materials Review,2002,16(12):65-67(in Chinese).
[5]TIMMONS S F,BLANCHARD C R,SMITH R A.Method of making and cross-linking keratin-based films and sheets:US,6124265[P].2000-01-01.
[6]徐博.羊毛角蛋白的溶解及其溶液特性的研究[D].西安:西安工程科技学院,2003. XU B.Study on the solubility and solution properties of wool keratin[D].Journal of Xi'an Polytechnic University,2003(in Chinese).
[7]姚金波,何天虹.羊毛角蛋质溶液的制备[J].毛纺科技.2003(4):16-20. YAO J B,HE T H.Preparation of wool keratin solution[J]. Wool Textile Journal,2003(4):16-20(in Chinese).
[8]WANG Y X,CAO X J.Extracting keratin from chicken feathers by using ahydrophobic ionic liquid[J].Process Biochemistry,2012(47):896-899.
[9]YAMAUCHI K,YAMAUCHI A,KUSUNOKI T,et al.Preparation of stable aqueous solution of keratins,and physiochemical and biodegradational properties of films[J].Journal of Biomedical Materials Research,1996,31(4):439-444.
[10]ALUIGI A,VINEIS C,VARESANO A,et al.Structure and properties of keratin/PEO blend nanofibres[J].European Polymer Journal,2008,44(8):2465-2475.
[11]XING Z C,YANG J,CHAE W P,et al.Keratin nanofiber as a biomaterial[C]//Int Conf Nanotechnology and Biosensors.2011:120-124.
[12]LIU Y,YU X,LI J,et al.Fabrication and properties of high-contentkeratin/poly(ethyleneoxide)blendnanofibersusingtwostep cross-linking process[J].Journal of Nanomaterials,2015,Article ID 803937.
[13]LIU Y,HE J H,YU J,et al.Controlling numbers and sizes of beads in electrospun nanofibers[J].Polymer International,2008,57(4):632-636.
[14]LIU Y,DONG L,FAN J,et al.Effect of applied voltage on diameter and morphology of ultrafine fibers in bubble electrospinning[J].Journal of Applied Polymer Science,2011,120(1):592-598.
[15]张林,朱平,徐江涛,等.人发角蛋白溶液的制备及其性能研究[J].青岛大学学报:工程技术版,2015,30(1):88-91. ZHANG L,ZHU P,XU J T,et al.Preparation and characterization of human hair keratin solution[J].Journal of Qingdao University:Engineering and Technology Edition,2015,30(1):88-91(in Chinese).
[16]PATRUCCO A,ALUIGI A,VINEIS C,et al.Bio-composite keratin films from wool fibrillation[J].Journal of Biobased Materials and Bioenergy,2011,5:124-131.
[17]MARINA Z,ANNALISA A,CLAUDIO T.Characterisation of keratin biomass from butchery and wool industry wastes[J]. Journal of Molecular Structure 2009,36:35-40.
[18]陈莉萍,于伟东.羊毛及其角朊膜显微镜傅里叶红外光谱对比分析[J].东华大学学报:自然科学版,2006,32(4):105-108. CHEN L P,YU W D.Contrastive analysis of microscope-fourier transform infrared spectroscopy of wool and its keratin membranes[J].Journal of Donghua University:Natural Science Edition,2006,32(4):105-108(in Chinese).
[19]SOW W T,LUI Y S,NG K W.Electrospun human keratin matrices as templates for tissue regeneration[J].Nanomedicine,2013,8(4):531-541.
[20]ALUIGI A,VARESANO A,MONTARSOLO A,et al.Electrospinning of keratin/poly(ethylene oxide)blend nanofibers[J]. Journal of Applied Polymer Science,2007,104(2):863-870.
[21]史铁钧,周玉波,廖若谷,等.电纺聚氧化乙烯纤维的分散形态和结晶行为研究[J].高分子学报,2005(5):760-763. SHI T J,ZHOU Y B,LIAO R G,et al.Study on the dispersion morphology and crystallization behavior of electrospun polye-thyleneoxidefibers[J].ActaPolymericaSinica,2005(5):760-763(in Chinese).
[22]HEN ZS C N,SZTATISZ J,BENE O.Thermal characterization of hair using tg-ms combined thermoanalyticaltechinique[J]. Journal of Thermal Analysis and Calorimetry,2004,78:427-440.
[23]SPEI M,HOLZEM R.Thermoanalytical investigations of extendedandannealedkeratins[J].ColloidPolymSci,1987,265:965-970.
[24]YAMAUCHI A,YAMAUCHI K.Formation and properties of wool keratin films and coatings[C]//ARISTIPPOS G.Protein-Based Films And Coatings.Washington(DC):CRC Press,2002:253-273.
Fabrication and properties of high-content keratin/poly(ethylene oxide)blend nanofibers
LIU Yong1,ZHAI Pei-yu1,LEI Tong-da1,WANG Yong-heng2,CAO Fu-yuan2,FAN Jie1
(1.School of Textile,Tianjin Polytechnic University,Tianjin 300387,China;2.Medical Experiment Center of Ji Tang College,North China University of Science and Technology,Tangshan 063300,Hebei Province,China)
To prepare uncrosslinked high-content keratin/PEO nanofibers with water as solvent,human hair keratin was extracted by 2-mercaptoethanol/urea/sodium dodecyl sulfate mixed system and blended with polyethylene oxide(PEO)with different mass ratios,and then keratin/PEO nanofibers were prepared by electrospinning.The results showed that the human hair keratin solution extracted with mercaptoethanol as reducing agent has higher viscosity,which can significantly improve the spinnability of high proportion keratin/PEO blended spinning solution. The maximum mass ratio of keratin/PEO can reach 80/20 without crosslinking modification.With the increase of keratin content,the average diameter of nanofibres decreased and the diameter distribution became narrower. The average diameter of nanofibers decreased from 310 nm (keratin/PEO=30/70)to 82 nm (keratin/PEO=90/ 10).In the blended nanofiber spectrum,the absorption peak intensity of keratin in the amide I band,amideⅡband and amideⅢband increased gradually,and the absorption peak intensity of PEO at 1 092.86 cm-1decreased gradually.The absorption peaks of PEO at 960 cm-1and 841 cm-1disappeared when the keratin content reached 80%.PEO could break the self-assembled structure of keratin to form a more stable secondary structure,thereby improving the thermal properties of blended nanofibers.
human hair keratin;polyethylene oxide(PEO);nanofibers;keratin content
TS102.65
A
1671-024X(2016)06-0001-07
10.3969/j.issn.1671-024x.2016.06.001
2016-10-24
国家自然科学基金面上资助项目(51573133);教育部新世纪优秀人才支持计划资助项目(NCET-12-1063);天津市自然科学基金面上资助项目(14JCYBJC17600);全国优博论文作者专项基金资助项目(201255);国家级大学生创新训练资助项目(201510058056).
刘 雍(1979—),男,博士,副教授,研究方向为纺织新材料与新技术.E-mail:liuyong@tjpu.edu.cn
