基于三羧基乙基磷的羊毛角蛋白提取及其性能
2015-10-27王闻宇马玉单陈立娟何雅僖肖长发
王闻宇 ,马玉单 ,陈立娟 ,何雅僖 ,金 欣 ,肖长发
(1.天津工业大学材料科学与工程学院,天津 300387;2.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津 300387)
角蛋白是羊毛的主要成分,羊毛中的角蛋白是可再生蛋白的重要来源.再生角蛋白有许多优质的特性,可应用于不同的领域.Akira Tachibana[1]将角蛋白海绵结构浸泡在含钙和磷酸盐离子的缓冲液中培养L-929细胞,一周后发现细胞无变异,可用于生物医用材料;王江波等[2]和Kawahara[3]均将角蛋白作为功能整理剂,对涤纶织物或棉织物进行亲水整理,处理后的织物手感柔软,具有很好的悬垂性能及吸湿功能;Aluigi[4]利用角蛋白吸附重金属离子、甲醛及其他挥发性有机化合物.
羊毛角蛋白中含有离子键、氢键、疏水键、二硫键等,其中二硫键是角蛋白折叠和结构稳定性的基础[5-6],因此溶解羊毛提取角蛋白的关键是破坏羊毛中的二硫键.常见的溶解羊毛提取角蛋白的方法有氧化法[7]、离子溶液法[8]及还原 A、B、C[9]等.最近,有一种新的还原剂三羧基乙基磷(TCEP)被用于羊毛角蛋白的溶解[10],与传统还原剂相比,TCEP对二硫键有极强的选择还原性[11],能得到分子质量集中在9.5~22.0 KD的不溶于水的角蛋白.而传统的羊毛溶解工艺得到的角蛋白均是水溶性蛋白,限制了角蛋白在重金属吸附、超吸水等方面的应用.
本文分别采用TCEP和NaHSO3提取羊毛角蛋白,对2种方法所提取角蛋白的相对分子质量、结构及热稳定性进行分析,并制备角蛋白(TCEP法提取)/聚乙烯醇复合膜,考察复合膜的吸水性.
1 实验部分
1.1 材料与仪器
所用原材料包括:羊毛,型号为DH1126,常州毛条厂产品;TCEP溶液,质量分数35%,联宽精细化学品有限公司产品;十二磺基磺酸钠(SDS),质量分数≥59%,天津市精细化工研究所产品;亚硫酸氢钠(NaHSO3),分析纯,天津市精细化工研究所产品;尿素,分析纯,天津市精细化工研究所产品;3500D型透析袋,Solarbio公司产品;乙酸,分析纯,天津市化学试剂三厂产品;聚乙烯醇(PVA),聚合度为 1750±50,天津市光复精细化工研究所产品,二甲基亚砜(DMSO),分析纯,天津精细化工研究所.
所用仪器包括:Nicolet iS10型红外光谱仪,美国Thermo Nicolet公司产品;DYY-16D型凝胶电泳仪,北京六一仪器厂产品;TG209F3型热重分析仪,德国Netzsch公司产品;BX51型偏光显微镜,日本Olympus公司产品.
1.2 羊毛角蛋白提取
(1)TCEP法:将羊毛剪碎至1 cm左右,取一定质量的碎羊毛溶解于装有TCEP溶液的烧杯中,浴比为1∶15;再向其中充入氮气,在90℃恒温水浴中加热12 h;将反应后的羊毛溶液抽滤,液体放入透析袋中,然后置于去离子水中透析,每隔3 h换一次水,36 h后离心、冷冻干燥得到角蛋白.
(2)NaHSO3法:称取0.05 mol/L的SDS和5 mol/L的NaHSO3倒入7 mol/L的尿素水溶液中,混合均匀;将羊毛剪碎至1 cm左右,并置于混合液烧杯中,浴比为1∶20;再向其中充入氮气,放于90℃恒温水浴中加热5 h;将反应后的羊毛溶液抽滤,液体放入透析袋中,然后置于去离子水中透析,每隔3 h换一次水,36 h后用乙酸滴定至白色不再增加,然后离心、冷冻干燥得到角蛋白.
1.3 角蛋白/PVA复合膜的制备
称取一定量TCEP法提取的非水溶性蛋白,与质量分数为8%的PVA水溶液共混,角蛋白与PVA质量比为1∶1.60℃恒温加热2 h,静置一段时间后迅速流延制膜;在60℃烘箱中干燥5 h后揭膜.
1.4 性能表征与测试
(1)傅里叶变换红外光谱分析(FTIR):采用Nicolet iS10型红外光谱仪在波数为650~4000 cm-1范围内,对羊毛纤维、TCEP法和NaHSO3法分别提取的角蛋白做红外光谱分析.
(2)SDS-PAGE分子质量测试:采用DYY-16D型凝胶电泳仪对TCEP法和NaHSO3法提取的角蛋白原液进行分子量测试.分离胶质量分数15%,浓缩胶质量分数 5%,上样 10 μL,取过滤后的溶液 3 μL,样品稀释液7 μL.电压80 V,用考马斯蓝R-250染色.
(3)TG热失重分析:采用TG209F3型热重分析仪以10℃/min的升温速率在20~800℃内对羊毛纤维及TCEP法和NaHSO3法分别提取的角蛋白的热稳定性进行对比.
(4)溶解性分析:采用BX51型偏光显微镜观察TCEP法和NaHSO3法分别提取的角蛋白在DMSO溶液中的溶解性,即将2种方法提取的角蛋白粉末分别与DMSO按质量比1∶11.5混合均匀后,取少量溶液放置在显微镜热台上,调整热台升温速率为5℃/min,升温范围30~60℃,观察溶解现象.
(5)不同温度下角蛋白/PVA复合膜的吸水性能测试:将已知质量(m1)的复合膜放入20℃去离子水中浸泡1 h后,再分别转入30、40和50℃去离子水中浸泡0.5 h后取出复合膜,用滤纸吸去表面水后称重(mt).计算样品的吸水率(Q):[12]

2 结果与讨论
2.1 红外光谱分析
对羊毛、TCEP法和NaHSO3法分别提取的角蛋白进行傅里叶红外光谱分析,如图1所示.

图1 羊毛及角蛋白的红外谱图Fig.1 IR spectra of wool and keratin
由图1可见,羊毛及羊毛提取物的红外谱图都属于典型的蛋白类红外光谱图,即具有明显的氢键、肽键、酰胺Ⅰ、Ⅱ、Ⅲ带的特征.根据文献[13-16]可知:在波数3090 cm-1附近原毛和羊毛的提取物均出现明显的吸收峰,这是多肽(—CONH—)的特征吸收峰,证明了TCEP法和NaHSO3法对羊毛酰胺键的影响不大.羊毛在红外光谱中2973 cm-1处较弱的吸收峰是C—H的伸缩振动谱带,TCEP法和NaHSO3法提取的角蛋白的C—H吸收峰在2960 cm-1处,这是由于二硫键在溶解的过程中发生断裂,使C—H的极性增强,从而使C—H吸收峰的位置向低波数移动.原毛的酰胺Ⅲ吸收峰为1235 cm-1,TCEP法和NaHSO3法提取的角蛋白的酰胺Ⅲ吸收峰分别为 1242 cm-1、1230 cm-1,酰胺Ⅲ带由N—H弯曲振动和C—N的伸缩振动产生,偏重C—N伸缩振动[17],而羊毛、TCEP法和NaHSO3法提取的角蛋白在酰胺Ⅲ带差别细小,说明在进行羊毛溶解时,羊毛大分子链间的化学键保持完整,HN键振动变化不明显,也就是说采用TCEP法和NaHSO3法溶解羊毛可以制得分子质量相对较高的角蛋白[18].
2.2 羊毛角蛋白液的SDS-PAGE电泳分析
图2所示为角蛋白的分子质量分布图.
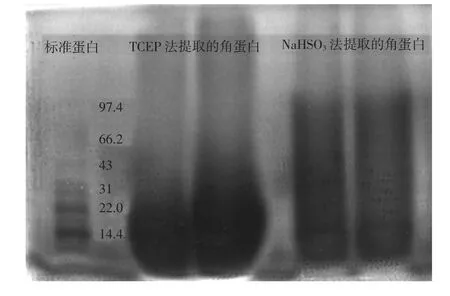
图2 2种方法提取的角蛋白分子质量分布Fig.2 Molecular weight distribution of keratin extracted by two kind of methods
由图2可知,TCEP法提取角蛋白的分子质量比较集中,角蛋白的分子质量分布在9.5~43 KD之间,主要集中在9.5~22 KD之间.NaHSO3法角蛋白分子质量分布很宽,在9.5~97.4 KD均有分布,在14.4 KD处有一条比较深的线条,说明最为集中在14.4KD分子质量处.
角蛋白经水解可以成为分子质量较小的系列中间产物直至氨基酸,在一定条件下得到的角蛋白实际上是各种中间产物和最终产物组成的混合体.羊毛角蛋白分为中长蛋白(分子质量45~60 KD)、高或超高硫蛋白(分子质量10~40 KD)、高-氨基乙酸-酪氨酸蛋白(分子质量10 KD)3类.NaHSO3法提取的角蛋白中有超过60 KD的蛋白,是由于使用NaHSO3作为还原剂时,存在可逆反应RSSR⇌2RSH,羊毛中的二硫键有90%被打开时,羊毛就被溶解[19].因此溶解的羊毛溶液中可能存在少量的二硫键未被打开,这些未断开的二硫键使部分的肽链相连,使电泳得到的角蛋白分子质量大于羊毛蛋白分子质量.TCEP法制得的角蛋白的相对分子质量集中在9.5~22 KD之间(<60 KD),说明TCEP法更能有效的断开二硫键,最终蛋白质中含有氨基酸、多肽等较低分子质量的物质.
2.3 TG热重分析
对2种提取方法所获得的角蛋白进行热重分析,结果如图3所示.
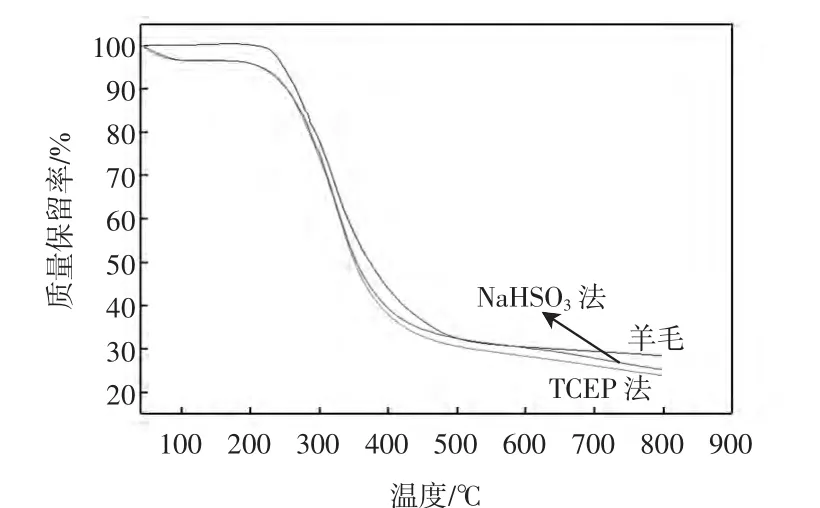
图3 羊毛及角蛋白的TG曲线Fig.3 TG cuves of wool and keratin
由图3可知,TCEP法和NaHSO3法分别提取的角蛋白在46℃附近有一个明显的失重,到90℃时重量达到一个初步稳定的阶段,这个过程可能是水分蒸发造成的,TCEP法和NaHSO3法分别提取的角蛋白有相同的热失重率.羊毛、TCEP法和NaHSO3法提取角蛋白的初始分解温度均在230℃附近,而且羊毛的初始分解温度比角蛋白的高,这是由于羊毛的结构比角蛋白的更加紧密,羊毛在溶解过程中二硫键被打开,空间立体结构被破坏,同时部分α-螺旋结构变为β-折叠结构,角蛋白的结构较松散,因此热稳定性下降.羊毛的最终质量保留率比角蛋白的要高,这可能是由于角蛋白中结晶α-螺旋结构的减少和β-折叠、无规则卷曲结构的增加造成的.TCEP法提取的角蛋白比NaHSO3法提取的角蛋白的质量保留率要低,说明了TCEP法制得的角蛋白中β-折叠和无规则卷曲结构比NaHSO3法制得的角蛋白中的增加的多,即TCEP法能更有效地破坏羊毛的螺旋结构和提取角蛋白.
2.4 角蛋白的溶解过程
角蛋白在DMSO中的溶解情况如图4所示.
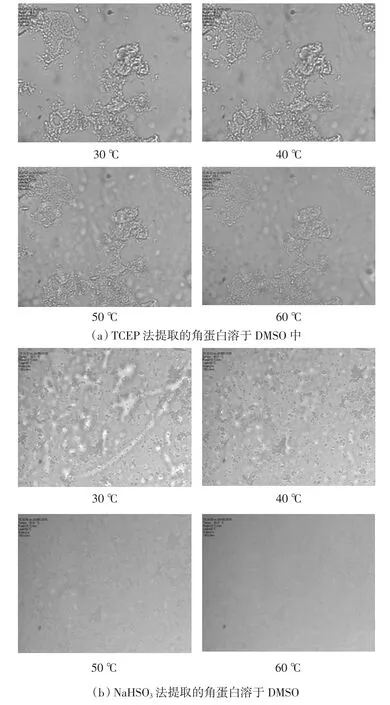
图4 角蛋白在DMSO中的溶解现象Fig.4 Phenomena of keratin in DMSO solution
水溶性及非水溶性的角蛋白在DMSO溶剂中均有很好的可溶性,在60℃左右几乎全部溶解.由图4可以看出,NaHSO3法提取的角蛋白在40℃开始溶解,60℃时几乎完全溶解于DMSO溶剂,而TCEP法提取的角蛋白在50℃才开始溶解,60℃时只有少量的角蛋白溶于DMSO溶剂,这说明TCEP法提取的角蛋白与NaHSO3法提取的角蛋白不相同.
2.5 复合膜的吸水性
图5所示为温度对角蛋白/PVA复合膜吸水率的影响.

图5 温度对膜吸水率的影响Fig.5 Influence of temperature on membrane water absorption
由图5可知,当温度从40℃升至50℃时,PVA膜和复合膜的吸水率均有大幅提高,这是由于PVA膜和复合膜在较高温度的蒸馏水中能更好地舒展开,大量的亲水集团暴露,使得膜的吸水率大幅提高.膜中具有的亲水基团的亲水性越强则复合膜的亲和力越大,吸水倍率也就越高,亲水基团亲水力:—SO3H>—COOH>—CONH2>—OH.角蛋白中含有大量的酰胺键和羟基,而且酰胺键的亲水性要高于羟基,也就是角蛋白的亲水性要高于PVA,因此复合膜的吸水率高于PVA膜.
3 结论
(1)TCEP和NaHSO3这2种还原剂均可以溶解羊毛,提取角蛋白.TCEP法能更有效的打开羊毛中的二硫键,提取的角蛋白分子量较集中,而NaHSO3与羊毛反应时存在可逆反应,二硫键并没有全部打开,因此角蛋白的分子量分布较宽.
(2)TCEP法提取的角蛋白微溶于DMSO溶液,可见TCEP法提取的角蛋白与NaHSO3法提取的角蛋白不完全相同.
(3)复合膜在水中的稳定性较好,其吸水性随温度的变化而变化,具有一定的温度敏感性.制得的角蛋白/PVA复合膜可进一步研究其力学性能,以应用于重金属吸附、药物缓释等领域.
[1]TACHIBANA A,FURUTA Y H,TANABE T,et al.Fabrication of wool keratin sponge scaffolds for long-term cell cultivation[J].Journal of Biotechnology, 2002,93(2):165-170.
[2]王江波,刘建勇,张玉荣,等.羊毛角蛋白溶液对涤纶织物的整理[J].印染助剂, 2011,28(11):36-38.
[3]KAWAHARA Y.Chemical modification of cotton fabrics with water soluble silk fibroin[J].Fiber, 1998,54(2):122-125.
[4]ALUIGI Annalisa, VINEIS Claudia, VARESANO Alessio, et al.Structure and properties of keratin/PEO blend nanofibres[J].European Polymer Journal, 2008,44(8): 2465-2475.
[5]WEDEMEYER W J, WELKER E, NARAYAN M, et al.Disulfide bonds and protein folding.Biochemistry, 2000,39(15):4207-4216.
[6]MCKITTRICK J, CHEN P Y, BODDE S G, et al.The structure, functions, and mechanical properties of keratin[J].JOM,2012,64(4):449-468.
[7]傅红梅.羽毛粉水解制取可溶性蛋白的工艺研究[J].四川联合大学学报:工程科学版, 1997(6):65-71.
[8]JI Yimei, CHEN Jinyan, LV Jingxiao, et al.Extraction of keratin with ionic liquids from poultry feather[J].Separation and Purification Technology, 2014(132):577-583.
[9]朱磊,朱赛,陈维国.羊毛角蛋白质溶液的制备及其在织物整理中的应用[J].丝绸, 2005(2):26-27.
[10]SWEETMAN B J, MACLARE J A.The reduction of wool keratin by tertiary phosphines[J].Aust J Chem,1966,19(12):2347-2354.
[11]王洁,刘建勇.还原法溶解体系提取的羊毛角蛋白及其应用[J].上海纺织科技,2013,41(9):12-16.
[12]袁久刚,王平,孙桂岩.羊毛角蛋白接枝聚丙烯酸-丙烯酰胺吸水树脂的制备[J].环境工程学报,2013(9):3695-3700.
[13]湛海玲,郭艺雯,于伟东.人工角蛋白膜的成分及致密性表征[J].材料导报, 2009,23(24):97-100.
[14]WOJCIECHOWSKA E, WOCHOWICZ A, WESEUCHABIRCZYN S A.Application of Fourier-transform infrared and Raman spectroscopy to study degradation of the wool fiber keratin[J].J Mol Struct,1999(14):307-318.
[15]陈莉萍,于伟东.羊毛及其角朊膜显微傅立叶红外光谱对比分析[J].东华大学学报:自然科学版, 2006,32(4):105-109.
[16]王莉,姚金波.利用傅里叶变换光谱技术分析拉伸羊毛的二级结构[J].天津工业大学学报, 2010,29(2):19-24.
[17]MOHARRAM M A,ELBABY G M S,RABIE S M ,et al Irradiation of wool fibers in mixtures of orgainc solvents[J].Polym-Plant Techn Eng,1997,36(4):635.
[18]王江波.羊毛角蛋白的溶解及其在织物整理上的应用[D].天津:天津工业大学,2011.
[19]PAULINA H,HELEN B,MARK V D.Some properties of keratin biomaterials:Kerateines[J].Biomaterials,2010,31(4):585-593.
