血清同型半胱氨酸、尿酸、超敏C反应蛋白水平与腔隙性脑梗死患者颈动脉粥样硬化程度的关系探讨
2020-06-03吴湘军郑海燕朱亚兰
吴湘军,郑海燕,朱亚兰
(四川省广汉市人民医院神经内科,四川 广汉 618300)
腔隙性脑梗死(lacunar infarction,LI)指脑小穿通动脉在长期高血压、糖尿病或动脉硬化基础上发生病变引起的缺血性梗死,病灶直径0.2~15 mm,常位于丘脑、脑桥及内囊等部位[1]。Kitagawa等[2]认为血管微粥样斑块形成是LI主要致病病因,近年来颈动脉粥样硬化(carotid atherosclerosis,CAS)斑块在缺血性脑血管病变中的作用逐渐引起广泛关注。Chen等[3]对27例LI患者展开的一项研究显示CAS可作为预测脑梗死发生风险关键指标,因此积极探讨CAS病因病机并采取合理措施进行干预对LI预防和治疗具有积极作用。既往报道显示同型半胱氨酸(Hcy)为动脉粥样硬化形成独立危险因素,血清Hcy水平升高可明显改变斑块形态并扩大斑块面积[4]。闫秋月等[5]认为尿酸(UA)与缺血性脑卒中发生关系密切,且在不伴高血压的患者中更为明显,但其具体作用机制尚未完全清楚,可能参与CAS斑块形成、血管炎症及氧自由基产生等多个环节。超敏C-反应蛋白(hs-CRP)属于急性反应时相蛋白,可能通过血管内膜损伤和炎症增生等作用导致CAS发生,同时还可能降低斑块稳定性而引起LI发病[6]。本文分析血清Hcy、UA及hs-CRP与LI患者CAS严重程度的关系,现报道如下。
1 资料与方法
1.1 一般资料我院2016年12月至2018年1月收治的LI患者90例,纳入标准:①符合第4届全国脑血管病会议提出的有关诊断标准[7];②经CT和MRI等影像学检查证实;③发病时间≤72 h;④均完成颈动脉超声和血清Hcy、UA、hs-CRP检查且临床资料保存完整;⑤患者及家属均知晓本研究并签署同意书。排除标准:①心源性脑梗死;②继发或合并随症状性脑出血;③伴严重神经功能损伤;④合并外周血管病患、急性炎症、肝肾功能障碍、急性冠脉综合征或恶性肿瘤等其它病变。根据颈动脉内膜中层厚度(intima media thickness,IMT)分为斑块组29例、IMT增厚组38例和正常组23例,其中斑块组男17例,女12例,年龄42~85岁[(59.74±12.08)岁],美国国立卫生研究院卒中量表(National Institute of Health stroke scale)评分0~5分[(2.62±0.87)分];IMT增厚组男21例,女17例,年龄46~82岁[(60.35±10.94)岁],NIHSS评分0~5分[(2.49±0.82)分];正常组男12例,女11例,年龄49~86岁[(61.07±12.38)岁],NIHSS评分0~5分[(2.65±0.89)分]。同时选取我院同期90例健康体检者为对照组,男49例,女41例,年龄41~87岁[(60.82±10.93)岁],各组基线资料比较差异无统计学意义(P> 0.05),本研究经我院伦理委员会审核批准。
1.2 方法采集各组研究对象性别、年龄、体质量指数(BMI)、吸烟史、饮酒史、IMT值及血清Hcy、UA、hs-CRP水平等临床资料并进行分析比较,其中IMT测量采用GE Voluson E9型彩色多普勒超声显像仪(美国GE公司生产)完成,诊断标准:IMT<0.9 mm为正常;0.9~1.3 mm为IMT增厚;IMT≥1.3 mm;局限性回声团突入管腔≥2.5 mm或局部IMT较周边增厚≥50%且未见管腔闭塞为CAS斑块。血清Hcy、UA和hs-CRP水平均采集空腹外周静脉血5 ml完成,所用仪器为日立7170 A型全自动生化仪,试剂盒均购自北京奥普森公司,所有操作均严格按照说明书要求完成。比较各组检测结果差异,分析血清Hcy、UA、hs-CRP水平与LI患者IMT值的相关性及各项指标对IMT值的影响。
1.3 统计学方法采用SPSS 22.0统计学软件分析数据。计数资料比较采用χ2检验;计量资料两组间比较采用t检验,多组间比较采用单因素方差分析及LSD-t检验;采用Pearson积差进行相关性检验,采用多元线性回归分析研究血清Hcy、UA、hs-CRP水平对IMT值的影响。P< 0.05为差异有统计学意义。
2 结果
2.1 LI患者与对照组各项检测结果比较LI患者血清Hcy、UA、hs-CRP水平及IMT值高于对照组(P< 0.05)。见表1。

表1 LI患者与对照组各项检测结果比较
2.2 各组LI患者检测结果比较斑块组血清Hcy、UA、hs-CRP水平及IMT值高于IMT增厚组和正常组,IMT增厚组血清Hcy、UA、hs-CRP水平及IMT值高于正常组(P< 0.05)。见表2。
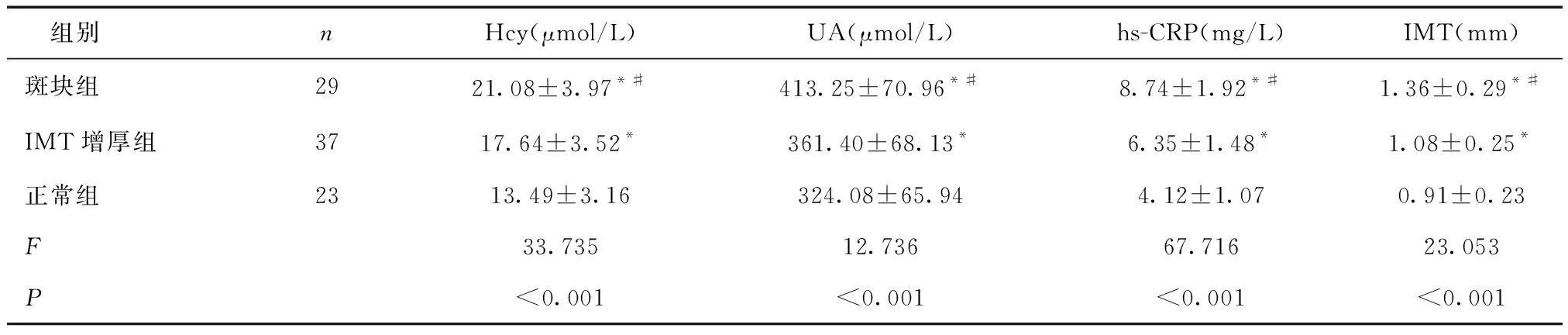
表2 各组LI患者检测结果比较
*与正常组比较,P< 0.05;#与IMT增厚组比较,P< 0.05
2.3 Hcy、UA、hs-CRP对LI患者IMT的影响分析Hcy、UA和hs-CRP均是影响LI患者IMT的重要危险因素(P< 0.05)。见表3。
2.4 LI患者血清Hcy、UA、hs-CRP水平与IMT值的相关性分析LI患者血清Hcy、UA、hs-CRP水平与IMT值呈正相关(r=0.255、0.236、0.213,P< 0.05)。见图1。
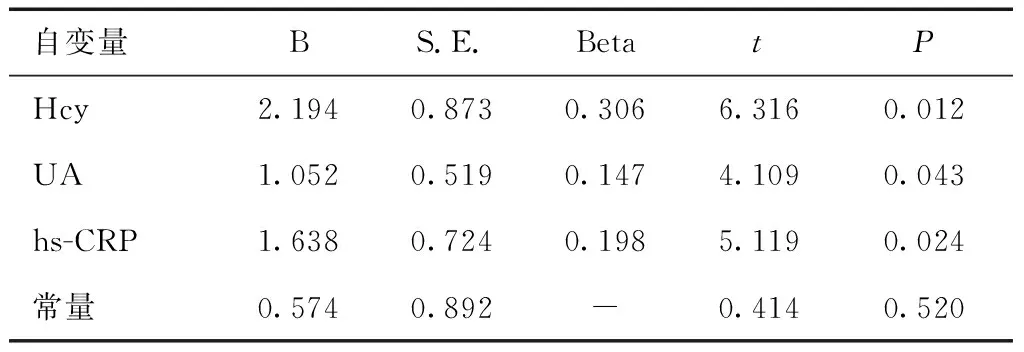
表3 Hcy、UA、hs-CRP对LI患者IMT的影响分析
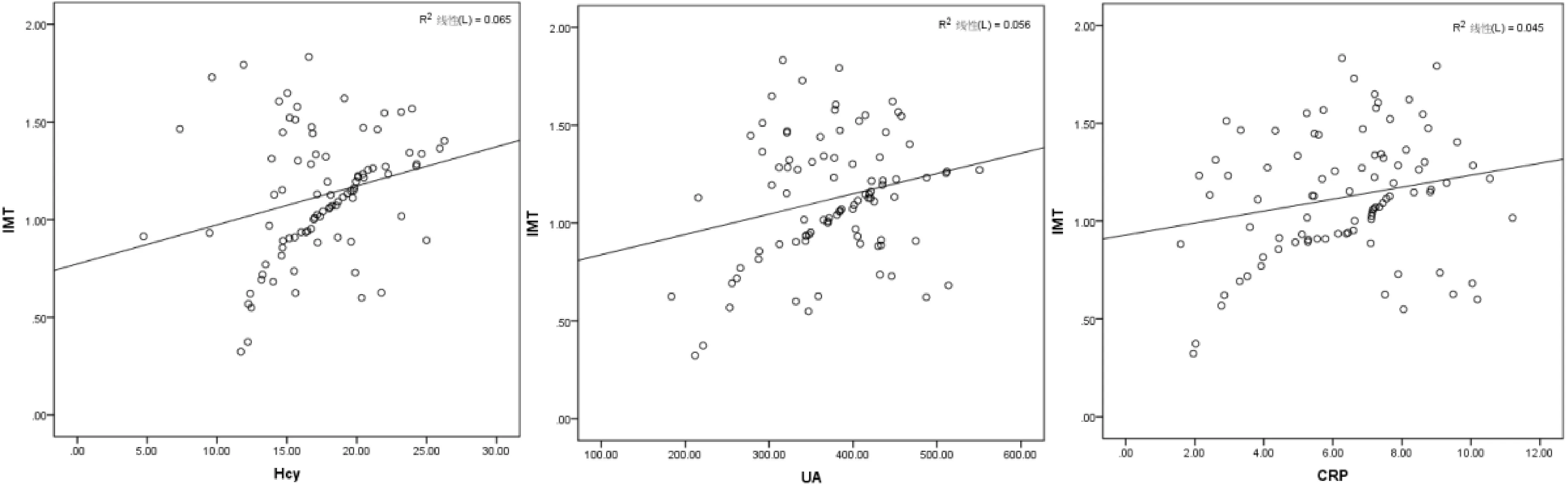
图1 LI患者血清Hcy、UA、hs-CRP水平与IMT值的相关性分析
3 讨论
近年来,我国脑血管疾病发病率正呈不断升高并趋于年轻化,现已成为威胁我国居民身心健康的主要公共卫生问题,流行病学统计显示中青年脑梗死在全部患者数量中占比高达2.7%~14%,且中年群体脑卒中年发病率正以每年8.7%的速度持续增长[8,9]。缺血性脑卒患者中LI占比20%~30%,因梗死区域较小,LI预后较高,多数患者经2~3个月即可明显恢复,致残率与致死率较低,但复发风险较高且缺少有效治疗方法,故而积极加强预防工作极为重要[10]。
Hcy是人体中蛋氨酸和丝氨酸代谢重要中间产物,健康人群血清表达水平通常约为5~15 μmol/L,在高血压、AS及脑梗死等心脑血管疾病发生和进展过程发挥关键作用[11]。翟莉红等[12]对98缺血性脑卒中患者展开的一项研究表明其血清Hcy表达水平较健康人群显著升高,且提升幅度与IMT有明显正相关性。UA在脑梗死中的作用尚未完全清楚,可能与低密度脂蛋白氧化、炎症反应和氧自由基生成等因素有关[13],此外有文献报道缺血性脑卒中发生与血清UA水平关系密切,且在不伴高血压的患者中表现更为显著[5]。hs-CRP作为主要由白介素-6诱导释放的血管炎症特异性标志物,与脑梗死病变部位、严重程度和预后均存在密切联系。LI是因小穿通动脉病变引起的脑梗死特殊类型,本研究结果显示LI患者血清Hcy、UA和hs-CRP水平明显高于健康人群,与张艳茹等[14]对中青年无症状脑梗死患者的研究结果大致相同,提示Hcy、UA和hs-CRP可能参与疾病发生和进展。
脑梗死发生和进展与CAS的关系已经大量研究证实,采用多普勒超声测量IMT可直观反映CAS严重程度并预测心脑血管疾病发生风险,文献报道IMT每增加0.15 mm,脑梗死发生风险可增加1.82倍[15]。本研究结果显示LI患者IMT较健康人群明显升高,提示CAS与LI也存在密切联系。根据IMT将患者分为斑块组、IMT增厚组和正常组进行分析,结果显示各组血清Hcy、UA和hs-CRP水平差异显著,表明Hcy、UA和hs-CRP可通过影响CAS而导致LI发病。既往报道显示Hcy影响CAS的作用机制可能包括促进氧自由基形成并减少内源性NO释放;刺激平滑肌细胞增殖和迁移,同时抑制血管内皮细胞生长分化,导致内皮功能异常和凝血活性增加,此外Hcy可促进胆固醇合成和低密度脂蛋白氧化,加重血管壁损伤。朱美娥等[15]研究表明血清UA水平和IMT增厚之间平行相关,多元回归分析结果显示血清UA为IMT独立危险因素,且大量存在于缺血性脑卒中患者硬化斑块之内。根据内皮细胞损伤反应学说相关内容,炎症反应在CAS发生过程中占有重要地位,hs-CRP不仅可促进炎症因子合成分泌,还诱导巨噬细胞等炎性细胞向内膜趋化和黏附,导致粥样斑块稳定性下降并发生破裂,从而栓塞脑供血动脉。本研究中Pearson积差系数和多元线性回归显示分析显示LI患者血清Hcy、UA、hs-CRP水平均与IMT值紧密相关,表明Hcy、UA和hs-CRP可促进CAS进展并显著增加LI发生风险。本研究样本容量相对偏小,可能导致结果存在一定偏倚,LI发病机制复杂,但因检测条件限制,本研究仅对颈动脉IMT进行测量并对动脉粥样硬化程度进行评估,无法不明确LI患者颅内小动脉病变情况,因此不能排除其他或不明原因引起的病变,后续还需要更多临床试验对血清Hcy、UA、hs-CRP水平与动脉粥样硬化的LI的关系进行探讨。
综上所述,LI患者血清Hcy、UA、hs-CRP水平明显升高,且与颈动脉IMT存在明显正相关性,均是导致CAS严重程度增加的重要危险因素,并可能增加LI发病风险。
