急性脑梗死患者血清溶血磷脂酸、胱抑素-C水平与颈动脉斑块稳定性的相关性分析
2020-06-03孙小艳何涛贞杨丽超
孙小艳,何涛贞,杨丽超
(四川大学华西医院 a.健康管理中心,b.小儿外科,c.神经内科,四川 成都 610041)
急性脑梗死(acute cerebral ischemic,ACI)是常见急危重症,ACI的发生发展与动脉粥样硬化、颈动脉斑块的形成密切相关,而颈动脉斑块的稳定性将直接影响患者预后[1]。有研究发现,血清溶血磷脂酸(lysophosphatjdjc acid,LPA)能通过调节金属基质蛋白酶(MMP)水平影响动脉粥样硬化进程和斑块的稳定性[2]。而胱抑素C(Cys-C)被证实与心脑血管疾病的发生及进展密切相关[3]。本研究探讨急性脑梗死患者血清LPA和Cys-C水平及其与颈动脉斑块稳定性的关系,现报道如下。
1 资料与方法
1.1 一般资料2018年6月至2019年1月四川大学华西医院神经内科收治的97例ACI患者,年龄41~78岁,男61例,女36例。纳入标准:①符合2014年中国急性缺血脑卒中诊疗指南[4],急性发病,局灶神经功能损伤,临床症状或体征持续时间不固定;②患者均知晓并理解研究内容,自愿签署知情同意书;③本研究已通过医院伦理审核。排除标准:①非血管性因素,脑外出血、肺炎、慢性阻塞性肺病、呼吸衰竭、肺源性心脏病等;②入院前3~4周各种外伤及各系统感染性疾病、血液性疾病者;③入组前使用抗感染、激素、免疫抑制药物者;④严重心律失常、先天性心脏病、心肌病、心脏瓣膜病等器质性心脏病;⑤酗酒、家族性高血压及长期服用避孕药物者、合并糖尿病者;⑥颅内出血者;⑦甲状腺功能异常者。
1.2 方法
1.2.1血清LPA及Cys-C检测 所有研究对象均于入院24 h内采集空腹静脉血3~5 ml,EDTA促凝管收集,3000 r/min离心10 min,收集血清冷藏待测。Cys-C测定采用四川迈克生物科技股份有限公司提供的Cys-C测定试剂盒,采用免疫比浊法测定Cys-C水平;LPA、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、甘油三酯(TG)、C反应蛋白(CRP)、同型半胱氨酸(Hcy)试剂盒均由罗氏诊断产品(上海)有限公司提供。其中,采用比色法测定LPA水平,采用酶联免疫法(ELISA)测定LDL、HDL、TG及CRP水平,采用循环酶法测定Hcy水平。检验过程均严格按照试剂盒相关步骤。
1.2.2颈动脉超声检查 采用美国飞利浦公司生产的THILI-HDIIXE彩色多普勒超声诊断仪检测急性脑梗死患者颈动脉斑块性质,嘱患者充分暴露颈部,超声探头频率7.5~12 MHz,检测患者双侧颈总动脉、颈动脉分叉部、颈内动脉、椎动脉,在颈总动脉起始部与分叉部1 cm处测量中膜膜厚度(IMT),观察斑块形成情况与稳定性。IMT≥1.0 mm为增厚,IMT≥1.2 mm并突向管腔内,可视为斑块形成;根据斑块形态与回声特点,将其分为不稳定与稳定斑块[5],定义软斑块与溃疡斑为不稳定斑块,扁平斑与硬斑为稳定斑块。
1.2.3研究设计 根据颈动脉超声检查结果,将97例急性脑梗死患者分为无斑块组(n=17)、稳定斑块组(n=33)与不稳定斑块组(n=47)三个亚组。患者入院24 h内,同时采集对照组与急性脑卒中患者空腹静脉血5 ml,完成血清Cys-C及LPA水平检测及相关实验室检查。
1.3 观察指标①无斑块组、稳定斑块组及不稳定斑块组的一般资料,包括性别、年龄、体重指数(BMI)、糖尿病病史、高血压病史、吸烟、饮酒史。②三组实验室检查结果:包括血清LPA、Cys-C、LDL、HDL、TG、CRP、Hcy水平。③根据急性脑梗死患者颈动脉内膜中层厚度,将其分为IMT<1.0 mm组、1.0 mm≤IMT<1.3 mm组、1.3 mm≤IMT<1.5 mm组,IMT≥1.5 mm组。
1.4 统计学方法采用SPSS 19.0软件分析数据。多组间计量资料比较采用单因素方差分析;计数资料比较采用χ2检验;影响因素分析采用Logistic回归分析。检验效能α=0.05。
2 结果
2.1 三组一般资料比较无斑块组、稳定斑块组及不稳定斑块组患者年龄呈依次上升趋势(P< 0.05),三组性别、BMI、糖尿病史、高血压病史、吸烟史及饮酒史比较,差异无统计学意义 (P> 0.05)。见表1。
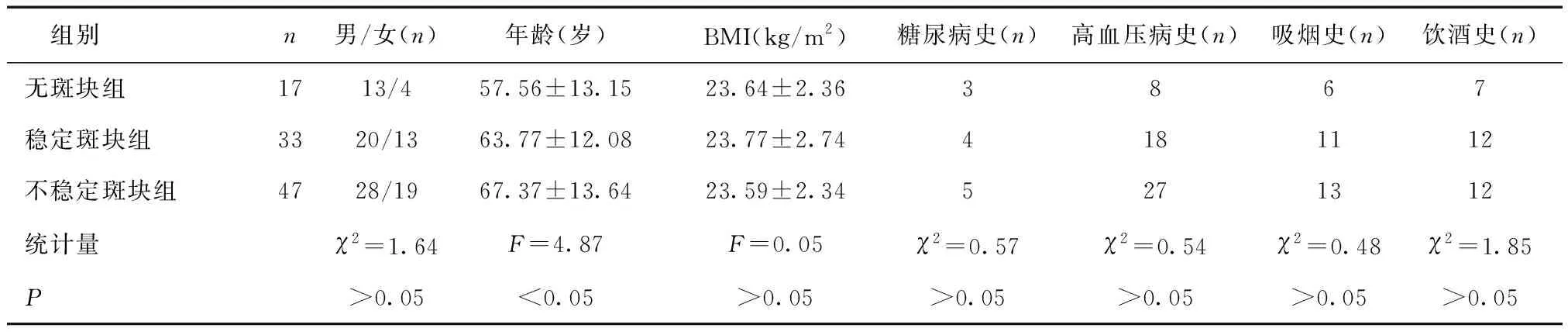
表1 三组一般资料比较
2.2 三组实验室检查结果比较无斑块组、稳定斑块组及不稳定斑块组间LPA、Cys-C、CRP及Hcy水平均呈依次上升趋势(P< 0.05),三组LDL、HDL及TG水平比较,差异无统计学意义(P> 0.05)。见表2。
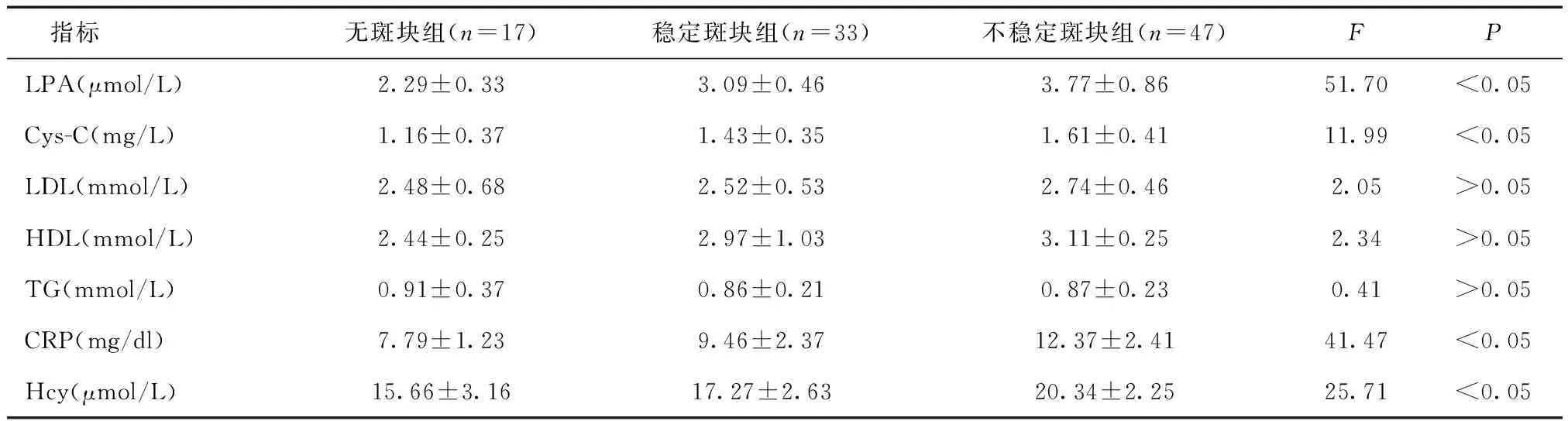
表2 三组实验室检查结果比较
2.3 ACI患者颈动脉斑块稳定性危险因素分析年龄、血清LPA、Cys-C水平及LDL、CRP水平均是影响颈动脉斑块稳定性的危险因素(P< 0.05)。见表3。

表3 ACI患者颈动脉斑块稳定性危险因素分析
2.4 不同颈动脉IMT患者血清LPA及Cys-C水平比较颈动脉IMT增加,急性脑卒中患者血清LPA及Cys-C水平均呈依次上升趋势(P< 0.05)。

表4 不同颈动脉IMT患者血清LPA及Cys-C水平比较
3 讨论
ACI是我国神经系统疾病中最常见的致死致残性疾病之一,其主要病理机制为动脉粥样硬化血栓形成。各种炎症因子及其他因素的刺激下可形成动脉粥样硬化斑块,斑块的稳定性及易损性与患者疾病发展及预后密切相关[6]。我院研究发现,除了传统因素,如年龄、CRP及Hcy外,血清LPA及Cys-C水平与ACI患者颈动脉斑块稳定性间也存在密切联系。颈动脉斑块表面切应力、内部氧化应激反应、炎症反应及内皮功能紊乱程度均将影响斑块稳定性,进而决定患者病情发展及预后[7,8]。故掌握急性脑梗死患者颈动脉斑块稳定情况是临床研究重点。
LPA主要生物效应包括刺激细胞增殖与血小板聚集,增加血管内皮通透性,并参与血管平滑肌收缩、肿瘤细胞浸润等生理、病理过程[9]。近年来,有研究发现[10],LPA与血小板活化、聚集相关,并参与了LDL的氧化过程,参与动脉粥样硬化、血栓形成,同时对冠状动脉斑块破裂起正向作用。LPA能促进MMP的分泌与表达,MMP的活化、表达则会导致斑块不稳定、破裂,因此LPA也可能与斑块破裂相关。同时,LPA能上调炎性因子、黏附分子表达水平,促进炎症细胞的迁移和浸润,抑制免疫系统清除等方式,导致斑块稳定性下降[11]。本文中,无斑块组、稳定斑块组及不稳定斑块组患者血清LPA水平呈依次上升趋势,Logistic分析也提示,血清LPA水平是影响斑块稳定性的危险因素。
Cys-C是一种由120个氨基酸残基相互构成的蛋白质,主要由真核生物中的有核细胞表达并分泌,有生理研究发现,脑脊液循环中血清Cys-C浓度是血循环中的5.5倍,且主要通过肾脏代谢[12]。但Cys-C与心脑血管疾病间的相关性暂未得到证实。本文研究发现,不稳定斑块组患者较稳定斑块者血清Cys-C水平明显增高,且血清Cys-C水平在无斑块、稳定斑块及不稳定斑块组中呈依次上升趋势,与既往研究结果一致。提示血清Cys-C水平异常增高可能影响颈动脉斑块的形成及稳定性。Cys-C水平对ACI患者颈动脉斑块的稳定性间的关系,可能与以下几个方面相关[13]:①脑内Cys-C浓度更高,脑屏障受损时脑内Cys-C进入血循环,使血清Cys-C浓度上升。②不稳定斑块形成后,提示机体局部应激反应更为强烈,并通过调节内分泌及神经系统,损伤肾功能,造成Cys-C排泄异常,导致血清Cys-C水平增高。本文研究发现,除了Hcy、CRP、年龄等因素外,血清Cys-C高水平也是影响颈动脉斑块稳定性的危险因素。
此外,根据IMT对ACI患者进行分组,分析发现,IMT厚度增加,ACI患者血清LPA及Cys-C水平随之上升,提示血清LPA及Cys-C与颈动脉斑块稳定性间的关系。
综上所述,ACI患者血清LPA及Cys-C水平与其颈动脉斑块形成及稳定性间具有紧密关联,可通过血清LPA、Cys-C水平预测患者颈动脉斑块性质与预后。
