酿酒粮食发酵蒸馏乙醇碳稳定同位素的变化
2020-06-02谢正敏安明哲叶华夏魏金萍
张 倩,谢正敏,安明哲,叶华夏,魏金萍,黄 箭
(1.五粮液股份有限公司,四川宜宾 644000;2.中国轻工业浓香型白酒固态发酵重点实验室,四川宜宾 644000)
白酒在我国拥有悠久历史,是我国文化不可分割的一部分。近年来,屡禁不止的“假酒”事件严重损害了消费者的消费信心及正规企业的品牌信誉。从本质上说,“假酒”与白酒的不同就是产品中有机成分(乙醇、风味物质等)来源的不同,涉及到白酒的原料真实性问题。碳稳定同位素技术揭示了产品特征有机物的信息,而该信息受产品原料种类、生长环境、代谢方式等[1]因素影响,不可人为改变,使该技术在白酒、蜂蜜、葡萄酒、奶制品等[2-7]食品及其原料真实性研究领域得到了广泛应用。白酒的主要成分为乙醇,而白酒中的乙醇最终来源于酿酒粮食,故酿酒粮食碳稳定同位素(δ13C)在理论上决定了白酒乙醇碳稳定同位素(δ13C)。本文以国内最具典型性的白酒原料——高粱、小麦混合酿酒粮食为例,研究混合原料总δ13C→总糖δ13C→发酵乙醇δ13C→蒸馏乙醇δ13C 的变化规律,为白酒鉴别事业添砖加瓦。
1 材料与方法
1.1 材料、试剂及仪器
材料:本地高粱、小麦、多原料基酒、成品酒。
试剂:耐高温淀粉酶、糖化酶、碘液、白炭黑、IAEA-CH-6(蔗糖,国际原子能机构IAEA,基于V-PDB 计算δ13C=-10.449 ‰)、IAEA-600(咖啡因,国际原子能机构IAEA,基于V-PDB计算δ13C=-27.771 ‰)、HPLC 级乙醇A、B(已标定δ13C值)。
仪器设备:AI 1310 自动进样器、Trace GC Ultra气相色谱仪、GC Isolink 燃烧转化装置、Delta V Advantage 稳定同位素比值质谱仪、Flash 2000-HT 元素分析仪,均为Thermo Fisher 公司产品;LG10-2.4A 离心机、FOSS CT410 旋风磨。
1.2 前处理方法
粉碎:用旋风磨将高粱、小麦各自粉碎,所得粉末可过100 目筛;按照不同比例将高粱、小麦粉末充分混合后待用;取适量混合粮食粉末包裹入锡盒待测。
液化糖化:往100 mL 蒸馏水中加入混合粮食粉末20 g,在搅拌状态下加热至糊状后加入0.3 mL耐高温淀粉酶,移入95 ℃水浴中进行液化,直至液化液不再使碘液变蓝为止;迅速冷却液化液至60 ℃,加入0.2 mL 糖化酶糖化3 h,取5 mL 糖化液冷冻保存,其余糖化液进行发酵。
糖样品:将保存的5 mL 糖化液以4000 r/min 离心5 min 去除固体杂质,用白炭黑吸附干燥后取适量包裹入锡盒待测。
发酵与乙醇样品:将剩余糖化液高温灭菌后,迅速冷却至室温,加入0.3 g酿酒干酵母,在30 ℃恒温培养箱中无氧发酵至恒重;用色谱纯丙酮将发酵液稀释,乙醇含量约为4 mL/L,将稀释液过0.2 μm过滤头后放入进样瓶待测。
1.3 测定方法
1.3.1 EA-IRMS测定粮食总δ13C和总糖δ13C
以IAEA-CH-6 为标准品、IAEA-600 为质控样,采用元素分析-稳定同位素比质谱联用技术(EA-IRMS)检测固体样品;所述元素分析条件为:进样器He 吹扫流量(Reference)为200 mL/min,氧化炉温度为960 ℃,柱温(Oven)为60 ℃,载气He(Carrier)流量为110 mL/min;稳定同位素比质谱条件如下:离子源真空为1.3×10-6mBar,电压为3.06 kV。
1.3.2 GC-C-IRMS测定乙醇δ13C
以标定δ13C 后的乙醇A 为标准品、乙醇B 为质控样,TR-WAXMS 毛细管柱(60 m×0.25 mm×0.25 μm);载气为高纯氦气,恒流模式,流速为1.0 mL/min;进 样体 积 为1 μL,进 样口 温 度为220 ℃;分流比为20∶1;升温程序为:起始温度40 ℃,保持2 min,以1 ℃/min 升温至50 ℃后保持1 min,再以20 ℃/min升温至200 ℃并保持4 min。
2 结果与讨论
2.1 混合原料总δ13C→总糖δ13C→发酵乙醇δ13C
为研究混合原料总δ13C→总糖δ13C→发酵乙醇δ13C的变化,选择δ13C差异较大的、国内最具酿酒典型性的高粱、小麦为原料,分别粉碎后按照不同重量比将之充分混合,并按照1.2 处理出不同样品;按照1.3检测不同样品的δ13C,结果见图1。
小麦属于C-3 植物、高粱属于C-4 植物,由于在光和作用中C-3、C-4 植物固碳途径不同导致两种植物δ13C 差异显著,为碳稳定同位素技术辨别酿酒原料提供了理论基础。图1a 显示,随着高粱、小麦比例的变化,混合粮食总δ13C 发生了相关性非常高的线性变化,符合理论。图1b 显示,不同比例粮食总糖δ13C 与混合粮食总δ13C 之间存在差异,前者微弱偏正,但两者拥有比较高的线性相关性,即两者相似相关不相同,这是因为植物生长过程中存在同位素自然分馏效应,使得同植物不同物质δ13C 之间也会存在差异。发酵乙醇的主要来源是发酵原材料中的糖,因此发酵乙醇δ13C 必同源于发酵原材料的总糖δ13C,图1c 显示了这种同源性:相较于总糖δ13C,发酵乙醇δ13C 更偏负,二者不完全相同,但线性正相关。这是因为在发酵过程中,糖的6 个碳原子有2 个生成了二氧化碳、余4 个生成了乙醇[8],导致碳同位素发生了代谢分馏,使发酵乙醇δ13C与总糖δ13C 相关相似不相同。总之,随着酿酒原料种类、配比的变化,混合粮食总δ13C、总糖δ13C 发生了相应变化,使得发酵乙醇δ13C 也随之发生了相关性非常高的变化,印证了酿酒原料δ13C 决定发酵乙醇δ13C 的理论;C-4、C-3 植物的δ13C 多处于-7‰~-15‰、-20‰~-35‰之间[9],当酿酒原料为混合粮食时,按照一定比例混合不同C-4、C-3酿酒原料,可以生产出一切δ13C 处于两者之间(-10‰~-30‰)的乙醇,换句话说,只检测乙醇δ13C无法准确判断酿酒原料的种类。即酿酒原料δ13C决定发酵乙醇δ13C,发酵乙醇δ13C 反映但不可准确辨别酿酒原料。

图1 混合原料总δ13C→总糖δ13C→发酵乙醇δ13C的变化
2.2 蒸馏过程乙醇δ13C的变化
为研究蒸馏过程中发酵乙醇碳稳定同位素变化情况,在蒸酒过程中按体积取样(每10 mL 取1 个样)的方法,测定酒精水溶液、小麦发酵液、高粱发酵液、高粱小麦混合发酵液的蒸馏液中乙醇δ13C,结果见图2。第0 次是发酵原液中的乙醇δ13C 值,第10次是蒸馏后剩余液体中的乙醇δ13C值。

图2 蒸馏过程乙醇δ13C的变化
由图2 可以看出,无论是发酵原液还是酒精水溶液,蒸馏过程中乙醇δ13C 均表现出随蒸馏过程变负的趋势,这是由于蒸酒过程中乙醇碳稳定同位素出现了反蒸汽压同位素分馏效应,导致重碳同位素更易累积在先蒸出的乙醇中,使得初蒸乙醇δ13C 相对于发酵原液偏正、末段乙醇δ13C 相对于发酵原液偏负,但总的来说都在一定范围内(发酵原液乙醇δ13C±1 ‰),不会过于偏离发酵原液乙醇δ13C。以上结果说明蒸馏过程对发酵乙醇δ13C 有微弱影响,但相对于发酵原料的决定性影响来说,可忽略不计,即蒸馏过程对发酵乙醇δ13C 无显著影响,只是在生产摘酒时,不同酒段的乙醇δ13C 会产生细微差异。
2.3 不同酒段基酒乙醇δ13C的变化
收集了不同浓香型酿酒车间混合酿酒粮食不同糟层不同酒段的基酒若干,用色谱纯丙酮将其稀释到含乙醇约4 mL/L,按照1.3.2 节检测各基酒乙醇δ13C。蒸馏摘酒顺序为酒头→一级酒→二级酒,将各蒸酒过程中酒头与一级酒、一级酒与二级酒的差值结果列于表1。
表1 显示,无论是什么糟层蒸馏的基酒,两个车间在摘酒时,得到的酒头与一级酒、一级酒与二级酒的乙醇δ13C 差值均为正值,且都小于1.0‰,说明在摘酒中,随着蒸馏过程的进行,乙醇δ13C 呈现逐渐微弱变负的趋势,同2.2 节的结论一致,即蒸馏过程会使不同酒段基酒乙醇δ13C 产生细微差异,但相对于发酵原料的决定性差异来说,蒸馏差异不显著。
2.4 成品酒乙醇δ13C
收集了同一浓香型酒厂2018 年多批次多粮(配比一致)酿造成品酒样若干(包括高档酒29 个、中档酒18 个),用色谱纯丙酮将其稀释到含乙醇约4 mL/L,按照1.3.2 节检测各成品酒乙醇δ13C,将结果列于图3。
图3 显示,该浓香型酒厂2018 年生产的多批次高档酒、中档酒乙醇δ13C 均值无显著差异,且标准偏差(STD)均小于1 ‰,比较稳定;而高档酒多用一级酒生产,中档酒多用二级酒生产,说明在大生产时,蒸馏过程对不同酒段基酒乙醇δ13C 产生的细微差异无法在不同品级成品白酒乙醇δ13C 上得到体现,即蒸馏过程对同一酒厂酿酒粮食配比一致的不同品级的成品白酒乙醇δ13C无显著影响。
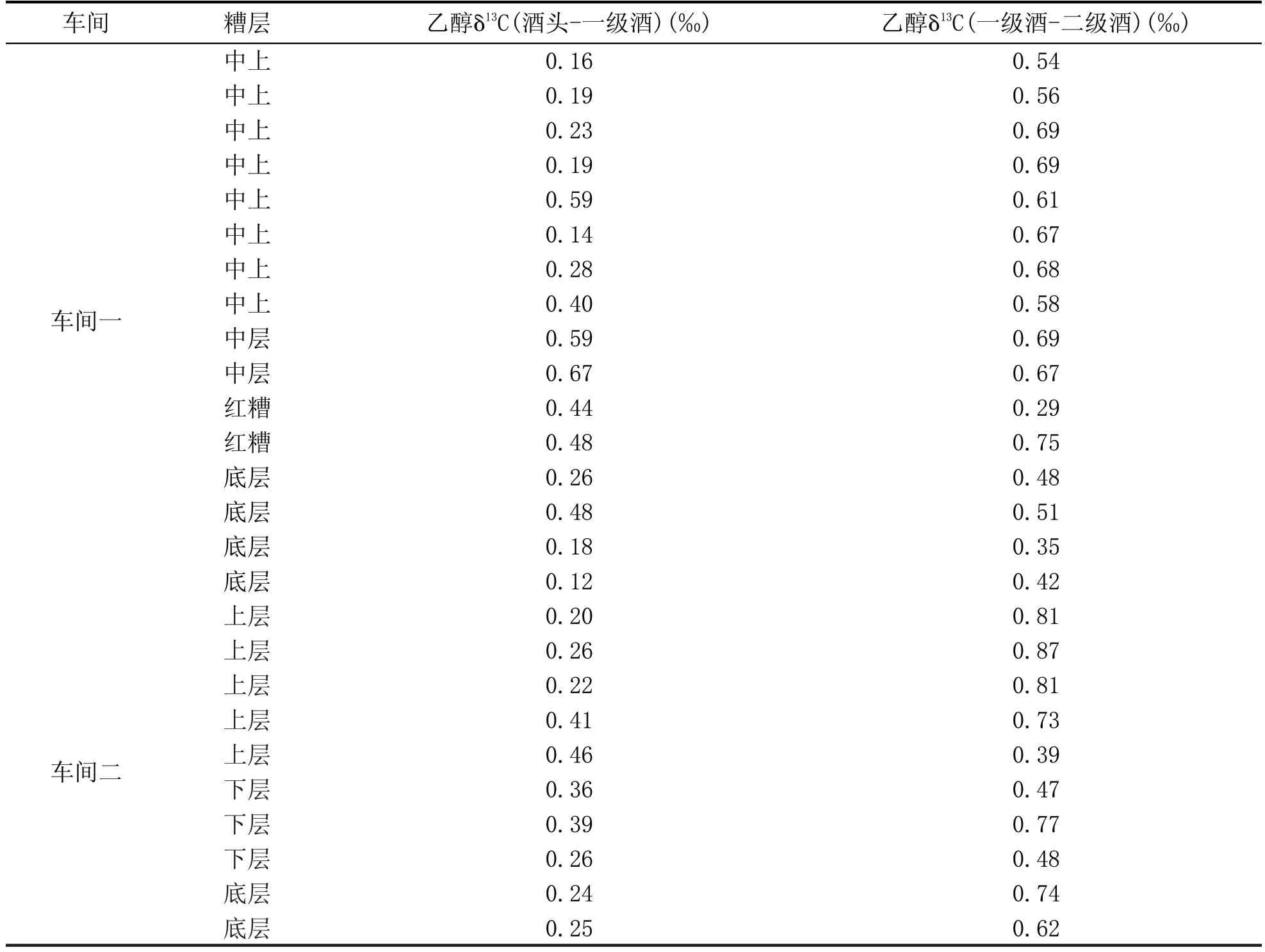
表1 各车间不同酒段基酒乙醇δ13C的差异

图3 同一浓香型酒厂2018年成品酒乙醇δ13C均值
3 结论
本研究发现,酿酒原料δ13C 决定发酵乙醇δ13C,发酵乙醇δ13C 反映酿酒原料δ13C,通过乙醇δ13C 辨别酿酒原料在理论上可行,但在实际生产中存在局限性;蒸馏过程不会使发酵乙醇δ13C 产生发酵原料级的变化,但会使生产摘酒时,不同酒段基酒乙醇δ13C产生细微差异,但最终在大生产上对不同品级成品酒乙醇δ13C 无显著影响。本文为白酒及其原料真实性的鉴别事业添砖加瓦。
