清香型白酒酒曲中核心真菌发酵特性的研究
2020-06-02张锦华
张 敏,张锦华
(山西大学生命科学学院,山西太原 030006)
中国白酒有着悠久的历史,酿酒和微生物的代谢活动息息相关,酒曲中含有大量的微生物菌株,使其具有糖化、发酵和生香的功能,霉菌中的糖化酶可以糖化粮食原料中的还原糖,为酵母的生长和发酵提供能源物质,酵母通过发酵可以产生乙醇和有特殊香气成分的酯类。
在各种指标中,糖化、酯化和醇化的能力直接反映了白酒生产的能力,是判断曲的质量的重要指标[1],对于现实酿造生产也具有指导意义。清香型酒曲中也含有多种真菌,如产乙醇酵母和产酯酵母,其中霉菌也具有高度糖化力。生长曲线反映了酵母在培养过程中的生长和繁殖,是了解所用的菌株和后期发酵培养的生理指标。目前,有许多关于用分光光度法测定酵母生长曲线的研究[2],而霉菌会形成较大的菌丝体,常用的方法是菌丝干重[3-4]。细胞中的糖化酶可以将淀粉水解成葡萄糖,其通过微生物发酵来产生乙醇[5]。糖化力是曲的质量控制的主要指标,准确快速地确定糖化力对于制曲生产质量具有重要意义[6]。采用最新国标中的直接滴定法测定还原糖的含量,滴定终点为无色,改善了旧方法中砖红色终点难以准确判断和控制的缺点。
酵母在白酒酿造过程中对香味物质的形成起着重要作用[7]。酿酒酵母是曲的主要酵母,它在发酵过程中首先利用葡萄糖代谢生成乙醇和乙酸,然后在酵母细胞内酯酶的作用下产生乙酸乙酯[8]。酯化能力主要发生在早期[9],而乙酸乙酯是清香型白酒中最重要的物质之一[10],也是清香型白酒香气的主要成分,其含量越高,香味就越好[11]。气相色谱法可快速准确地检测样品中乙醇和乙酸乙酯的含量。
对清香型白酒的酒曲中核心真菌菌株的发酵特性进行了初步研究,为优化酿酒厂的生产工艺,提高酒曲的质量,生产更优质的清香型白酒提供参考。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 材料和试剂
材料:清香型白酒核心菌株(均取自山西省祁县某酒厂)。霉菌:红曲霉(Monascus purpureus Went);11 号(Aspergillus awamori);根 霉(Rhizopus)。酵母:白地霉(Geotrichum candidum);拟内孢 霉 酵 母(Endomycopsis);Kyle(Saccharomyces cerevisiae);3077(Wickerhamomyces anomalus),3091(Wickerhamomyces anomalus),wind-2(Wickerhamomyces anomalus)。
培养基(均于121 ℃高压灭菌20 min,试剂均为分析纯):
马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar Medium,PDA 培养基):马铃薯(去皮并切块)200 g,葡萄糖20 g,琼脂20 g,蒸馏水1000 mL,自然pH值。
酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD 培养基):葡萄糖20 g,酵母粉10 g,蛋白胨10 g,蒸馏水1000 mL,自然pH值。
酵母浸出粉胨可溶性淀粉培养基(Yeast Extract Peptone Soluble Starch Medium,YPS 液体培养基):酵母膏10 g,蛋白胨20 g,可溶性淀粉20 g[12],蒸馏水1000 mL,自然pH值。
生长培养基:葡萄糖20 g,硫酸铵5 g,磷酸二氢钾1 g,酵母粉0.5 g,MgSO4·7H2O 5 g[7],蒸馏水1000 mL,自然pH值;
糖化培养基:可溶性淀粉20 g,硫酸铵5 g,磷酸二氢钾1 g,酵母粉0.5 g,MgSO4·7H2O 5 g[7],蒸馏水1000 mL,自然pH值。
试剂及耗材:酵母DNA 提取试剂盒、胶回收试剂盒,Omega Bio-Tek,中国技术支持中心;引物ITS4,ITS5、6 × Loading Buffer,上海生物工程生物技 术 有限 公 司;Marker,λ DNA/hand III、100 bp Marker、2× Taq PCR Mastermix,北京Real-times 生物科技有限公司;蛋白酶K、溶菌酶琼脂糖G-10、I型核酸染色剂、二巯基乙醇等,上海生物工程生物技术有限公司。
1.1.2 仪器与设备
JA1203N 电子天平,上海恒平有限公司;LDX-75KB 电热恒温培养箱,北京市六一仪器厂;HRHPY-300 恒温培养摇床,青岛海尔特种冰箱柜有限公司;UV-5100 紫外分光光度计,METASH 上海元析仪器有限公司;DYY-6C 双定时电泳凝胶仪,北京六一生物科技有限公司;DY-8C 旋涡振荡仪,苏州净化设备有限公司;BIO RAD TIOOTM PCR 热循环仪,新加坡制造;SC-3614 ZONKIA 低速离心机,安徽中科Zonkia 科学仪器有限公司;BioRad 全能成像分析系统,哈尔滨德远科技开发有限公司;2010 ATF 气相色谱仪,230V Shimadzu Corporation(日本岛津)。
1.2 试验方法
1.2.1 形态学和分子生物学鉴定
对其中几株未知菌株进行测序和鉴定[11,13-14]。将菌株接种到PDA 培养基中,观察各菌株形态并记录。待生长状态良好,用接菌环将菌株接种到YPD 液体培养基中,制备种子液,在28 ℃,120 r/min恒温摇床中振荡约20 h,当酵母在YPD培养基中于600 nm 处的OD 值达到约1 h,用酵母DNA 试剂盒提取基因组,再用0.7%琼脂糖凝胶进行核酸电泳(样品,5 μL;Marker:λDNA/handIII,5 μL;6×Loading buffer,2 μL)。然后以基因组作为模板进行聚合酶链式反应(25 μL 体系:引物:ITS4:5'-TCCTCCGCTTATTGATATGC-3',5 μL;ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3',5 μL;dNTP,Taq DNA 聚合酶的混合物和缓冲液,12.5 μL;dd 水,2.5 μL;模板,1 μL;PCR 反应条件:起始:105 ℃,体系:25 μL;1.94 ℃,5:00;2.94 ℃,0:30;3.55 ℃,0:30;4.72 ℃,1:30;5.转到步骤2,34×;6.72 ℃,10:00;7.12 ℃,∞)。用1.5%琼脂糖凝胶进行核酸电泳(样品,5 μL;标记物:100 bp 标记,5 μL)进行测试。照胶并记录,然后对PCR 产物进行测序。
1.2.2 菌株生长曲线
酵母生长曲线:将菌株接种到YPD 液体培养基中制备种子液,在28 ℃,120 r/min 的恒温摇床中振荡约14 h,以4000 r/min 离心4 min,弃上清液,加入无菌水悬浮细胞,并调节菌悬液浓度,直至OD 600 nm 值相同。吸取1 mL 菌悬液注入含有100 mL 生长培养基的250 mL 锥形瓶中,然后每隔2 h 测量OD 600 nm[2,15-17]根据相关研究,白地霉应在OD 660 nm处进行测定[18]。
霉菌的生长曲线:向在PDA 培养基上生长的霉菌中加入40 mL 无菌水,涂布并过滤制备孢子悬浮液。吸取2 mL 悬浮液注入含有100 mL 生长培养基的250 mL 锥形瓶中,在28 ℃,120 r/min 下振荡。每24 h 取出1 次并过滤,在80 ℃下干燥至恒定。差值法计算菌丝体干重[3,19-20]。
1.2.3 糖化力
制备霉菌孢子悬浮液,将2 mL悬浮液吸入50 mL YPS 液体培养基中,并在28 ℃,120 r/min 摇床培养。每天24 h 取霉菌培养基,加入10 mL 乙酸-乙酸钠缓冲液,30 ℃水浴1 h,过滤,取10 mL 滤液倒入50 mL 2%可溶性淀粉溶液中,在40 ℃水浴中静置1 h,加入3 mL 1 M 氢氧化钠溶液停止反应,再加水定容至100 mL。
将5 mL 样品,6 mL 斐林试剂,10 mL 水,10 个沸石加入150 mL 锥形瓶中。加热至沸腾时开始滴定。当最后一滴滴下时,溶液蓝色消失并变为无色或淡黄色,即为终点。此过程在3 min 内完成。进行预滴定,并设置空白对照,用蒸馏水替换酶溶液。用标准葡萄糖溶液滴定测定还原糖含量,滴定法参照国家标准[12,21]。
糖化酶活性的定义:在40 ℃,pH4.6 的条件下,水解1 mL 可溶性淀粉溶液1 h 所需的酶量被称为酶活性的一个单位,以U/mL表示[22]。
1.2.4 产酒力
挑取酵母并将其接种于含有50 mL YPD 液体培养基的100 mL 锥形瓶中,在28 ℃,120 r/min摇动20 h,以4000 r/min离心4 min,然后用无菌水悬浮细胞,并将所有菌株的OD 值调整为2。吸取1 mL悬浮液接种到含有50 mL YPD 培养基的100 mL 锥形瓶中,在28 ℃下静置培养。每24 h 取出样品用pH 计测量酸度值并蒸馏,收集等量的滤液,通过0.22 μm 滤膜,并通过气相色谱检测。气相色谱条件:进样口:220 ℃,色谱柱为SGEAC-20 毛细管柱,(30 m×0.25 mm×0.25 μm);起始柱温为32 ℃,保持5 min,以5 ℃/min升至60 ℃;载气为高纯氮气(纯度为99.999%);检测器温度为220 ℃,氢气流速为30 mL/min,空气流速为350 mL/min,拖尾速度为30 mL/min,分流比为30∶1;注射量为1 μL[13-14,23]。
1.2.5 酯化力
制备悬浮液,接种于上述YPD 液体培养基中,每24 h取出培养液,加入100 mL 60%乙醇溶液,蒸馏后收集75 mL 馏分,用气相色谱法测定馏液[24],色谱条件与上述相同。
1.2.6 数据处理
测序结果用MEGA5 软件分析,建立系统发育树,得到鉴定结果。
生长曲线:实验数据由origin 9.1 软件分析,取平均值为显示结果。
糖化力:在液体培养基中培养4 种真菌后,提取悬浮液中的糖化酶并测量活性。样品中还原糖通过如下公式计算[25-26]:

式中:X:样品中葡糖淀粉酶活性,U/mg;V:滴定空白样品时所用的标准葡萄糖溶液的消耗量,mL;V0:滴定样品时消耗的标准葡萄糖溶液的消耗量,mL;1:每毫升标准葡萄糖溶液中含有的葡萄糖量,mg/mL;100/5:糖化溶液的总体积与用于滴定的糖化溶液的体积的比率;60/10:比率糖化酶溶液的总体积与糖化酶溶液的体积相对应;50:真菌悬浮液的体积,mL。
产酒力和酯化力:用气相色谱法检测不同浓度梯度的样品,以峰面积为横坐标,浓度为纵坐标,绘制标准曲线。乙酸乙酯趋势线公式:y=2E-6x +0.0028,R2=0.9997。使用相同的方法,绘制乙醇浓度和峰面积的标准曲线:y=1E-5x-0.0727,R2=0.9994。将样品的峰面积值代入公式,计算样品浓度值。
2 结果与分析
2.1 菌株形态和分子生物学特征
图1 是在PDA 固体培养基上于28 ℃条件下生长3~5 d 的真菌菌落形态图片。菌株形态特征见表1。
2.2 分子生物学鉴定
使用分子生物学技术进一步鉴定未知菌株。如图2 所示,提取酵母基因组并进行PCR 反应,对PCR产物进行核酸凝胶电泳。在凝胶图中,泳道M:100 bp marker,泳道1,2:Kyle,片段大小约800 bp,泳道3,4:3091,泳道5,6:Wind-2,泳道7,8:3077,片段大小均约为600 bp。

图1 真菌形态学
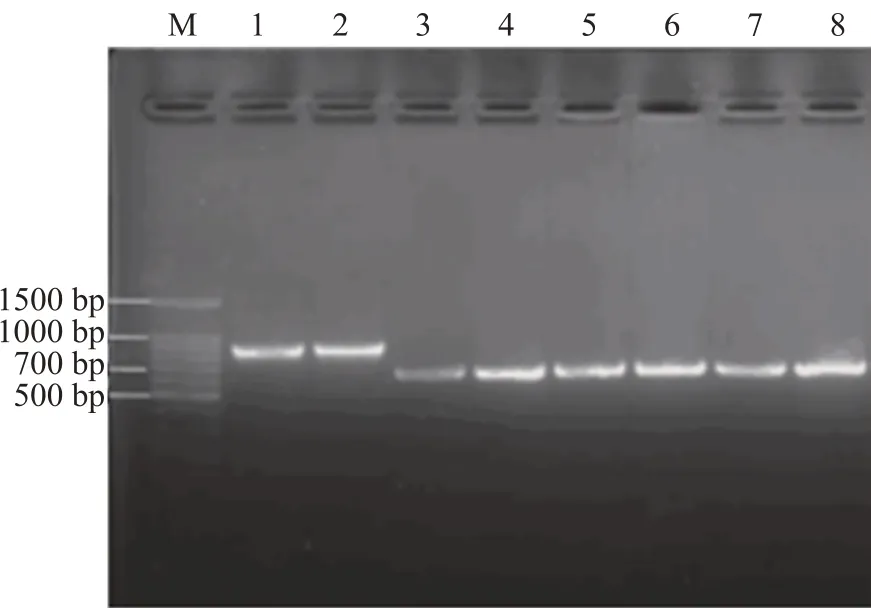
图2 Kyle、3091、Wind-2,3077的PCR产物凝胶图

表1 菌株形态特征

图3 Kyle、3091、Wind-2、3077的系统发育树
系统发育树分析:保留测序结果中可靠的序列,通过NCBI进行比较,获得具有更高同源性的已知分类群,然后选取并使用这些序列通过Mega.5软件构建系统发育树[7]。如图3 所示,经过比较,kyle 和酿酒酵母Saccharomyces cerevisiaeculture CBS:7764(KY105065.1)之间的相似性高达95%,因此它可能被鉴定为酿酒酵母,而3077,3091 和wind-2 与异常威克汉姆酵母的相似性高达99%,因此它们具有高度的同源性。菌种11 号由南昌科昌生物技术有限公司鉴定,与泡盛曲霉具有高度同源性。
2.3 菌株的生长曲线
图4 显示酵母3077、3091、Kyle、Wind-2、Geotrichum candidun、Endomycopsis在600 nm 处的OD值,而白地霉在660 nm 处测量。延滞期为0~6 h,指数生长期为6~30 h,稳定期为30 h。在细胞生长期间培养基中同时含有活细胞和死细胞,以及未使用的培养基和代谢物。因此,培养液的吸光度不能反映衰退情况[27]。
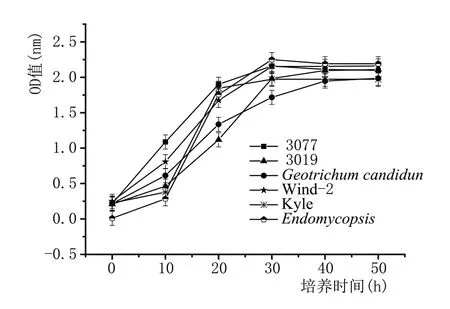
图4 酵母菌的生长曲线
计算抽滤前滤纸的干重与抽滤后滤纸和菌丝体的总干重之间的差值。在图5 中,霉菌细胞干重随时间而变化,其趋势先增加后减小。11号和红曲霉菌丝体的干重在第4 天达到最大值,而根霉菌的菌丝干重在第3天达到最大值。
2.4 菌株的糖化力
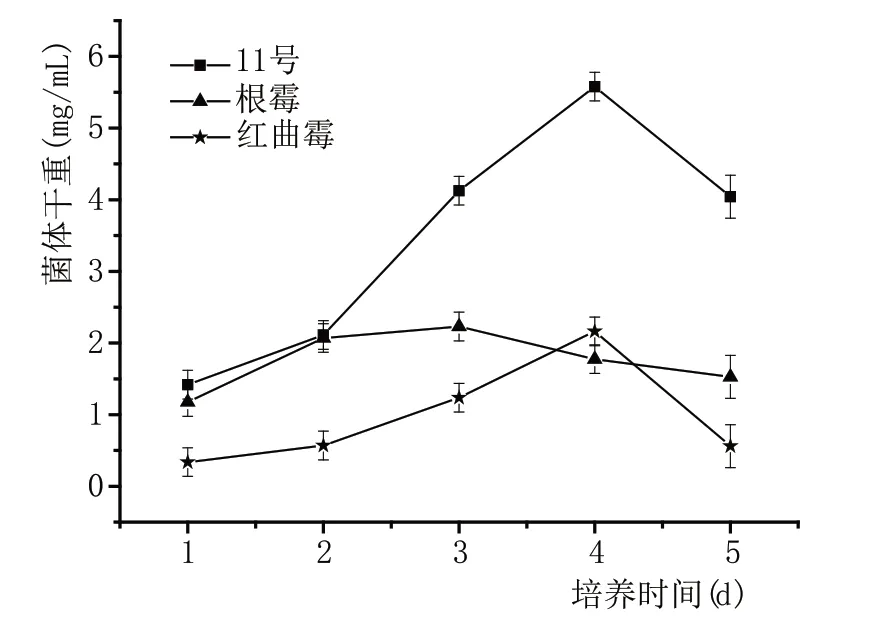
图5 霉菌生长曲线
图6 显示了3 种不同霉菌的葡萄糖淀粉酶活性随时间的变化趋势,随着时间的延长,均出现先增加而后下降的趋势。红曲霉在开始时生长缓慢,然后降低,葡萄糖淀粉酶活性达到最大值,第5 天达到5.76 U/mL;而根霉的最大葡萄糖淀粉酶活性在第3天为7.68 U/mL,11号为6.94 U/mL。

图6 霉菌糖化力
2.5 酵母的产酒能力和酯化能力
图7 是6 种酵母的乙酸乙酯产量的变化曲线。不同酵母在不同的发酵阶段表现出不同的产酯特性。在第3 天,3077、白地霉和Wind-2 的乙酸乙酯含量分别达到最高值0.178 mg/mL、0.029 mg/mL 和0.558 mg/mL;在第4天,3091,Kyle和拟内孢霉的乙酸乙酯含量分别达到最高值0.144 mg/mL,0.16 mg/mL和0.705 mg/mL。在发酵期内,菌株拟内孢霉表现出较高的合成乙酸乙酯的能力,乙酸乙酯产量明显高于其他酵母,是清香型白酒中主要的产酯酵母。

图7 酵母酯化能力
图8 显示6 株酵母合成乙醇产量的变化。随着时间的推移,3077、Endomycopsis、Kyle 和Wind-2 的乙醇产量逐渐减少,第1 天的最大含量分别为17.18 mg/mL、17.43 mg/mL、19.27 mg/mL 和27.05 mg/mL。3091 和白地霉的乙醇含量呈现先增加后减少的趋势,第4 天最高分别为8.78 mg/mL 和40.72 mg/mL。在实验测定的5 d 发酵时间内,白地霉乙醇含量最高,显著高于其他5 株酵母,表现出优异的产酒能力。

图8 酵母产酒力
3 结论
通过形态学和分子生物学鉴定,确定了核心菌株中几株未知菌株,分别属于酿酒酵母,异常维克汉逊酵母和泡盛曲霉。
在测量了菌株的糖化能力后,我们发现在这些真菌中,根霉具有最强的糖化力,最强的葡萄糖淀粉酶活性为7.68 U/mL,而糖化能力最弱的则是拟内孢霉酵母酵母,为3.175 U/mL。
在这些酵母中,结果显示具有最强酯化力的酵母是拟内孢霉酵母,乙酸乙酯产量为0.705mg/mL;其次是Wind-2,含量为0.558 mg/mL;乙酸乙酯的最低产量为白地霉,0.029 mg/mL,相反,产乙醇的能力最强,最高含量为40.72 mg/mL,产酒精能力最弱的菌株为3091,含量8.78 mg/mL。实验结果为各核心菌种在酒曲中的灵活运用及清香型白酒的酿造工艺的优化提供了理论依据。
