泥炭对人工窖泥培养的影响研究
2020-06-02张宿义康承霞邱川峰殷鹏飞
杨 艳,张宿义,秦 辉,康承霞,邱川峰,徐 琼,马 蓉,张 健,徐 伟,殷鹏飞
(泸州老窖股份有限公司,四川泸州 646000)
众所周知,传统新窖产酒酒质较差,新窖泥需要通过长年不断周而复始的酿酒生产才能自然老熟,但其老熟时间漫长,远不能满足人们物质生活的需求。人工窖泥不仅能缩短窖泥老熟的时间,还能提高产质量,因此越来越多的应用于浓香型白酒的酿造生产。与此同时针对人工窖泥的各种研究层出不穷,例如人工窖泥的工艺[1]、菌种[2]、配方[3]以及培养过程中风味物质变化[4]等,然而人工窖泥中对泥炭的使用研究极少。泥炭是湿地条件下死亡植物残体不完全碳化形成的产物,其保水性强、富含有机质、容重小[5];泥炭的土颗粒由有机质和矿物质共同组成,有机质含量较高的还具有压缩性[6]。由此特性,泥炭用于人工窖泥当中,能充当一种类似海绵体的结构,能吸纳、储存、释放营养物质,这种功能很难找到其他泥土或辅料替代,并且对窖泥感官和微生物生长具有积极的作用。所以,本文将通过对人工窖泥培养过程是否添加泥炭的跟踪测定,研究泥炭对人工窖泥的培养过程及结果的影响。
1 材料与方法
1.1 材料及仪器
1.1.1 材料
黄泥、老窖泥、窖皮泥、麸皮、豆粕、大曲粉、黄水、尾水、泥炭、磷酸氢二钾、窖泥功能菌液A、B、C、D。

表1 主要仪器设备
1.1.2 主要仪器(表1)
1.2 实验方法
1.2.1 窖泥培养方法
(1)方案设计(表2)
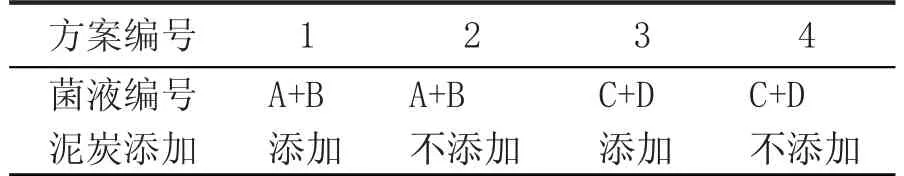
表2 方案设计
A、B、C、D 菌种液接种前的菌体数分别为:1.96×108个/mL、1.75×108个/mL、2.13×108个/mL、1.59×108个/mL;每种方案设置3次平行实验。
(2)将地面清洗干净,把黄泥均匀铺在地面上,泼上一定量的黄水和尾水,然后按比例及顺序将泥炭、麸皮、豆粕、曲粉、窖皮泥、老窖泥层层均匀铺在黄泥上面,再根据需要泼上一定量的黄水和尾水。
(3)使用耙梳和铁铲将原料和黄泥拌和均匀,窖泥功能菌液采用泼洒的方式,边泼洒菌液边用搅拌机拌和窖泥。
(4)待所有原辅料拌和均匀后且窖泥柔熟之后,将窖泥收堆成长条状,用铁铲拍光,盖上窖皮,四周用黄泥压封,密封发酵90 d以上。
1.2.2 数据采集方法
每天定时定点检测温度,每15 d 取样测定理化指标及微生物数量,文中数据为3 次平行实验的平均值。窖泥培养结束,经专家鉴定其质量后应用于酿酒生产。
1.2.3 检测方法
己酸菌计数方法:血球计数板法。
温度测定:窖池数显温度计。
水分、pH 值、氨态氮、有效磷测定:参照《白酒生产技术全书》窖泥分析[7]。
有效钾测定:参照《土壤农化分析》土壤中钾的测定[8]。
腐殖质测定:参照《森林土壤腐殖质组成的测定》[9]。窖泥微生物计数方法:稀释平板法。
2 结果与分析
2.1 窖泥培养过程升温情况(图1)
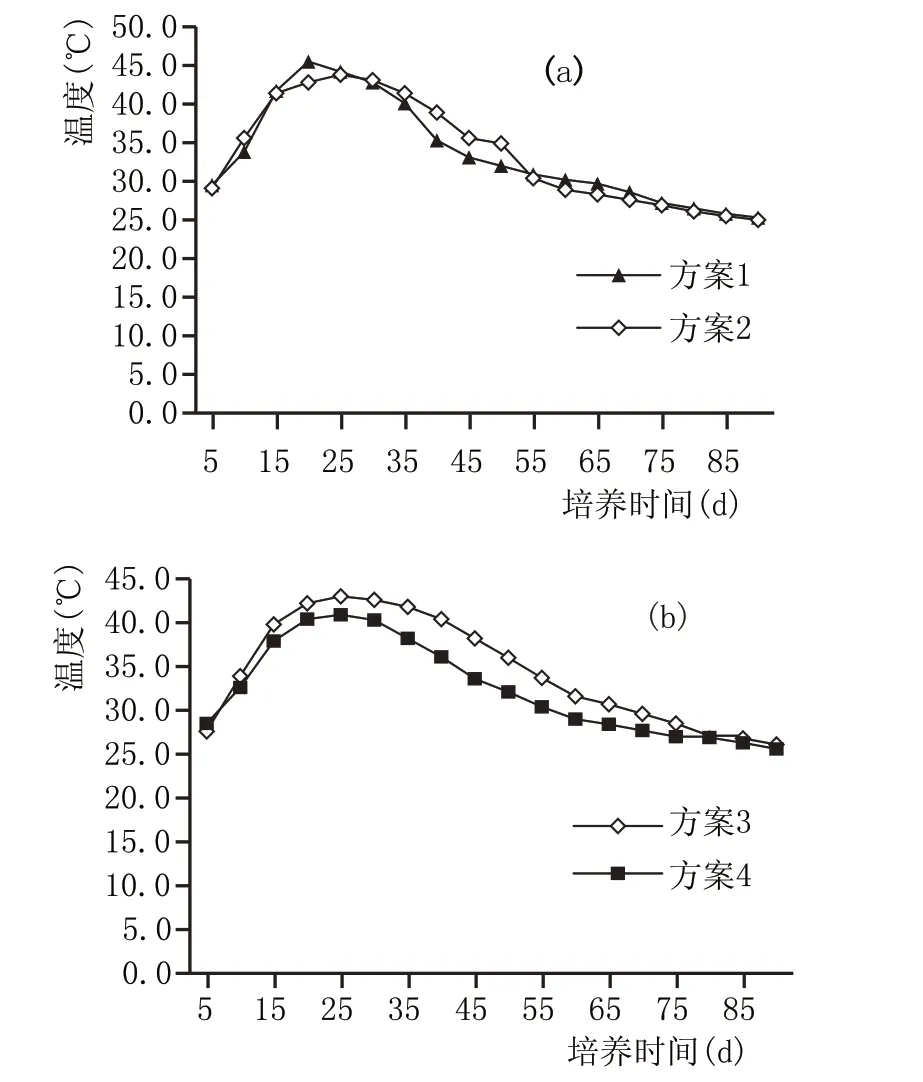
图1 窖泥培养过程温度变化情况
从图1a、图1b 可以看出,人工窖泥在培养开始后,快速升温,20 d 左右达顶温,升温幅度在10~15 ℃;中挺10 d 左右开始缓慢降温,最后趋于稳定。图1a 中加泥炭与不加泥炭的温度变化差异不明显,而图1b 中加泥炭的整体温度比不加泥炭的略高。
2.2 窖泥培养过程理化指标变化情况
2.2.1 窖泥培养过程水分含量变化(图2)

图2 窖泥培养过程水分含量变化情况
生物在生长繁殖代谢过程中会消耗水分,同时释放热量和水。从图2a、图2b 可以看出,人工窖泥培养过程水分呈上升趋势,但升幅小,都在1%的范围内变化。由于窖泥培养全过程是密封的,水分增大说明微生物在窖泥培养过程中代谢消耗的水分量小于代谢产生的水分量。加泥炭组窖泥初始水分比不加泥炭组高2%左右,且整个培养期水分均比不加泥炭组要高,说明在相同的水分下,加泥炭组窖泥水分比不加泥炭组水分更高,体现了泥炭良好的保水性能。
2.2.2 窖泥培养过程pH值变化(图3)

图3 窖泥培养过程pH值变化情况
窖泥在培养过程中,微生物生长代谢后会产生有机酸。从图3a、图3b 可以看出,随着培养时间的延长,窖泥的pH 值略有下降。培养前45 d,pH 值下降速度较快,45 d 以后下降速度变缓,直到培养结束。加泥炭组与不加泥炭组pH 值差异不明显,但加泥炭组变化幅度更小,可能原因是泥炭对窖泥培养过程形成的酸起到一定的缓冲作用。
2.2.3 窖泥培养过程氨态氮含量变化(图4)
从图4a、图4b 可以看出,窖泥培养过程中氨态氮含量增加明显,呈持续上升趋势。窖泥中大多微生物都属于异养微生物,它们分解利用蛋白质、氨基酸等有机氮后生成无机氮,窖泥中氨态氮的含量变化能反映微生物对营养物质利用情况。培养前45 d,微生物对有机氮利用速度快,45 d 以后速度变缓,这与窖泥中主体微生物细菌的数量变化趋势相似,说明氨态氮含量的变化趋势可能与微生物的数量和增殖速度有关。添加泥炭与否,对窖泥氨态氮含量无显著影响。
2.2.4 窖泥培养过程有效磷含量变化(图5)
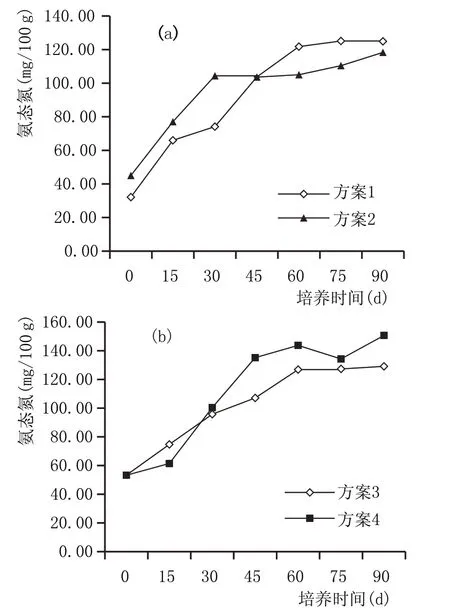
图4 窖泥培养过程氨态氮含量变化情况

图5 窖泥培养过程有效磷含量变化情况
从图5a、图5b 可以看出,有效磷含量在培养的过程中前期呈急速下降趋势,30 d 后平缓下降。微生物在生长繁殖过程中组成细胞结构需要大量的有效磷,在窖泥培养前期微生物呈对数生长,所以窖泥培养前15 d 有效磷含量急剧下降;30 d 后呈缓慢下降,后期基本稳定。其原因可能是微生物在消耗窖泥中原有有效磷的同时,也在利用微生物死亡自融后释放出来的有效磷;此外,微生物代谢会产生有机酸,而有机酸能促使固定磷向有效磷转化,从而在培养后期有效磷达成动态平衡。方案1 有效磷含量略低于方案2,方案3 有效磷含量略高于方案4,添加泥炭与否对窖泥有效磷含量无显著影响。
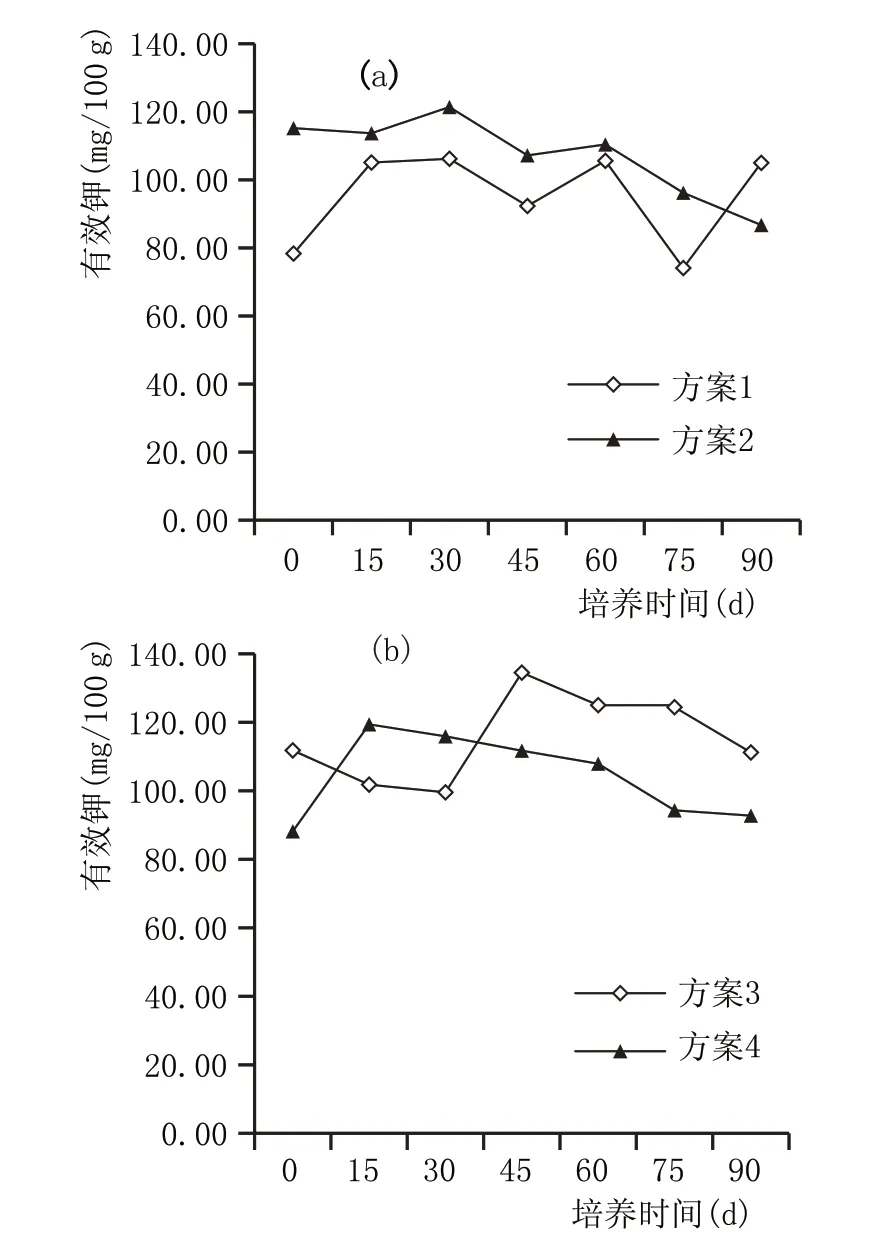
图6 窖泥培养过程有效钾含量变化情况
2.2.5 窖泥培养过程有效钾含量变化(图6)
微生物在生长繁殖的过程中,对钾的需求量较少。图6a、图6b 中添加泥炭组有效钾含量无明显规律,未添加泥炭组总体呈下降趋势。
2.2.6 窖泥培养过程腐殖质含量变化(图7)
腐殖质是已死的生物体在土壤中经微生物分解而形成的有机质,是窖泥培养过程中微生物生长的一种重要营养源。从图7a、图7b 可以看出,腐殖质含量在窖泥培养过程中呈缓慢下降趋势,说明被微生物分解利用。泥炭中含有少量腐殖质,所以加泥炭组腐殖质含量略高于不加泥炭组,但差异较小。
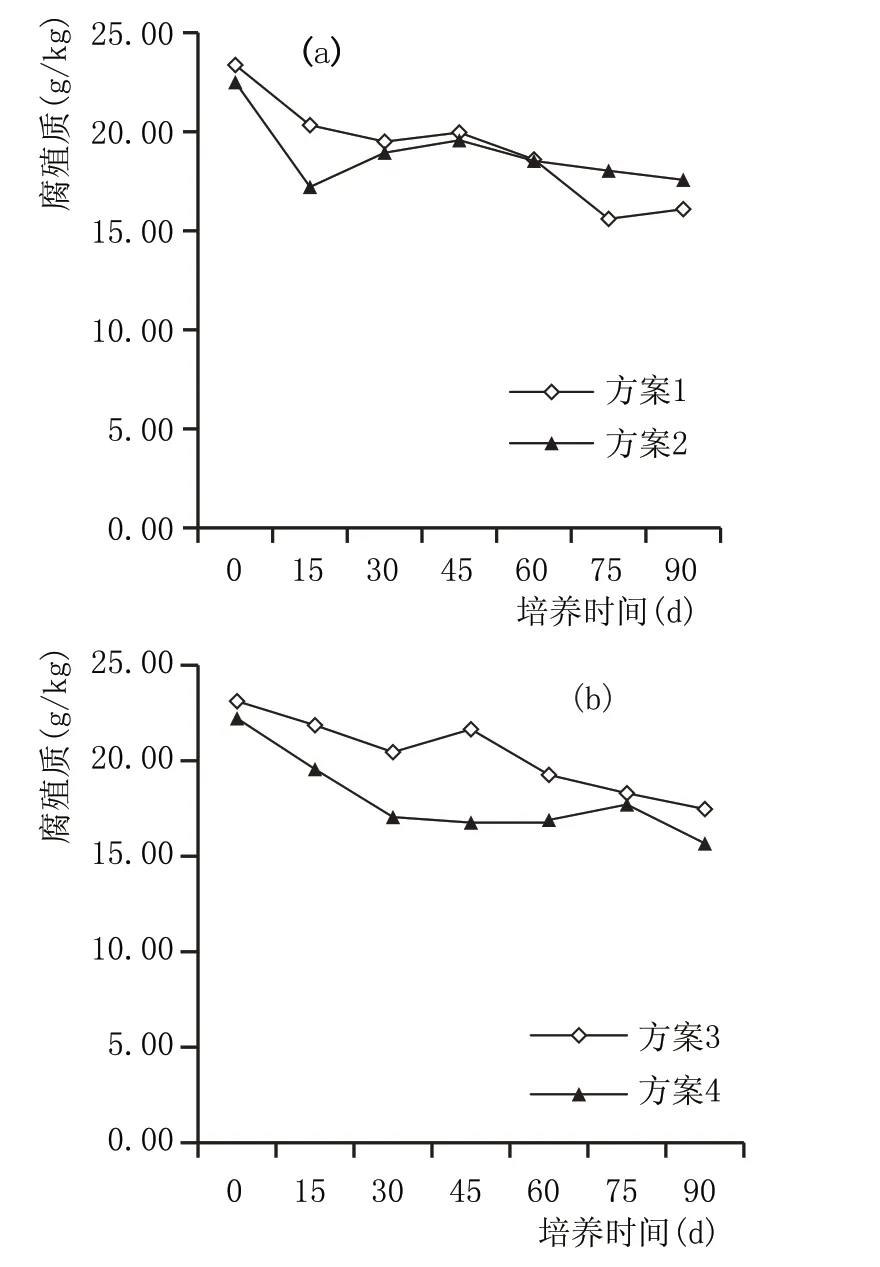
图7 窖泥培养过程腐殖质含量变化情况
2.3 窖泥培养过程微生物数量变化
2.3.1 窖泥培养过程细菌数量变化(图8)
从图8a、图8b 可以看出,窖泥在发酵过程中,前期细菌呈快速生长态势,维持一段时间后缓慢下降。其原因是窖泥培养前期,微生物数量少,营养充足,微生物呈对数生长;随着营养物的消耗以及菌体代谢后窖泥内环境的改变,好氧菌等部分菌体的衰老死亡,微生物增殖速度减慢;最后死亡率大于繁殖率,微生物数量急剧下降。窖泥培养前期,不加泥炭组细菌增长速度与数量均大于加泥炭组,培养后期不加泥炭组细菌数量下降幅度更大,可能是泥炭中含有一定量的微生物,在培养后期表现出生长优势,对衰亡细菌数量起到一定的补充作用;也可能是泥炭释放出储存的营养物质,提供给微生物生长利用,减缓了其衰亡速度。
2.3.2 窖泥培养过程芽孢杆菌数量变化(图9)
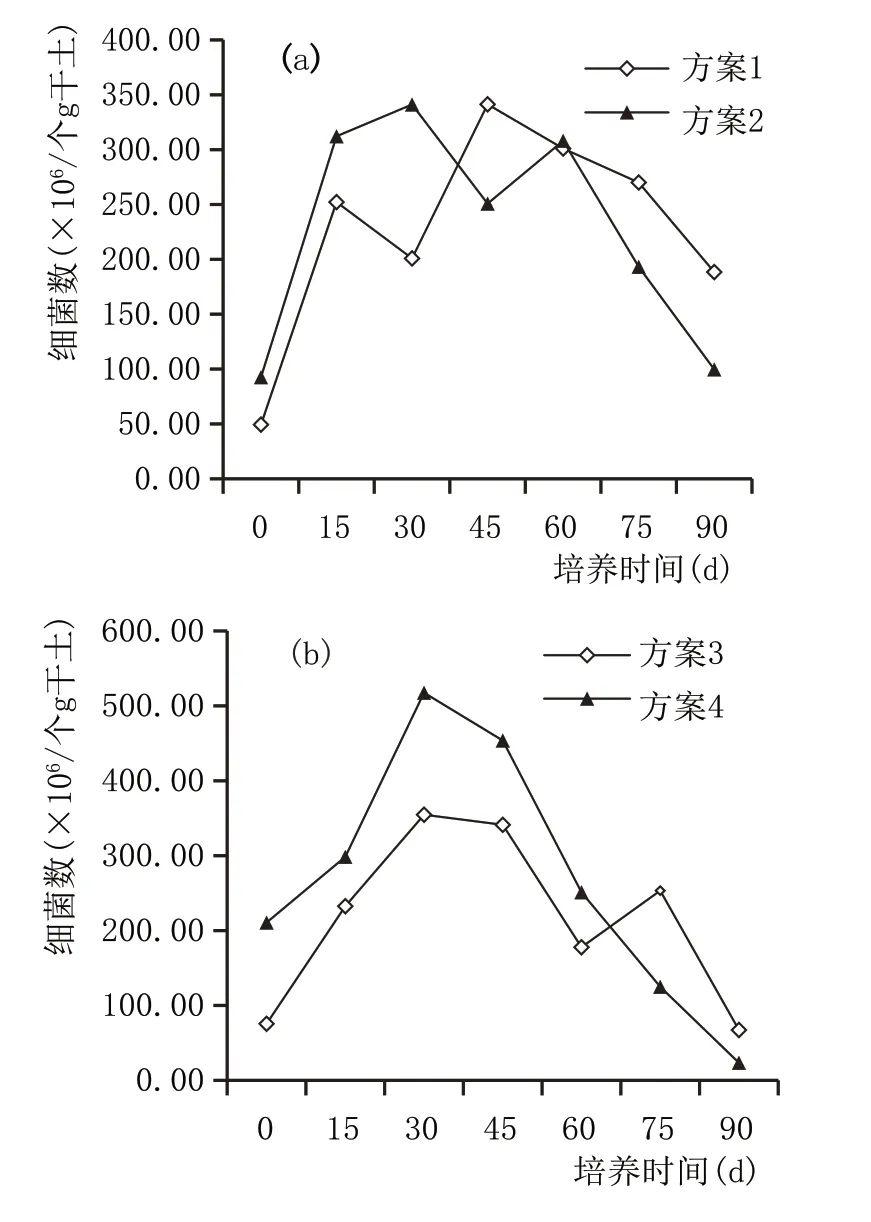
图8 窖泥培养过程细菌数量变化

图9 窖泥培养过程芽孢杆菌数量变化
由图9a、图9b 可知,芽孢杆菌生长变化规律与细菌变化规律一致,呈现先增加后降低的趋势,但加泥炭与不加泥炭组与细菌表现出的特征有所区别:加泥炭与不加泥炭组在培养45 d 以前,芽孢杆菌增长速度与数量基本一致,45 d 以后,方案1 芽孢杆菌降幅大于方案2,方案3 大于方案4,即加泥炭组下降幅度更大。可能是泥炭中本身含有的芽孢杆菌数量少,不能对衰亡的芽孢杆菌数量起到补充作用;同时接入的窖泥功能菌属于兼性厌氧菌,在微氧条件下更具生长优势。泥炭的疏松特性,给窖泥带来了更多的氧含量,一定程度上抑制了窖泥功能菌的生长,导致芽孢杆菌数量在后期降幅明显。
2.3.3 窖泥培养过程霉菌数量变化(图10)

图10 窖泥培养过程霉菌数量变化
从图10a、图10b 可以看出,霉菌数量在窖泥培养前期急剧下降,后期数量极少。其原因是霉菌为好氧菌,窖泥培养开始后,微生物数量呈指数增加,消耗了大量的氧,培养中后期窖泥环境难以满足生长条件,数量快速下降。是否添加泥炭与霉菌数量变化无明显关系。
2.3.4 窖泥培养过程酵母菌数量变化(图11)
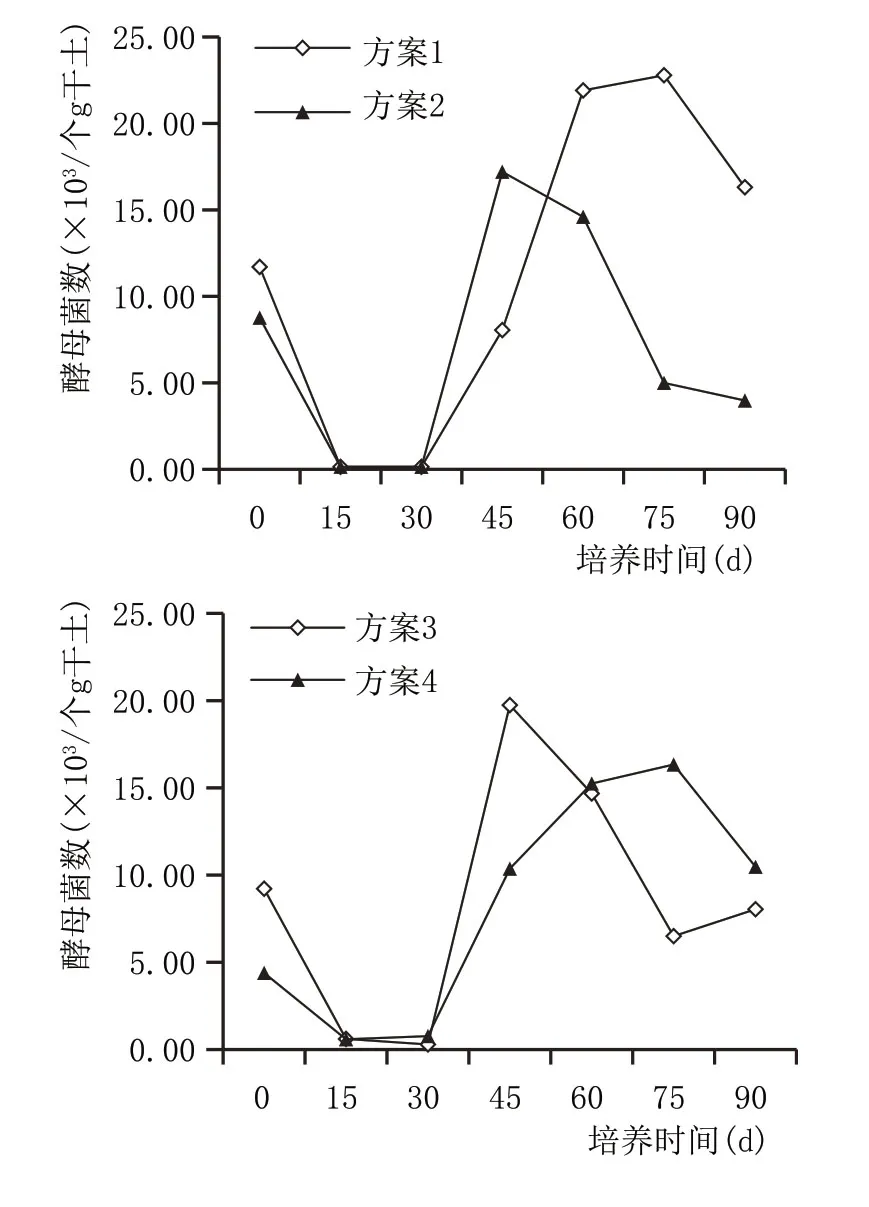
图11 窖泥培养过程酵母菌数量变化
窖泥培养过程,酵母数量呈先减少、后增加、再减少的变化趋势。酵母菌属于兼性厌氧菌,窖泥培养前期,泥堆升温快,最高达到45 ℃以上,高温以及氧的快速消耗共同导致了酵母菌数量的急剧下降,并以少量孢子的形式存在;培养45 d左右,伴随泥堆温度降低,酵母菌孢子开始成长,酵母菌数量增加;窖泥培养后期,营养物减少、窖泥酸度变化,酵母菌数量逐渐下降。是否添加泥炭与酵母菌数量变化无明显关系。
2.4 窖泥感官评价(表3)
人工窖泥培养结束后,通过对其色泽、气味和手感来比较培养效果,4 种方案培养的窖泥皆为褐色,香气纯正、窖香味浓,柔熟、均匀,感官差异不明显。

表3 窖泥感官评价
3 结论
针对本次实验结果分析,可以得出以下结论:(1)相同的水分下,泥炭的添加有利于窖泥储水和保水;(2)泥炭能为窖泥提供少量腐殖质营养;(3)泥炭对人工窖泥的酸度有缓冲调节作用;(4)泥炭对窖泥中细菌的衰亡有一定缓冲作用,但其培养后期芽孢杆菌衰亡更快,对酵母菌和霉菌数量影响不明显;(5)泥炭对人工窖泥氨态氮、有效磷、有效钾含量影响不明显;(6)加泥炭与不加泥炭培养的窖泥感官质量无明显差异。
后续将培养的窖泥应用于酿酒生产并进行多排跟踪,对比基础酒产质量、窖泥老熟程度,以此对培养人工窖泥是否需要添加泥炭作出科学的评判。
