玻璃体切除术中直视下睫状体光凝和引流阀植入治疗新生血管性青光眼疗效对比分析
2020-06-01黄晓菁黄盛梅
黄晓菁 黄盛梅
(1.浙江中医药大学 杭州 310053;2.上海市浦东新区公利医院眼科 上海 200135)
新生血管性青光眼(neovascular glaucoma,NVG) 是由于各种原因引起虹膜表面及前房角有新生血管及纤维血管膜,病变累及小梁网,使周边虹膜与小梁网和角膜后壁粘连,引起前房角关闭、房水外流受阻的一种难治性青光眼,多继发于糖尿病视网膜病变、视网膜中央静脉阻塞及分支静脉阻塞、视网膜缺血综合征等视网膜血管性疾病[1]。临床上治疗NVG常采用降眼压药物和外滤过手术等方式,但治疗后患者新生血管仍会继续生长而导致眼压控制效果不佳,造成复发甚至眼球摘除。睫状体光凝是利用激光破坏睫状上皮使睫状体发生凝固性坏死,直接减少睫状体的房水生成从而起到降眼压的作用。本研究对需要行玻璃体切除术的患者行直视下睫状体光凝和引流阀植入术统计分析效果后发现,前者在早期提高患者术后视力方面更具优势。
1 资料与方法
1.1 资料 回顾分析2014年5月~2019年1月在我院住院治疗的NVG患者32例(32眼) 的临床资料,病因为糖尿病视网膜病变及视网膜中央静脉阻塞。所有病例均行裂隙灯、房角镜检查,见虹膜面和房角新生血管,眼压升高,均符合NVG诊断。排除标准:合并全身手术禁忌证者;合并肝、肾功能异常或血糖控制不佳者。
根据手术方式分为玻璃体切除术中直视下睫状体光凝术( A组,15例)和青光眼引流阀植入(B组,17例)。A组男性6例、女性9例;年龄41~68岁,平均(56.80±7.11)岁;术前平均眼压为(46.26±10.62)mmHg(1 mmHg=0.133 kPa);视力:无光感~0.05;致病原因:糖尿病视网膜病变7眼、视网膜静脉阻塞8眼。B组男性8例、女性9例;年龄37~70岁,平均(56.35±9.09)岁;术前平均眼压为(48.33±5.03)mmHg;视力:无光感~0.12;致病原因:糖尿病视网膜病变10眼、视网膜静脉阻塞7眼。2组患者均在术前1周左右注射康柏西普。2组患者性别组成、年龄、术前眼压等差异均不具有统计学意义(P值均>0.05),具有可比性。比较2组患者术前和术后1、3、6个月视力、眼压及术后并发症情况。
1.2 方法
1.2.1 手术方法 患者取仰卧位,常规铺巾、消毒后,采用4 mg/mL盐酸奥布卡因滴眼液行眼球表面麻醉,用1 mL注射器吸取0.05 mL康柏西普(成都康弘生物科技有限公司)于颞上方角膜缘后3.5 mm穿刺进入玻璃体后缓慢推入玻璃体腔,术后用左氧氟沙星滴眼液和降眼压药物滴眼。
玻璃体内注射康柏西普后1周进行玻璃体切除术或者Ahmed青光眼引流阀植入术。手术方式选择依据:有明显玻璃体积血影响眼底检查及原发病治疗的行玻璃体切除术,玻璃体无积血或仅有少量积血但角膜水肿明显影响视网膜检查及激光的先行植入引流阀。玻璃体切除术采用球后神经阻滞麻醉,常规睫状体平坦部三通道切口,行玻璃体全切除,同时行全视网膜光凝术。完成玻璃体手术后,巩膜顶压器顶压暴露睫状突,内眼激光行180°~240°睫状突光凝,直至出现睫状突变白。激光参数:光斑直径200 μm,光凝时间400 ms,光凝能量400~700 MW。根据光凝时睫状体组织反应对激光参数进行调整,以光凝后睫状突变白、塌陷皱缩为最佳。B组患者等待眼压下降,角膜透明后尽快行全视网膜激光光凝。
Ahmed青光眼引流阀植入术选择在颞上象限,做以穹隆为基底的结膜瓣,分离筋膜;于巩膜表面向后做钝性分离,将引流阀置于颞上方赤道部巩膜表面,距离角膜缘约10 mm处用5-0丝线从引流盘前端的2个孔将其固定于巩膜表面。在距离角膜缘7 mm处制作巩膜桥型瓣备用,距离角膜缘4 mm处用21 G针头在1/3巩膜厚度下潜行隧道穿刺进入前房,引流管于巩膜桥型瓣下通过隧道并在前房留置合适长度,用8-0可吸收线间断缝合筋膜和球结膜。
1.2.2 视力评估方法 使用国际标准视力表评估视力[2]:以<0.05、0.05~0.08、≥0.1划分视力等级,术后视力较术前提高或降低1个等级为视力提高或降低,与手术前视力等级相同为视力稳定。
1.3 统计学处理 采用SPSS 18.0统计学软件处理数据。比较2组患者术前和术后1、3、6个月眼压及术后视力变化情况。计量资料采用均数±标准差表示。治疗前、后的平均眼压比较采用配对样本t检验分析,计数资料比较采用χ2检验,统计显著性α= 0.05。
2 结果
2.1 眼压 治疗前2组患者眼压比较差异无统计学意义(P>0.05) ,治疗后1、3、6个月眼压较治疗前均显著降低(P值均<0.05),术后不同时间2组间眼压差异均无统计学意义(P值均<0.05;表1)。

表1 2组患者术前和术后眼压情况
2.2 视力 术后1个月,A组患者术后视力提高人数(10例)显著高于B组(5例),差异具有统计学意义(P=0.03)。术后3个月和6个月视力稳定。术后6个月,A组视力<0.05者6眼,0.05~0.08者3眼,≥0.1者6眼。B组视力<0.05者4眼,0.05~0.08者5眼,≥0.1者8眼,组间比较差异无统计学意义(P值均>0.05;表2)。
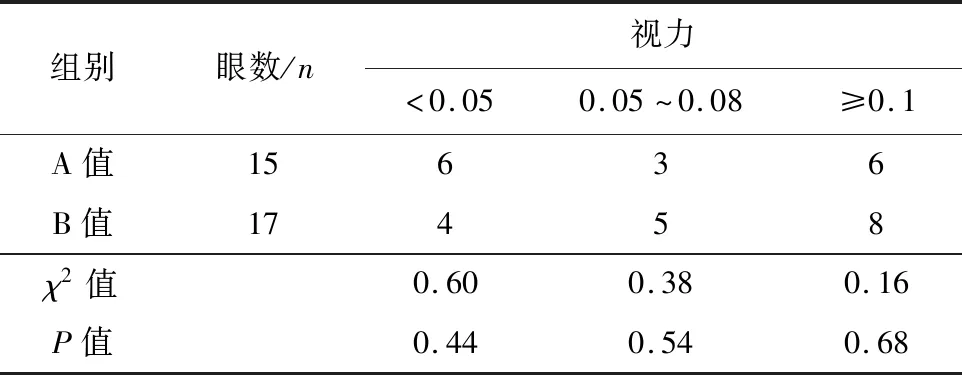
表2 术后6个月2组间视力比较
2.3 术后并发症 2组患者术后早期并发症为前房积血、前房炎症反应、术后早期低眼压、玻璃体积血、脉络膜脱离等,2组的并发症发生率比较,差异无统计意义(P>0.05)。
3 讨论
NVG是一类以虹膜和房角新生血管形成为特征的继发性青光眼,病因大多为各种疾病导致的广泛眼后节缺氧或局部性眼前节缺氧,致盲率高。积极行原发病治疗及手术干预可以缓解疼痛,提高视力,提高患者生活质量。但由于NVG患者到眼科就诊时病情往往已经发展至终末期,高眼压常伴随角膜水肿或合并晶状体等屈光间质浑浊,常无法对导致新生血管的原发病进行处理。2013年之后,抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗极大改变了NVG降眼压治疗的策略[3],但抗VEGF治疗只是暂时使得新生血管消退、眼压下降,效果维持时间短,并不能从根本上彻底消除缺血、缺氧状态。抗VEGF后再采用手术治疗是比较常用的方法,睫状体破坏术和引流阀植入术是比较有效的2种手术方式。
NVG多继发于视网膜缺血疾病,首要病因为糖尿病视网膜病变(构成比为52.6%),其次为视网膜静脉阻塞(构成比为28.0%)[3],而这些疾病中有不少需要行玻璃体手术治疗以清除积血、复位视网膜以及视网膜激光光凝治疗;玻璃体切除后,直接顶压暴露睫状突,再行睫状突激光光凝,使房水分泌减少而降低眼压。
临床上比较常用的睫状体光凝主要是经巩膜睫状体光凝,包括微脉冲激光透巩膜光凝[4],另外还有内镜下睫状体光凝。我们采用的顶压后直视下睫状突光凝,能更直观精确控制光凝范围以及光斑反应。但此方法因需充分暴露睫状突,对于熟练的眼底外科医师来说,充分顶压完全可以很好地暴露睫状突,而不像文献[5]所说的必须摘除晶状体以及晶状体前后囊。
关于激光能量,有学者[6]用600~900 MW,我们用400~700 MW。太大能量可能会出现气泡以及色素播散,太小能量可能导致光凝不彻底。直视下睫状突范围目前无法定量估算,完全依靠术者根据患者的年龄、病情等凭经验实施,光凝过量可能出现房水分泌不足而致眼球萎缩,而光凝不足又不能很好控制眼压。本研究统计有2眼术后眼压>25 mmHg,但因未达到30 mmHg,故未再处理。
眼内激光睫状突光联合玻璃体切除术中,睫状突光凝范围为180°~240°,光凝范围越大降压效果越好,术后6个月趋于稳定。本研究中样本量少,未出现需要重复激光的病例。何珂等[6]认为,术后1个月眼压下降幅度最大,而术后18~24个月时降压效果明显减弱,可能与睫状突上皮再生有关。本研究中单纯引流阀植入患者,待眼压下降、角膜透明后尽快行眼底激光治疗,也能很好地控制眼压。
对于需要玻璃体手术清除玻璃体积血的患者来说,眼内激光睫状突光凝联合玻璃体切除保证了光线到达视网膜的视觉通路通畅,在视力提高方面比其他手术具有优势[7]。本研究表明,术后1个月行睫状突光凝联合玻璃体切除手术的患者视力明显高于单纯行引流阀植入的患者。而术后6个月,2组患者原发病得到了充分的治疗,视力趋于稳定,差异无统计学意义。
本研究所统计样本量偏小,术后长期效果以及安全性、稳定性还要在以后的工作中多收集样本来验证。对于治疗NVG而言,需要玻璃体切除的患者同时行直视下睫状体光凝术相对于单纯引流阀植入的患者在早期提高术后视力方面具有优势,是一种可选择的治疗方法。
