Fru-Gly化合物的合成条件优化及其抗氧化活性
2020-05-24宋莹蕾付桂明
宋莹蕾 万 茵* 付桂明,3 郭 岚
(1 南昌大学 食品科学与技术国家重点实验室 南昌330047 2 南昌大学食品学院 南昌330031 3 南昌大学中德食品工程中心 南昌330047 4 南昌大学分析测试中心 南昌330047)
1-氨基-1-脱氧-2-酮糖又名Amadori 化合物,是美拉德反应初期阶段形成的关键中间体。该物质是由N-取代葡萄糖胺经Amadori 重排而来,在其形成阶段不产生香气,是重要的非挥发性香味前体物[1],对食品的风味、色泽及营养价值具有重要作用。
近年来关于Amadori 化合物的研究主要集中于烟草行业[2-4],有关食品中Amadori 化合物的研究也逐渐增多,比如Yuan 等[5-6]利用液-质谱联用法同时测定葡萄干、新鲜大蒜和黑蒜中Amadori化合物及Heyns 化合物的含量;Katayama H 等[7]同时测定了酱油中的20 种Amadori 化合物。目前,用于测定Amadori 化合物含量的方法主要包括高效阴离子色谱串联脉冲安培检测器法[8]、高效阴离子色谱串联质谱法[9]及高效液相色谱-串联质谱法[10]。
近年来,美拉德反应产物(Maillard reaction products,MRPs)的抗氧化活性一直是研究的热点[11-12]。有研究报道,美拉德反应产物中,尤其是中间产物还原酮、类黑精以及其它一些衍生物,不仅对食品的风味、色泽,营养价值和稳定性具有重要影响,而且具有较强的抗氧化活性[13-14]。然而,对于美拉德反应初期阶段形成的Amadori 化合物的抗氧化活性的研究不多。如Koch[15]研究发现番茄制品中的1-脱氧-1-L-组氨酸-D-果糖(Fructose-Histidine,Fru-His)具有抗氧化活性,它与番茄红素相互作用可以降低前列腺癌的风险。刘丽敏[16]人工合成红参中精氨酸单糖苷(Fructose L-Arginine,Fru-Arg)并对其抗氧化活性进行研究,发现Fru-Arg 具有一定的DPPH 自由基清除能力。肜霖[17]研究发现1-脱氧-1-L-丙氨酸-D-果糖、1-脱氧-1-L-缬氨酸-D-果糖和1-脱氧-1-L-脯氨酸-D-果糖具有抗氧化活性。Mossine 等[18]研究发现Fru-His 具有潜在的抗氧化活性。目前对于Fru-Gly 化合物抗氧化活性的研究仍处于空白。
目前Amadori 化合物的相关标准品难以获得并且价格昂贵,利用UPLC-TOF MS-MS 法检测其生成量,从而对其合成工艺进行优化的试验成本较高。为降低成本,本文利用UPLC-TOF MSMS 法测定不同反应条件下葡萄糖和甘氨酸反应合成Fru-Gly 化合物的浓度,并对其抗氧化活性进行测定,以说明Fru-Gly 化合物具有一定的抗氧化活性。由相关性分析说明其浓度与DPPH、ABTS、还原力法测定的抗氧化能力的相关性,为Amadori 化合物的合成工艺优化和美拉德反应产物研究提供参考。
1 材料与方法
1.1 材料与试剂
Fru-Gly 化合物,加拿大TRC 试剂公司;Amberlite IR-120H+阳离子交换树脂、DPPH、ABTS、甲醇(色谱纯),美国Sigma 公司;乙腈(色谱纯),百灵威科技有限公司;甲酸(色谱级),上海安谱科学仪器有限公司;葡萄糖,阿拉丁试剂有限公司;甘氨酸、盐酸、氯化钠、氨水、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁,均为国产分析纯试剂。
1.2 仪器与设备
TripleTOF 5600+ LC-TOF MS-MS,美国AB Sciex 公司;Shim-pack GIST C18(2.1 mm×75 mm,2 μm)液相色谱柱,日本岛津;HH-6 数显恒温搅拌水浴锅,金坛市城东新瑞仪器厂;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;TU-1900 双光束紫外分光光度计,北京普析通用电器有限责任公司。
1.3 方法
1.3.1 Fru-Gly 标准曲线的制作 精密称取Fru-Gly 标准品0.0050 g,置于10 mL 容量瓶中,用蒸馏水溶解并定容,配制成500 μg/mL 的贮存液。准确吸取0.1 mL 贮存液于50 mL 容量瓶并定容,配成质量浓度为2 μg/mL 的母液。依次稀释母液,得到系列标准液质量浓度为1,0.5,0.2,0.1,0.05 μg/mL。
1.3.2 Fru-Gly 化合物合成条件单因素试验
1.3.2.1 反应时间 保持葡萄糖和甘氨酸物质的量比为3∶1,溶于30 mL 冰乙酸中,在80 ℃水浴条件下回流不同时间(0.5,1,1.5,2,2.5 h)。反应完成后倒入培养皿中,在40 ℃水浴下将冰乙酸挥发完全,加10 mL 蒸馏水溶解。将样品置于4 ℃保存,用于后续的样品纯化。
1.3.2.2 反应温度 保持葡萄糖和甘氨酸物质的量比为3∶1,溶于30 mL 冰乙酸中,在不同反应温度(70,75,80,85,90 ℃)下回流1 h,后续操作同上。
1.3.2.3 葡萄糖和甘氨酸的物质的量比 将不同物质的量比(5 ∶1,4 ∶1,3 ∶1,2 ∶1,1 ∶1,1 ∶2)葡萄糖和甘氨酸溶于30 mL 冰乙酸中,在80 ℃水浴条件下回流1 h,后续操作同上。
1.3.3 响应面优化试验 根据单因素试验结果,选取反应时间、反应温度及葡萄糖和甘氨酸物质的量比3 个因素,分别以A、B、C 表示并作为自变量进行3 水平试验。每个自变量的低、中、高试验水平分别以-1,0,1 进行编码,以生成Fru-Gly 化合物的浓度为响应值,根据Box-Behnken 的设计原理,利用Design-Expert 8.0.6 软件设计响应曲面分析试验。响应面设计试验因素和水平见表1。
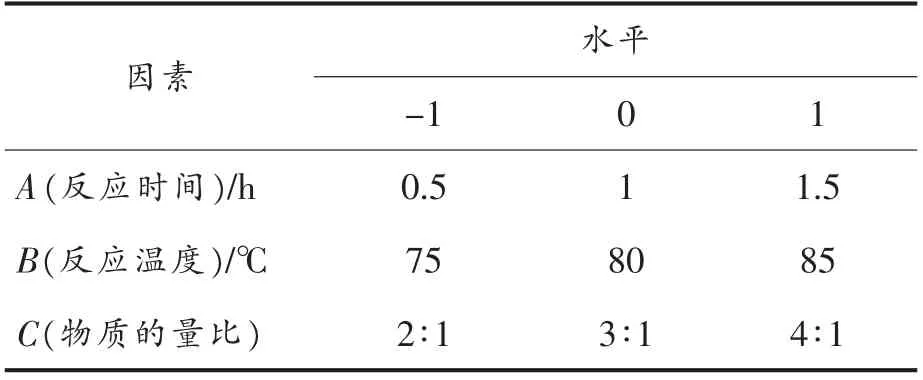
表1 响应面设计试验因素与水平Table1 The factors and levels of response surface experiment
1.3.4 样品的纯化[19]由于糖、有机酸等物质对质谱分析有基质效应,因此样品在LC-TOF MSMS 分析前需进行纯化。取制备的0.3 mL 样品加入Amberlite IR-120H+阳离子交换树脂自制小柱中,先用20 mL 蒸馏水洗脱树脂,洗去未反应的糖等水溶性杂质,再用20 mL 0.2 mol/L 氨水溶液洗脱树脂并收集氨水洗脱液。将此纯化洗脱液在50℃条件下真空旋转蒸发5 min,用蒸馏水定容25 mL,即纯化样液,备用,。
1.3.5 Fru-Gly 分析的色谱条件 色谱柱:Shimpack GIST C18(2.1 mm×75 mm,2 μm);洗脱溶剂:0.1%甲酸乙腈溶液(A)和0.1%甲酸水溶液(B);流速0.2 mL/min;柱温30 ℃;进样量10 μL;等度洗脱:5%A 和95%B。
1.3.6 质谱条件 电喷雾离子源,正离子模式;离子源电压5 500 V,温度550 ℃;气帘气为206 850 Pa,辅助气1 为344 750 Pa,辅助气2 为344 750 Pa;碰撞能18 V;裂解电压40 V。
1.3.7 Fru-Gly 分析的褐变程度的测定[20]准确移取1.3.2 节制备的样品0.1 mL,稀释适当倍数后,以蒸馏水作为空白对照,在波长420 nm 处测定吸光值A420,每个样品平行测3 次。
1.3.8 抗氧化活性的测定 测定1.3.4 节所得纯化样液的抗氧化活性,每个样品平行测3 次。
1.3.8.1 DPPH 自由基清除能力的测定 DPPH 自由基清除试验参照Lu 等[21]的方法,并稍作修改。取2 mL 纯化样液,加入2 mL 现配的0.1 mmol/LDPPH 甲醇溶液,混合摇匀后室温下置于暗处静置30 min,于波长517 nm 处测定吸光值。DPPH 自由基清除率的计算公式为:

式中:Ai——纯化样液与DPPH 甲醇溶液的吸光值;Ao——蒸馏水与DPPH 甲醇溶液的吸光值;Aj——纯化样液与甲醇溶液的吸光值。
1.3.8.2 ABTS 自由基清除能力的测定 ABTS 自由基清除试验参考闫旭等[22]的方法并稍作修改。首先配制7 mmol/L ABTS 水溶液和2.45 mmol/L过硫酸钾水溶液,将两者的混合物避光放置12~16 h 得到稳定的ABTS+·母液。使用时需将ABTS+·母液用蒸馏水稀释合适的倍数,使其在734 nm 处的吸光值为0.70±0.02。
具体操作步骤:取0.8 mL 纯化样液,加入3.2 mL ABTS 工作液,轻微振荡混匀并置于暗处反应6 min,随后测定734 nm 处的吸光值。ABTS 自由基清除率的计算公式:

式中:As——纯化样液与ABTS 工作液的吸光值;Ac——蒸馏水与ABTS 工作液的吸光值;Ab——纯化样液与蒸馏水的吸光值。
1.3.8.3 还原能力的测定[23]取2 mL 纯化样液,加入2 mL 0.2 mol/L 磷酸缓冲溶液(pH 6.6)和2 mL 1%铁氰化钾(K3Fe(CN)6)溶液,混合均匀后放入50 ℃温水浴20 min,取出,立即冷却。加入2 mL 10%三氯乙酸(TCA),振荡摇匀后取上述溶液2 mL 于新的10 mL 离心管中,加入2 mL 蒸馏水和0.3 mL 0.1%三氯化铁(FeCl3)溶液,振荡混匀后静置10 min,于波长700 nm 处测定吸光值。以2 mL 蒸馏水代替纯化样液,相同操作下测定波长700 nm 处吸光值。吸光值越大,样品的还原能力越强。还原力的计算公式:

式中:As——纯化样液的吸光值;Ab——蒸馏水的吸光值。
1.4 数据分析
采用SPSS 21.0 软件进行数据的方差和相关性分析,用Origin 9.0 作图。
2 结果与分析
2.1 Fru-Gly 标准曲线的制作
配制一系列不同浓度的Fru-Gly 标准溶液进行液-质谱分析,定量碎片离子峰为88[19]。以标准溶液的浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到回归方程y=131601x+3354.1,相关系数R2=0.9998。Fru-Gly 化合物在质量浓度0.05~1 μg/mL 范围与峰面积具有良好的相关性。
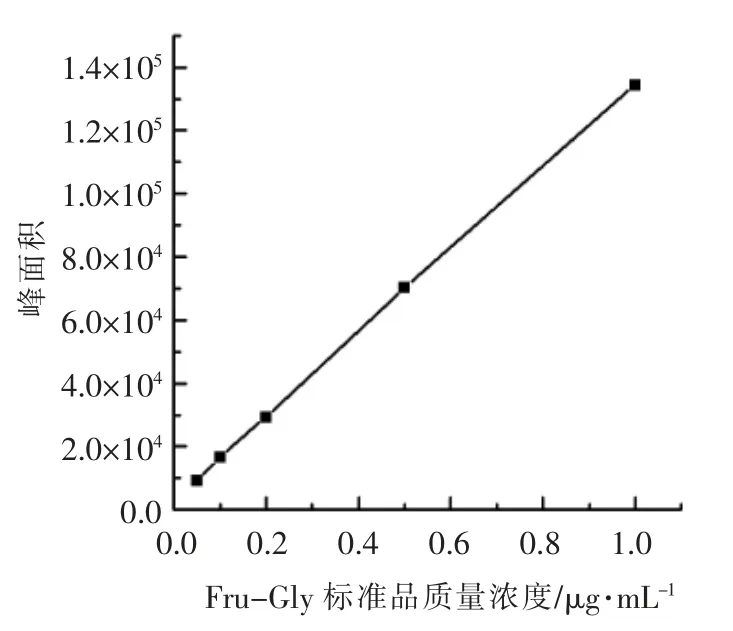
图1 Fru-Gly 化合物的标准曲线Fig.1 Calibrationdata of Fru-Gly compounds
2.2 单因素试验结果
2.2.1 反应时间对反应体系生成Fru-Gly 化合物浓度及褐变程度的影响 将纯化样液稀释100倍,过0.22 μm 滤膜,进行液-质谱分析。将得到的峰面积代入标准曲线,计算纯化样液中Fru-Gly化合物浓度,结果如图2a 所示。随着反应时间的增加,Fru-Gly 化合物的浓度先增加后急剧减少。在Maillard 反应的过程中,A420作为监测反应褐变程度的特征吸收值,是判断Maillard 反应高级阶段的重要标志,吸光值越大,Maillard 反应的进程越快,生成的类黑精也越多,吸光值越小则相反[24]。由图2b 可知,随着反应时间的延长,反应体系的褐变程度也在增大。当反应时间为0.5 h 时,反应体系的吸光值仅为0.334,说明此时的褐变程度比较小,Maillard 反应进行到高级阶段的程度低,原因主要在于反应时间过短使反应不完全,反应结束后,仍有大量的原料未参与反应。当反应时间为2.5 h 时,吸光值达到1.202,是反应时间为0.5 h 时的3.6 倍,此时的褐变程度很高。Fru-Gly 化合物质量浓度在反应时间为1 h 时达到最大值56.44 μg/mL,之后随着反应时间的增加,其浓度迅速降低。由于Amadori 化合物主要在Maillard反应的初级阶段形成,反应时间长,生成的Fru-Gly 化合物进一步参与Maillard 反应的后续反应,导致Fru-Gly 化合物浓度降低,该结果与图2b 所示的反应时间大于1 h 后,褐变程度越来越高,反应体系进行到Maillard 反应高级阶段的程度越来越高的结果保持一致。当反应时间为0.5 h 时,Fru-Gly 化合物的浓度偏低是因为反应时间过短,反应不完全,仍有大量反应原料未参与反应。
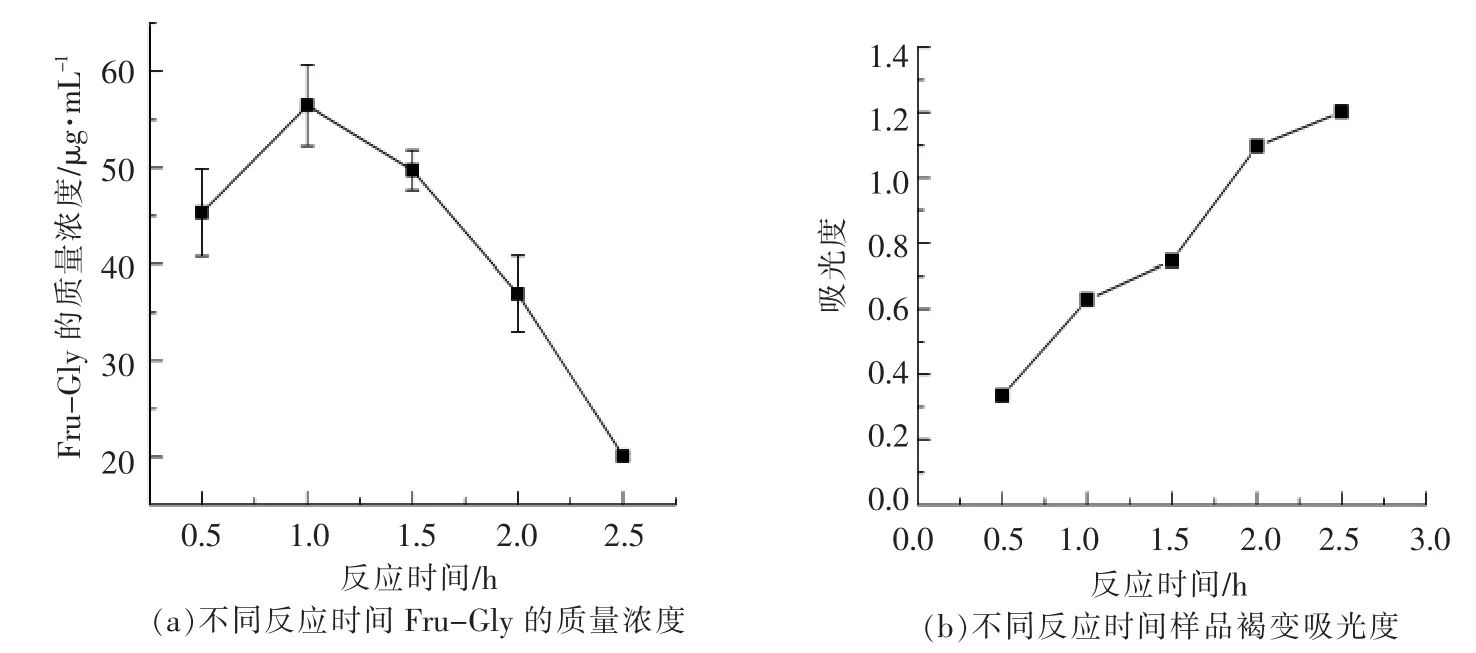
图2 反应时间对反应体系生成Fru-Gly 化合物浓度及褐变程度的影响Fig.2 Effect of reaction time on the concentration of Fru-Gly compounds generated and browning degree
2.2.2 反应温度对反应体系生成Fru-Gly 化合物浓度及褐变程度的影响 由图3a 可知,随着反应温度的增高,Fru-Gly 化合物浓度呈先增加后减少的趋势。当反应温度70~80 ℃时,随着温度的增高,Fru-Gly 化合物浓度不断增高,80 ℃时反应体系中Fru-Gly 化合物浓度达到最大值,之后,随着温度的增高,Fru-Gly 化合物浓度反而急剧减少。由图3b 可以看出,随着反应温度的增高,反应体系的褐变程度不断增加。Maillard 反应受温度的影响较大,温度越高,褐变程度越大,褐变的速率也越大[25]。当温度从70 ℃升到80 ℃时,褐变的速率远小于温度从80 ℃升到90 ℃的。当反应温度为70 ℃时,反应不完全,有大量的原料剩余。当反应温度为75 ℃时,仍有少量的原料剩余,这也是这两个温度下,反应体系褐变程度较低的原因。结合图3a、3b 可知,温度越高,反应体系的褐变程度越高,Maillard 反应的进程越大,生成的部分Fru-Gly化合物参与Maillard 反应的后续反应。当温度超过80 ℃时,反应体系生成的Fru-Gly 化合物浓度逐渐降低。当温度低于80 ℃时,反应体系仍有相当部分原料未参与反应,导致Fru-Gly 化合物的浓度低。

图3 反应温度对反应体系生成Fru-Gly 化合物浓度及褐变程度的影响Fig.3 Effect of reaction temperature on the concentration of Fru-Gly compounds generated and browning degree
2.2.3 物质的量比对反应体系生成Fru-Gly 化合物浓度及褐变程度的影响 由图4a 可知,随着反应体系中葡萄糖和甘氨酸物质的量比的逐渐减小,反应体系生成Fru-Gly 化合物的浓度先小幅度减少,然后小幅度增加,最后急剧减少。当葡萄糖和甘氨酸物质的量比为3∶1 时,反应体系生成Fru-Gly 化合物的质量浓度达到最大值56.82 μg/mL。当物质的量比为2∶1 时,Fru-Gly 化合物的含量急剧减小到27.49 μg/mL。结合图4b 可知,物质的量比为2∶1 的反应体系褐变程度最大,Maillard反应也最为彻底,说明Fru-Gly 化合物进一步参与Maillard 反应的后续反应,导致测得的Fru-Gly化合物浓度很低,两者的结果一致。当物质的量比大于2∶1 时,反应体系生成的Fru-Gly 化合物的浓度均较高且相差较小。当物质的量比小于2∶1时,其浓度急剧减小,说明合成Amadori 化合物的反应体系中过量的葡萄糖可能有利于Amadori 化合物生成。
由图4b 可知,葡萄糖和甘氨酸的物质的量比为2∶1 时,反应体系的褐变程度最大。当物质的量比大于2∶1 时,褐变程度无明显差别,Maillard 反应程度基本保持一致;当物质的量比为1∶1 时,反应体系的褐变程度开始急剧减小;当物质的量比为1∶2 时的褐变程度又小幅度增加。这说明当葡萄糖和甘氨酸的物质的量为2∶1 时,Maillard 反应最为彻底,反应程度最大。反应体系中葡萄糖的量过少时,严重影响Maillard 反应的进行。
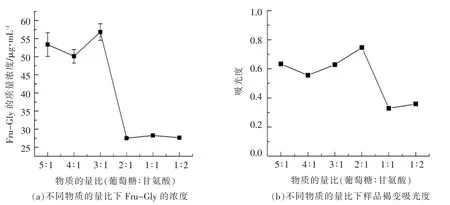
图4 物质的量比对反应体系生成Fru-Gly 化合物浓度及褐变程度的影响Fig.4 Effect of molar ratio on the concentration of Fru-Gly compounds generated and browning degree
2.3 响应曲面试验结果及方差分析
2.3.1 Box-Behnken 设计试验 以反应时间(A)、反应温度(B)和物质的量比(C)3 个因素为自变量,测得的Fru-Gly 化合物浓度为响应指标,根据Box-Behnken 实验原理进行响应曲面试验,结果见表2。
2.3.2 模型建立与方差分析 利用Design-Expert 8.0.6 软件对表2数据进行二次多项拟合回归分析,得到响应值与因素编码值之间的二次多项回归方程为:
Y=60.69-3.75A-1.43B+3.50C+3.86AB-8.15AC+0.90BC-16.24A2-4.55B2-10.02C2
对响应曲面试验结果(表2)进行方差(ANOVA)分析,结果见表3。由表3可知,模型的Prob>F=0.0267(P<0.05),表明该模型具有显著性,模型的建立有意义。此外,该模型的F 值为4.71,表明模型仅有4.71%的可能性是由干扰造成的。模型的失拟项值为0.0652,不显著,说明模型较合适,试验的相对误差较小,可用此模型对Fru-Gly 化合物的浓度进行分析和预测。反应时间的二次项(A2)对Fru-Gly 化合物的浓度影响极显著(P<0.01),而葡萄糖与甘氨酸的物质的量比(C2)对Fru-Gly 化合物的浓度影响显著(P<0.05)。
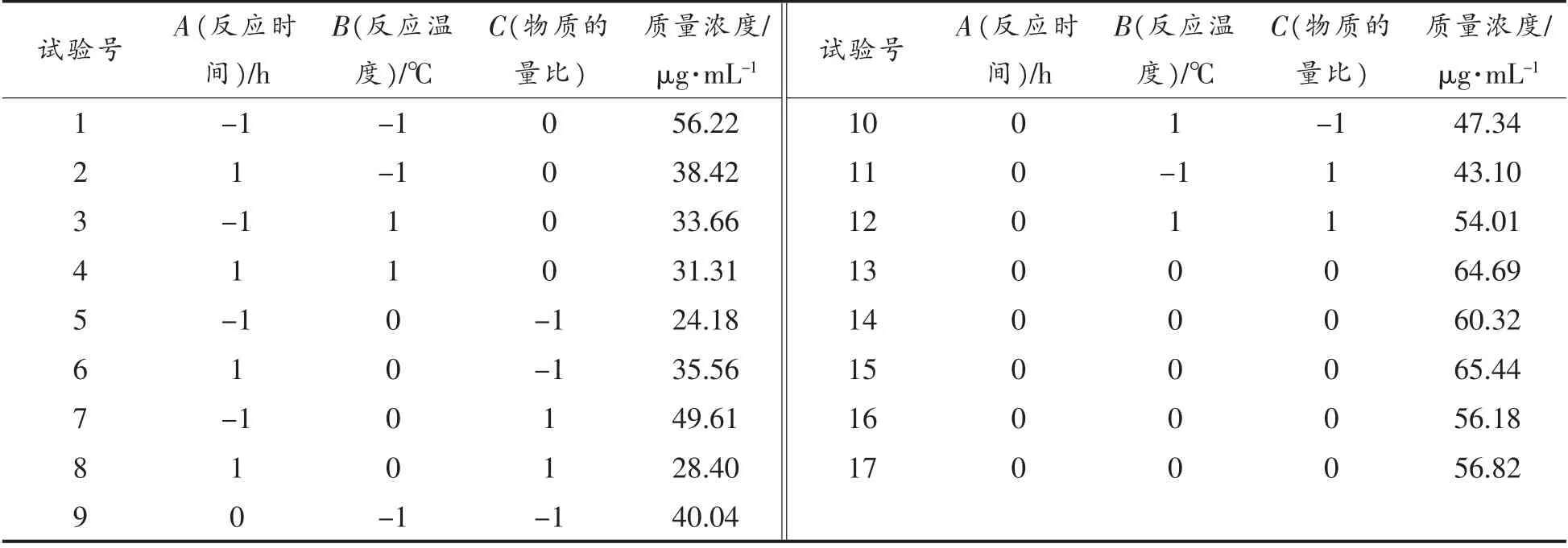
表2 响应面试验设计及结果Table2 Design and results of response surface experiment

表3 响应曲面试验结果与方差分析结果Table3 Response surface test results and variance analysis results
2.3.3 响应面图及等高线图分析 响应面图可直观反映各参数与最佳参数之间的相互作用,等高线的形状反映不同因素间相互影响的强弱。等高线呈椭圆形表示两个因素间的相互作用明显,等高线呈圆形则相反。

图5 各因素交互作用的响应面及等高线图Fig.5 Response surface and contour plots of various factors
由图5a 可知,响应曲面的坡度较陡峭,说明Fru-Gly 化合物浓度对反应时间和温度较为敏感。在反应温度不变的条件下,反应体系生成Fru-Gly化合物的浓度随着反应时间的增加呈先升高后降低的趋势,且变化较大。在反应时间不变的条件下,随着反应温度的升高,Fru-Gly 化合物浓度呈先上升后下降的趋势,变化较小。从等高线可以看出,反应时间与温度交互作用显著。
由图5b 可知,响应曲面的坡度比较陡峭,说明Fru-Gly 化合物的浓度对反应时间和物质的量比较为敏感。在物质的量比不变的条件下,反应体系生成Fru-Gly 化合物的浓度随着反应时间的增加呈现出先升高后降低的趋势。在反应时间不变的条件下,随着物质的量比的升高Fru-Gly 化合物浓度呈先迅速上升后缓慢下降的趋势。从等高线可以看出,反应时间与物质的量比交互作用显著。
由图5c 可知,响应曲面的坡度比较陡峭,说明Fru-Gly 化合物浓度对反应温度和物质的量比较为敏感。在反应温度不变的条件下,反应体系生成Fru-Gly 化合物的浓度随着物质的量比的增大呈现出先升高后降低的趋势,且变化较大。在物质的量比不变的条件下,随着反应温度的升高,Fru-Gly 化合物的浓度呈先上升后下降的趋势,变化较小。从等高线可以看出,反应温度与物质的量比交互作用显著。
通过响应曲面试验分析,生成Fru-Gly 化合物浓度的最佳反应条件为反应时间0.9 h,反应温度79 ℃,葡萄糖和甘氨酸物质的量比3.25∶1。依此条件做验证试验,Fru-Gly 化合物质量浓度为58.80 μg/mL,与模型预测值的误差小于5%。由此可见,该模型具有实用价值。
2.4 反应体系生成Fru-Gly 化合物的浓度与其抗氧化能力的相关性分析
由图6可知,反应体系纯化样液Fru-Gly 化合物的浓度与其DPPH 自由基清除能力、ABTS 自由基清除能力及还原能力具有相同的变化趋势,即随着反应体系Fru-Gly 化合物浓度的增大,3 种抗氧化能力均增强,且DPPH 自由基清除能力始终大于ABTS 自由基清除能力。
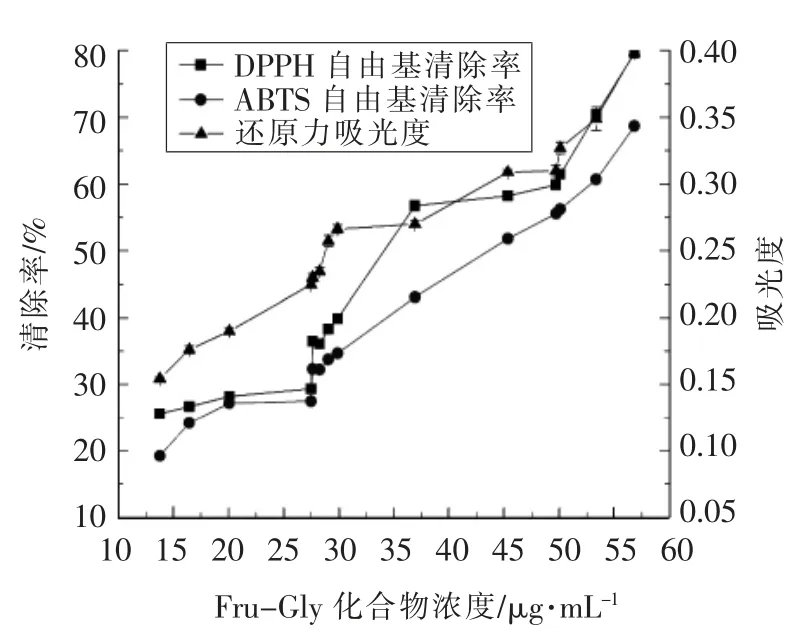
图6 反应体系Fru-Gly 化合物的浓度与其抗氧化能力的关系Fig.6 The relationship between the concentration of Fru-Gly and its antioxidant capacity in the reaction system
表4列出采用Pearson’s 相关系数分析反应体系生成Fru-Gly 化合物的浓度与其抗氧化能力的相关性,结果表明,Fru-Gly 化合物的浓度与DPPH 自由基清除能力、ABTS 自由基清除能力以及还原能力互为极显著正相关,且相关性系数均大于0.96。由相关性分析结果可推测,反应体系Fru-Gly 化合物的浓度越高,其3 种抗氧化能力越强。
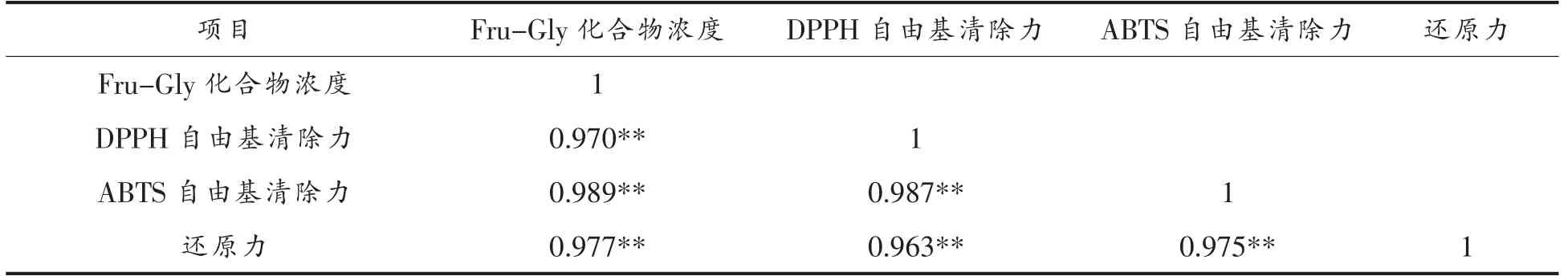
表4 反应体系Fru-Gly 化合物浓度与其抗氧化能力相关性分析Table4 Correlation analysis between the concentration of Fru-Gly and its antioxidant capacity in the reaction system
3 结论
优化合成Fru-Gly 化合物的条件,研究其抗氧化活性,以DPPH 自由基清除率、ABTS 自由基清除率及还原力评价样品的抗氧化性能。结果表明,Fru-Gly 化合物具有一定的抗氧化能力,反应体系Fru-Gly 化合物的浓度越高,其3 种抗氧化能力越强,且DPPH 自由基清除率始终大于ABTS自由基清除率。生成Fru-Gly 化合物浓度的最佳反应条件为反应时间0.9 h,反应温度79 ℃,葡萄糖和甘氨酸物质的量比3.25∶1。
相关性分析结果表明,Fru-Gly 化合物浓度与DPPH、ABTS、还原力法测定的抗氧化能力呈极显著相关性(P<0.01)。合成Amadori 化合物时,可通过分光光度法对反应体系进行DPPH 自由基清除率、ABTS 自由基清除率及还原力测定,根据抗氧化性高低监测Amadori 化合物生成程度,从而避免Amadori 化合物标准品难以获取的不足及用UPLC-TOF MS-MS 设备检测定量Amadori 化合物的高昂费用,既简便易行,又节省成本。
