生物表面活性剂鼠李糖脂性质的研究
2022-02-21罗志刚杨欢齐亮
罗志刚 杨欢 齐亮
(华南理工大学 食品与工程学院,广东 广州 510640)
表面活性剂是一类重要的两亲性化合物,具有乳化、起泡等功能性质。已经广泛地应用于日化、食品加工、农业、环境修复等领域[1]。表面活性剂通常采用化学方法制备,且大部分合成表面活性剂属于石油化工产品,存在生物降解性差、易污染环境及消耗不可再生资源等问题[2]。随着各工业领域对表面活性剂需求的不断增加及绿色环保可持续发展理念的增强,绿色表面活性剂受到了越来越多的关注,其中最具代表性的是生物表面活性剂。生物表面活性剂主要是指由微生物产生的具有表面活性的次生代谢物,常见的生物表面活性剂包括槐糖脂、鼠李糖脂、海藻糖、脂肽[3]等。生物表面活性剂具有良好的生物相容性、生物降解性高、毒性低、作用特异性强、抗菌活性高以及在极端条件下具有良好的表面活性等优点[4]。
鼠李糖脂是目前研究最广泛的生物表面活性剂,它主要由铜绿假单胞菌经发酵而产生[5],属于糖脂类表面活性剂。鼠李糖脂的亲水基团一般由1-2个鼠李糖分子组成,疏水基团由1-2个不同碳链长度的饱和或不饱和脂肪酸分子组成[6]。鼠李糖脂具有多种功能特性,作为乳化剂、抗菌剂、发泡剂和润湿剂[7- 9]被广泛地应用于生物修复、医疗、农业、食品、日化等[10- 15]工业领域。
以铜绿假单胞菌1.104 52发酵生产的鼠李糖脂为研究对象,通过超高压液相色谱-高分辨质谱联用仪分析其组成成分,并测定其临界胶束浓度(CMC)、乳化性、起泡性、泡沫稳定性及抗菌活性等功能性质,从而探究鼠李糖脂用作表面活性剂的潜力,以期为鼠李糖脂在食品、日化、农业、环境等领域的应用提供理论依据和实验数据。
1 材料与方法
1.1 供试材料
铜绿假单胞菌1.104 52(Pseudomonasaeruginosa),源自中国普通微生物保藏中心;大肠杆菌ATCC25922(Escherichiacoli)、金黄色葡萄球菌ATCC6538(Staphylococcusaureus)、白色念珠菌ATCC10231(Candidaalbicans),购自上海鲁微科技有限公司。
十二烷基硫酸钠(SDS)、氯化钠、葡萄糖、硝酸钠、磷酸二氢钠、磷酸氢二钾等,国药集团化学试剂有限公司生产;牛肉膏、蛋白胨,环凯生物科技有限公司生产;卡松,北京桑普生物化学技术有限公司生产;玉米油,金龙鱼有限公司生产。
LB液体培养基和LB固体培养基用于培养细菌;酵母膏胨葡萄糖(YPD)液体培养基及YPD固体培养基用于培养真菌。发酵培养基:玉米油60 g/L、硝酸钠6.8 g/L、硫酸镁0.4 g/L、磷酸二氢钠3.2 g/L、磷酸氢二钾4.8 g/L、无水氯化钙0.02 g/L、硫酸亚铁0.024 g/L。
1.2 仪器设备
高压灭菌锅,上海三申医疗器械有限公司生产;超净工作台,苏州智净净化设备有限公司生产;震荡培养箱,上海知楚仪器有限公司生产;表面张力仪,德国 Dataphysics 公司生产;超高压液相色谱-高分辨质谱联用仪,德国Bruker公司生产;泡沫仪R- 2000,德国SITA公司生产。
1.3 实验方法
1.3.1 鼠李糖脂的发酵生产与提取
将斜面保存的铜绿假单胞菌接种于LB培养基中,并置于37 ℃、180 r/min条件下培养18~24 h。然后,在发酵培养基中加入5%培养好的种子液,将发酵培养基置于37 ℃、180 r/min培养72~96 h,最终得到鼠李糖脂发酵液。
鼠李糖脂的提取参考WITEK等[16]及朱零青[17]的方法并进行适当修改。将发酵液离心(8 000 r/min,10 min)以去除菌体,然后收集上清液,并用 6 mol/L HCl将除菌发酵液pH值调节至2.0,于4 ℃ 条件下静置过夜,离心(8 000 r/min,10 min)收集沉淀。沉淀用0.05 mol/L NaHCO3溶液悬浮沉淀3次,并离心(8 000 r/min,10 min)收集上清液。将上清液的pH值调节至2.0,静置沉淀。最后用乙酸乙酯萃取所得沉淀,收集乙酸乙酯有机相,将有机相与pH值为8.0的磷酸盐缓冲溶液混合,有机相中的鼠李糖脂富集于水相中,收集下层水相即得到鼠李糖脂溶液。
1.3.2 鼠李糖脂的组成成分测定
鼠李糖脂的组成成分测定参考Zhao等[18]的方法并进行适当修改,采用液相色谱-质谱(LC-MS)对鼠李糖脂的组分进行分离鉴定。LC分析条件为:采用250 mm×4.6 mm×5 μm C18反相柱进行色谱分离。经0.22 μm滤膜过滤后,取20 μL样品注入液相色谱仪系统,用4 mmol/L的醋酸铵水溶液和乙腈为流动相进行梯度洗脱,开始用40%乙腈洗脱4 min,20 min后乙腈浓度升至90%,液相色谱流速为0.4 mL/min,洗脱液直接用质谱仪检测,采用负离子模式,在100~1 000的质荷比(m/z)范围内记录质谱。
1.3.3 鼠李糖脂临界胶束浓度的测定
临界胶束浓度(CMC)由表面张力法确定[19]。制备不同浓度(c,0~1 000 mg/L)的鼠李糖脂溶液,利用表面张力仪测定其表面张力(γ),并绘制γ-lgc曲线,曲线的转折点即为鼠李糖脂临界胶束浓度(CMC)。以十二烷基硫酸钠(SDS)作为对照。
1.3.4 鼠李糖脂乳化能力的测定
鼠李糖脂的乳化能力由乳化指数(E24)表示[20]。制备1 g/L的鼠李糖脂溶液,测定其乳化指数。将3 mL的疏水性有机物(大豆油、液体石蜡和正己烷)与3 mL的鼠李糖脂溶液混合,将混合液于8 000 r/min条件下均质2 min,然后静置24 h并测量乳状液层高度,根据式(1)计算乳化指数(E24)。以十二烷基苯磺酸钠(SDS)、十六烷基三甲基氯化铵(CTAC)和吐温80作为对照。
(1)
其中,E24表示乳化指数,H为混和物总高度,h为乳化层高度。
1.3.5 鼠李糖脂泡沫性能的测定
泡沫性能可用起泡比和泡沫稳定性表示,参考王健等[21]的方法并修改,用泡沫分析仪测定鼠李糖脂在纯水和硬水中的起泡性及泡沫稳定性,在泡沫分析仪的样品玻璃罐中加入250 mL质量浓度为2 g/L的鼠李糖脂溶液(分别用纯水和硬水配制),然后在1 000 r/min条件下搅拌5 min,每隔15 s记录泡沫体积,搅拌停止后每隔30 s测定其泡沫体积。并用式(2)和(3)计算鼠李糖脂在纯水和硬水中的起泡比和泡沫稳定性[22]。以十二烷基苯磺酸钠(SDS)作为对照。
(2)
(3)
其中,F为起泡比,S为泡沫稳定性,V为试样体积(250 mL),V0为搅拌停止时的泡沫体积,V5 min为搅拌停止5 min后的泡沫体积。
1.3.6 鼠李糖脂稳定性的测定
鼠李糖脂的稳定性可以利用表面张力[23]和乳化能力[24]来评价。制备1 g/L的鼠李糖脂溶液,然后将其在不同的pH值(2、3、4、6、8、10、12、13、14)、不同的温度(-20、4、25、40、60、80、100 ℃)及不同的NaCl质量浓度(0.0、2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0、22.5、25.0、27.5、30.0 g/L)的条件下处理4 h后,测定其表面张力和乳化指数(用于测定乳化指数的疏水有机相为液体石蜡),研究温度稳定性及NaCl稳定性时采用自然pH(5.8),以SDS作为对照。
1.3.7 鼠李糖脂抑菌活性的测定
(1)抑菌圈直径的测定
采用琼脂打孔法测定鼠李糖脂对试验菌株(金黄色葡萄球菌、大肠杆菌、白色念珠菌)的抑菌圈直径,具体操作方法参考Bharali等[25]的方法并进行适当修改,并以化学防腐剂卡松及天然防腐剂壳聚糖作为阳性对照,无菌水作为阴性对照,以对比相同浓度下鼠李糖脂的抗菌能力。此外,在试验琼脂平板上打孔,向圆孔中分别注入20 μL不同浓度(3.125、6.250、12.500、25.000、50.000 mg/mL)的鼠李糖脂溶液,以确定不同浓度鼠李糖脂溶液的抗菌能力。将平板分别在37 ℃(细菌)或28 ℃(真菌)条件下培养24 h,并使用透明公制尺测量观察到的抑制圈直径(mm)。
(2)最低抑菌浓度的测定
采用微量肉汤稀释法[26]测定鼠李糖脂的最低抑菌浓度(MIC),并以化学防腐剂卡松及天然防腐剂壳聚糖作阳性对照,培养基作阴性对照。将96孔板置于37 ℃(细菌)或28 ℃(真菌)下培养24 h并加以观察,以不出现浑浊的最后一孔对应的浓度即为相应抑菌剂对供试菌的MIC值[27]。
1.4 数据分析
所有实验均进行3次,实验结果以平均值±误差表示,利用SPSS 23.0软件进行数据统计与分析,Origin 8.5软件作图。
2 结果分析
2.1 鼠李糖脂组成成分分析
鼠李糖脂通常包括双鼠李糖脂和单鼠李糖脂,鼠李糖脂的组成成分主要取决于发酵所用菌株及培养基条件,当菌种及培养条件发生改变时,所得到的鼠李糖脂的组分及其相对含量也会随之发生变化,从而导致不同组分构成的鼠李糖脂在性质上存在差异。据报道[28],鼠李糖脂混合物一般由2-28种同系物组成。通过LC-MS对鼠李糖脂进行组分测定及分析,其组成成分及相对含量见表1。
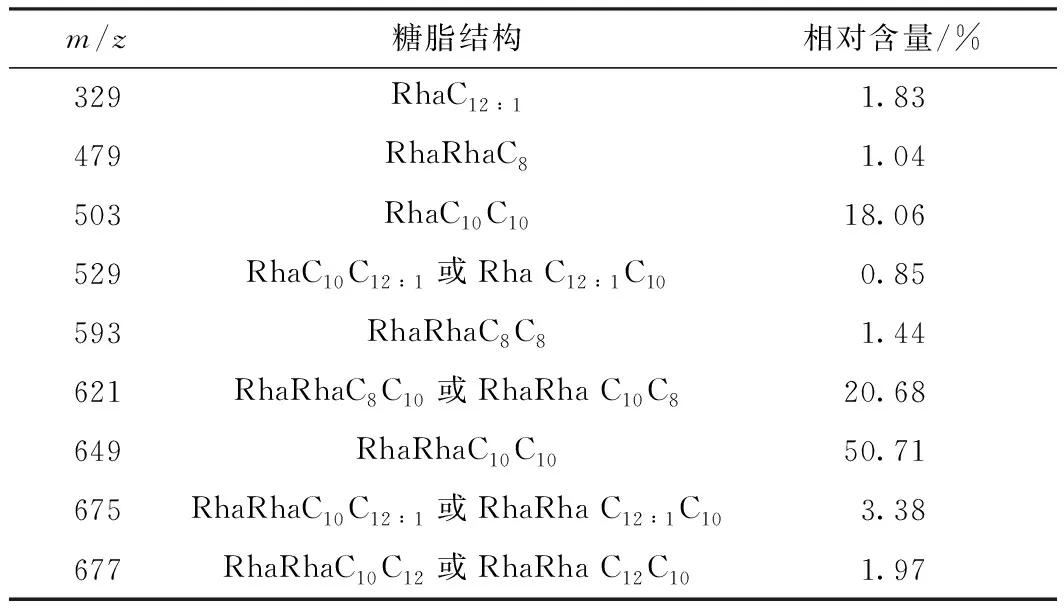
表1 鼠李糖脂同系物的结构和相对含量Table 1 Structure and relative abundance of rhamnolipids homo-logues
表1中RhaCn和RhaCnCn为单鼠李糖脂,Rha-RhaCn和RhaRhaCnCn为双鼠李糖脂(其中n代表8、10和12)。由表1可知,本研究利用铜绿假单胞菌1.104 52发酵生产的鼠李糖脂产品主要由9种同系物组成,并且主要成分为双鼠李糖脂,其相对含量为79.22%,双鼠李糖脂中占比最大的是RhaRhaC10C10,其相对含量为50.71%。已有研究表明[19],相较于单鼠李糖脂,双鼠李糖脂具有更好的表面活性、乳化性及稳定性。而该鼠李糖脂产品中含有将近80%的双鼠李糖脂,因此,推测该鼠李糖脂会具有较好的理化性质。
2.2 临界胶束浓度的测定
CMC是指表面活性剂在溶剂中形成胶束的最小浓度,它是评估表面活性剂界面活性的重要参数,CMC越低,表明表面活性剂形成胶束所需的浓度就越低,其表面活性就越好,因此起到乳化和起泡等理化性质所需的最小浓度越低[29]。由图1(a)可知,当鼠李糖脂溶液质量浓度小于80 mg/L时,表面张力随着鼠李糖脂溶液浓度的增加而降低,而当鼠李糖脂溶液的质量浓度大于80 mg/L时,表面张力趋于稳定,不再随着鼠李糖脂溶液浓度的升高而变化,说明该鼠李糖脂的CMC为80 mg/L。而从图1(b)中可以看出,化学表面活性剂的SDS的CMC为600 mg/L。这表明本研究所制备的鼠李糖脂的表面活性优于SDS。

(a)鼠李糖脂

(b)SDS图1 鼠李糖脂及SDS的临界胶束浓度Fig.1 Critical micelle concentration of rhamnolipids and SDS
2.3 鼠李糖脂的乳化能力
用液体石蜡、大豆油和正己烷3种疏水性有机物评价鼠李糖脂、SDS、吐温80和CTAC 4种表面活性剂的乳化活性。从图2中可以看出,鼠李糖脂对液体石蜡的乳化指数达到65.69%,优于化学表面活性剂SDS、CTAC及乳化剂吐温80。液体石蜡作为护肤品中常见的保湿剂、柔润剂,鼠李糖脂对液体石蜡良好的乳化性表明其作为乳化剂在日化行业中具有很好的应用前景。鼠李糖脂对大豆油的乳化指数为63.75%,与化学表面活性剂SDS相近且优于乳化剂吐温80及化学表面活性剂CTAC,表明其对食用油具有良好的乳化性。因此,鼠李糖脂作为清洁剂和乳化剂在食品工业中具有潜在的应用前景。此外,鼠李糖脂对正己烷的乳化指数为52.54%,说明鼠李糖脂也能够用于乳化有机溶剂,可以应用于生物修复领域。
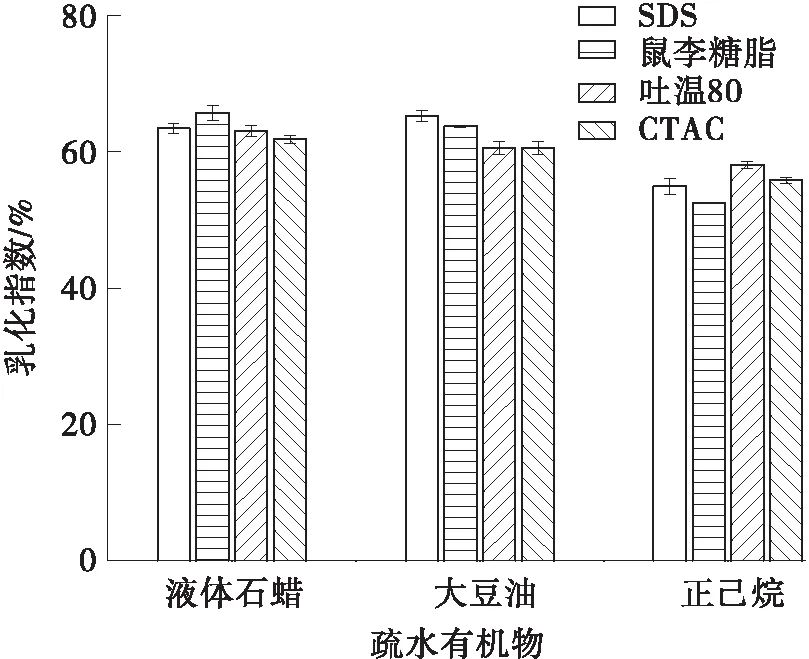
图2 鼠李糖脂对不同疏水有机物的乳化活性Fig.2 Emulsification of rhamnolipids on different hydrophobic organic compounds
2.4 鼠李糖脂的泡沫性能
泡沫体积及起泡比可用于表征鼠李糖脂的起泡性,起泡比越大,鼠李糖脂的起泡性就越好[30]。从表2中可知,鼠李糖脂在纯水和硬水中的起泡比分别为(287.86±0.83)%和(280.40±0.40)%。与相同浓度下的化学表面活性剂SDS相比,二者在纯水中具有相近的起泡比,而在硬水中鼠李糖脂具有更高的起泡比。这表明该鼠李糖脂在硬水中具有更好的起泡性。静置5 min后,鼠李糖脂溶液在纯水中的泡沫体积由之前的718 mL变为714 mL,其泡沫稳定性为(99.44±0.14)%,与SDS相近,鼠李糖脂在硬水中的泡沫体积由之前的701 mL变为697 mL,其泡沫稳定性为(99.47±0.08)%,而SDS在硬水中的泡沫稳定性为(96.83±0.34)%,说明鼠李糖脂在硬水中表现出更好的泡沫稳定性。

表2 鼠李糖脂的起泡比与稳泡性Table 2 Foaming ratio and foam stability of rhamnolipids
2.5 鼠李糖脂的稳定性
由图3(a)可知,在鼠李糖脂溶液的pH值为2~6时,其表面张力基本不变,而在pH 6~12的范围内,鼠李糖脂的表面张力整体略微上升,但鼠李糖脂溶液的表面张力在整个pH范围内始终在33 mN/m 以下,说明该鼠李糖脂样品的表面活性受pH影响较小。此外,鼠李糖脂溶液的乳化指数在pH 2~6的范围内随着pH增大而逐渐升高,而在pH 6~13的范围内乳化指数基本不变。当pH为2时,鼠李糖脂溶液的乳化指数接近于0,这可能与鼠李糖脂在pH 2时溶解度最低有关。

(a)pH稳定性

(b)氯化钠稳定性
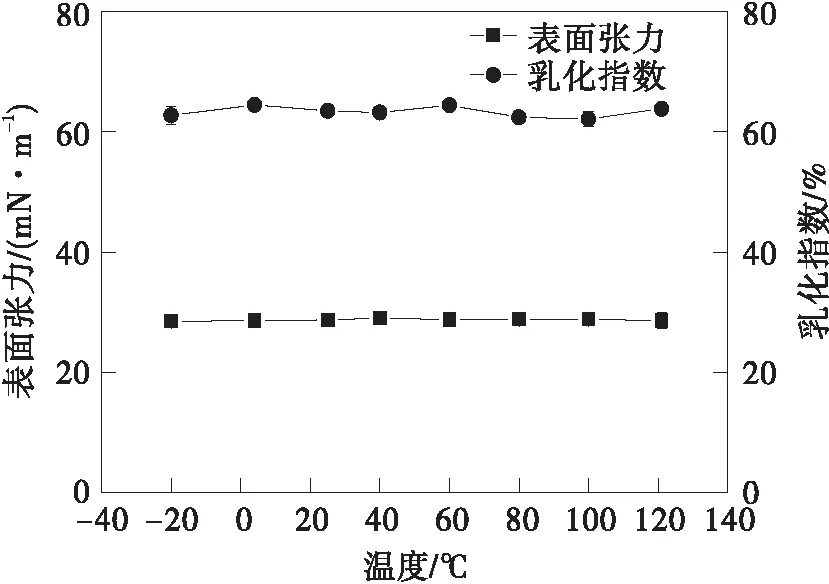
(c)温度稳定性图3 鼠李糖脂的稳定性Fig.3 Stability of rhamnolipids
由图3(b)可知,在氯化钠质量浓度为0~30 g/L的测定范围内,鼠李糖脂溶液的表面张力未发生明显变化,基本维持在28 mN/m左右,说明在氯化钠质量浓度低于30 g/L时,该鼠李糖脂产品的表面活性不受影响。此外,在氯化钠质量浓度为 0~25 g/L的范围内,鼠李糖脂的乳化指数相对较稳定,说明在氯化钠质量浓度低于25 g/L时,鼠李糖脂具有很好的稳定性。而当氯化钠质量浓度超过25 g/L时,鼠李糖脂溶液的乳化指数出现急速下降,此时鼠李糖脂溶液的乳化活性在氯化钠体系中受到了抑制。
由图3(c)可知,该鼠李糖脂产品的表面活性及乳化活性在-20~121 ℃的温度范围内基本保持不变,说明该鼠李糖脂产品具有耐受极端温度的能力。鼠李糖脂在极端条件下保持较好的稳定性可能与其复杂庞大的分子结构有关[31]。鼠李糖脂对不同温度、盐度、pH的耐受性使其在极端复杂的环境中具有很好的应用潜力,如修复被石油污染的土壤。
2.6 鼠李糖脂的抑菌活性
通过测量抑菌圈的直径以及测定最低抑菌浓度(MIC)来表征本研究制备的鼠李糖脂对革兰氏阳性菌(金黄色葡萄球菌)、革兰氏阴性菌(大肠杆菌)和真菌(白色念珠菌)的抑菌效果。
2.6.1 抑菌圈直径
10 mg/mL的鼠李糖脂溶液对不同菌种的抑菌圈直径见表3。由表3可知,鼠李糖脂对3种供试菌均具有明显的抑制作用,对3种供试菌的抑菌作用虽然弱于化学防腐剂卡松,但是优于天然防腐剂壳聚糖。据吴海霞等[32]的研究,当抑菌圈直径在15~20 mm时,为供试菌对抑菌剂高度敏感,当抑菌圈直径大于20 mm时,为供试菌对抑菌剂极敏感。此外,从图4中可以看出,各供试菌的抑菌圈直径均随着鼠李糖脂溶液浓度的升高而增大,这说明鼠李糖脂浓度越高,其对菌株的药效和抗菌能力就越强。因此鼠李糖脂可以作为抗菌剂应用于日化、食品等领域。

表3 鼠李糖脂对供试菌的抑菌圈直径Table 3 Diameter of inhibition zone of rhamnolipids on tested bacteria

图4 不同鼠李糖脂浓度对供试菌的抑菌圈直径Fig.4 Diameter of inhibition zone of rhamnolipids with different concentrations on the tested bacteria
2.6.2 鼠李糖脂的最低抑菌浓度
MIC是指能够抑制微生物生长所需的最低抑菌剂浓度,MIC越小,说明其对供试菌的抑菌活性越强[33]。由表4可知,鼠李糖脂对白色念珠菌、金黄色葡萄球菌、大肠杆菌的MIC与化学防腐剂卡松相比相差较小,而壳聚糖对白色念珠菌、金黄色葡萄球菌、大肠杆菌的MIC最大,再次说明鼠李糖脂对供试菌的抗菌活性优于天然抗菌剂壳聚糖。

表4 鼠李糖脂对供试菌的最低抑菌浓度Table 4 Minimal inhibitory concentration of rhamnolipids on tested bacteria
鼠李糖脂对革兰氏阳性菌、革兰氏阴性菌和真菌所表现出来较高的抗菌活性与其结构特性有关。这可能是由于具有疏水性和亲水性基团的鼠李糖脂分子可以将其脂肪酸组分插入细胞膜,从而引起细胞超微结构的显著改变,鼠李糖脂较短的酰基尾部插入细胞膜也可能导致细胞骨架元素和质膜之间的断裂,使质膜脱离细胞质成分,导致细胞损伤[26,34],从而起到了抑菌的作用。
3 结论
本研究对铜绿假单胞菌1.104 52发酵生产的鼠李糖脂的组成成分及性质进行了较为详细的分析。研究结果表明所生产的鼠李糖脂由9种同系物组成,以双鼠李糖脂为主要成分,其临界胶束浓度为80 mg/L,具有较好的表面活性。鼠李糖脂具有与化学表面活性剂SDS相近的乳化能力,对大豆油、液体石蜡、正己烷的乳化指数分别为63.75%、65.69%、52.54%。鼠李糖脂在纯水和硬水中均表现出良好的起泡性和泡沫稳定性。此外,鼠李糖脂对革兰氏阳性菌、革兰氏阴性菌和真菌均具有较高的抑菌活性。
