长链非编码RNA AC244502.3⁃201对甲状腺乳头状癌细胞增殖和迁移的影响
2020-05-22向涛梁巍巍柯文徐梓筠修玲玲卫国红
向涛 梁巍巍 柯文 徐梓筠 修玲玲 卫国红
中山大学附属第一医院内分泌科(广州510080)
甲状腺癌是内分泌系统中最常见的恶性肿瘤,近年来其发病率在全球范围内持续升高,是全球增速最快的恶性肿瘤[1]。甲状腺癌按组织形态学可分为起源于滤泡上皮细胞的甲状腺乳头状癌(papillary thyroid cancer,PTC)、滤泡状甲状腺癌(follicular thyroid cancer,FTC)和未分化甲状腺癌(anaplastic thyroid cancer,ATC)以及起源于滤泡旁C 细胞的甲状腺髓样癌(medullary thyroid cancer,MTC)[2]。PTC 在甲状腺癌中约占90%[3],尽管大多数PTC 患者预后很好,但它具有较强的侵袭和定植能力,容易抵抗失巢凋亡发生淋巴结和远处器官转移,甚至会去分化演变为更恶性的癌症[4]。因此研究PTC 恶性进展过程中的分子机制,寻找调控PTC 发生发展的关键因素和作用分子具有重要意义[5]。LncRNAs 是一类转录本长度超过200 nt 的不编码蛋白的RNA 分子,它们可以通过对转录和转录后的调控、基因组印迹和染色质修饰等多种机制在肿瘤发生发展过程中发挥广泛的调控作用[7],如LncRNA RP11⁃356I2.2 在胃癌中表达降低能抑制胃癌细胞增殖、迁移和成瘤[8]。在甲状腺癌中,目前也发现多种异常表达的lncRNAs,其中部分lncRNAs 的功能得到了初步研究,例如一些在甲状腺癌中表达下降的lncRNAs(如NAMA 等)具有抑癌作用[8],而表达增加的lncRNAs(如h19 等)则具有致癌作用[10],关于lncRNAs 调控甲状腺癌功能的机制也有初步的研究,如LINC00377 在甲状腺癌组织中低表达,在SW579 细胞中证实过表达LINC00377 能够通过下调miR⁃29a⁃3p 表达促进ADAMTS9 基因的表达进而抑制细胞增殖和迁移[11]。AC244502.3⁃201 是一种长为844 nt 的lncRNA 分子,它位于14 号染色体22,415,362⁃22,418,657,由3 个外显子组成。目前关于AC244502.3⁃201 在肿瘤发生发展中的作用还未被报道。
本研究旨在探讨AC244502.3⁃201 在PTC 中的表达水平,并分析AC244502.3⁃201 对PTC 细胞增殖及侵袭迁移的影响以及可能的分子机制,为理解PTC 发生发展的分子机制及新的治疗靶点提供依据。
1 材料与方法
1.1 临床标本收集收集2019年在中山大学附属第一医院进行外科手术治疗的10 例PTC 患者的癌组织及癌旁组织。取得的标本用无菌PBS(phosphate buffer saline)洗涤后快速放入液氮储存待测。本研究通过中山大学附属第一医院伦理委员会审核批准。
1.2 细胞以及主要试剂Nthy⁃ori3⁃1、BCPAP 、TPC1、KTC1 和K1 细胞购自于北纳生物(BNCC)细胞库。DMEM(Dulbecco's Modified Eagle Medium)培养基和胎牛血清(Fetal Bovine Serum,FBS)购自美国Gibco 公司。BCA 蛋白定量试剂盒、核浆分离试剂盒、TRIzol 试剂及Lipofectamine 3000 购自美国Invitrogen 公司。Transwell 小室购自美国Corning 公司。RIPA 裂解液、CCK⁃8 试剂盒购自美国Sigma 公司。逆转录相关试剂购买于日本TaKaRa 公司。一抗和二抗均购自于美国CST 公司。qRT⁃PCR 引物于金唯智公司合成。EdU 试剂盒购自锐博公司,Smart Silencer 也由锐博公司设计合成。
1.3 RNA 提取和实qRT⁃PCR 检测用TRIzol 试剂提取组织和细胞中的总RNA。采用MMLV 逆转录酶和随机引物逆转获得互补脱氧核糖核酸(cDNA)。qRT⁃PCR 实验采用SYBR Green 法,用CFX96 实时荧光定量PCR 仪运行标准程序。β⁃actin 用于标准内参,用2⁃ΔΔCt计算最终基因表达差异。相关引物序列如下:AC244502.3⁃201 上游引物:5'⁃GACAGGGAAGAAGATGAAT⁃3',下游引物:5'⁃CGTCTCCTTGTTGATGTA⁃3';β⁃actin 上游引物:5'⁃AGCCATGTACGTAGCCATCCA⁃3',下游引物:5'⁃TCTCCGGAGTCCATCACAATG⁃3';U1 上游 引物:5'⁃TCCCAGGGCGAGGCTTATCCATT⁃3',下游引物:5'⁃GAACGCAGTCCCCCACTACCACAAAT⁃3';CCND1上游引物:5'⁃GCTGCGAAGTGGAAACCATC⁃3',下游引物:5'⁃CCTCCTTCTGCACACATTTGAA⁃3';MYC 上游引物:5'⁃GGCTCCTGGCAAAAGGTCA⁃3',下游引物:5'⁃CTGCGTAGTTGTGCTGATGT⁃3';MMP9 上游引物:5'⁃TGTACCGCTATGGTTACAC⁃TCG⁃3',下游引物:5'⁃GGCAGGGACAGTTGCTTCT⁃3';VEGF 上游引物:5'⁃ATGGACCAGTGAAGCGAT⁃CAT⁃3',下游引物:5'⁃GTTCCTCCAAACTAGAAGC⁃AGC⁃3'。
1.4 核浆分离试验核浆分离试剂盒用于分离细胞核和细胞浆的RNA 组分。qRT⁃PCR 实验用于探测AC244502.3⁃201 的亚细胞定位。β⁃actin 用于细胞浆的参照标准,U1 用于细胞核的参照标准,引物序列见1.3。
1.5 细胞细胞培养和转染细胞用含有10%FBS的DMEM 培养基,放置于在37 ℃的5%CO2恒温孵箱中培养。为了敲低AC244502.3⁃201在细胞内的表达,由锐博公司设计合成特异性敲低AC244502.3⁃201 的Smart Silencer。Smart Silencer 由3 条siRNAs和3 条ASOs 构 成。3 条siRNAs 的靶 序 列为:5'⁃GCAAATCTTCACTGTGAAA⁃3';5'⁃TCACTCCTAAT⁃GGAATCAA⁃3';5'⁃GCGAGCAGAACAAATCAAA⁃3';3 条ASOs 的靶序列为:5'⁃CCCTATCCATGGT⁃GACTCCC⁃3';5'⁃CTTGCTGAGGTCCCTTCCAC⁃3';5'⁃TGATTTGTCTGGTGCACCCA⁃3'。其对照Nega⁃tive control(NC)也由锐博公司提供,是由不包含人、鼠和兔的同源序列的3 条siRNAs 和3 条ASOs 构成。Smart Silencer 和NC 的转染均采用Lipofectamine 3000,按照试剂盒的标准操作进行转染。
1.6 细胞增殖检测将细胞接种于96孔板,CCK⁃8试剂孵育30 min 后,采用分光光度计测量450 nm处的吸光度,每24 h 检测1 次细胞增殖水平。细胞接种于24 孔板,在EdU 试剂盒说明书的指导下对细胞进行孵育标记,通过计数荧光显微镜下能被EdU 标记的阳性细胞数目来检测细胞增殖效率。细胞接种于6 孔板,10% FBS 培养7 d,4%多聚甲醛固定后采用结晶紫染色,漂洗后于显微镜下拍照并进行计数。
1.7 细胞侵袭迁移能力检测运用8 μm 孔径的Transwell 小室进行细胞侵袭能力检测。提前在小室的上室中铺50 μg 基质胶,加入含4×104个细胞的200 μL 无血清DMEM,下室加入500 μL 含有20%FBS 的DMEM,培养48 h 后,用4%多聚甲醛固定30 min,并用结晶紫染色30 min,漂洗后于显微镜下拍照并统计迁移入下室的细胞。细胞迁移实验则不采用基质胶让肿瘤细胞迁移24 h。
1.8 双荧光素酶报告基因检测实验NF⁃κB 信号通路活性检测采用报告质粒pNFκB⁃TA⁃Luc(Clon⁃tech)。该质粒在荧光素酶基因(Luciferase)前含有NF⁃κB顺式作用增强元件(NF⁃κB cis⁃acting enhanc⁃er element),能够检测NF⁃κB 信号通路的活性。细胞接种于24 孔板,运用Lipofectamine 3000 共转染Smart Silencer 或NC、pNFκB⁃TA⁃Luc 以及Renilla 内参基因,转染6 h 后更换为含10% FBS 的DMEM 培养基,36 h 后根据Dual⁃luciferaseTMReport Assay Kit说明书检测荧光素酶活性。
1.9 Western Blot 检测采用RIPA 裂解液裂解细胞收集总蛋白,运用BCA 试剂盒测定蛋白浓度。制备蛋白样品,经SDS-聚丙烯酰胺凝胶(SDS⁃PAGE)凝胶电泳,聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)转膜后,用5%的脱脂牛奶封闭60 min。一抗4 ℃孵育过夜、二抗室温孵育2 h,之后采用ECL 化学发光法进行显影。
1.10 TANRIC(The Atlas of Noncoding RNAs in Cancer)数据分析TANRIC(https://bioinformatics.mdanderson.org/public⁃software/tanric/)分析了来源于TCGA(The Cancer Genome Atlas Program)的RNA⁃seq 数据,使得研究者能够快速且直观地分析感兴趣的lncRNAs。为了鉴定在甲状腺癌中具有差异表达的lncRNAs,笔者从TANRIC 中下载了497 例甲状腺癌样本及59 例癌旁非癌组织样本的lncRNAs 数据。利用SPSS 20.0 软件的成组t检验方法分析肿瘤组和癌旁组的差异表达的lncRNAs。
1.11 统计学方法所有统计分析均使用IBM SPSS Statistics 20.0 软件,统计方法使用t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 AC244502.3⁃201在PTC 中高表达为了寻找在甲状腺癌中具有差异表达的lncRNAs,本研究分析了TANRIC 下载的甲状腺癌lncRNAs 表达数据。取差异倍数≥20倍且P<0.01的lncRNAs(共96个)进一步分析。笔者注意到其中AC244502.3⁃201 表达明显升高(P< 0.05,图1A),且在肿瘤中尚无相关研究报道,于是笔者选择其进一步深入研究。在收集的10 对成对PTC 组织与相应癌旁组织中采用qRT⁃PCR 验证其表达情况,结果显示AC244502.3⁃201 在PTC 中的表达量相较癌旁组织明显升高(P< 0.05,图1B)。同时qRT⁃PCR 检测人正常甲状腺细胞(Nthy⁃ori3⁃1)和4 株PTC 细胞系(BCPAP、TPC1、KTC1 和K1)中AC244502.3⁃201 的表达量,结果显示AC244502.3⁃201 在PTC 细胞系中的表达明显升高(P<0.05,图1C)。
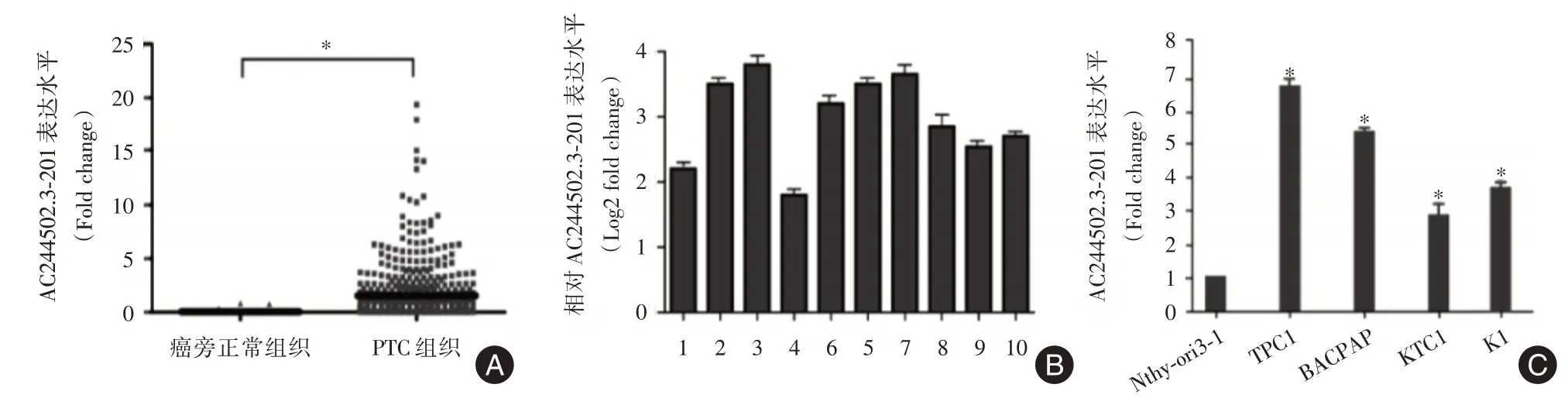
图1 AC244502.3⁃201 在PTC 中表达明显升高Fig.1 The expression of AC244502.3⁃201 is upregulated in PTC
2.2 AC244502.3⁃201 的基本生物学特征采用生物信息学软件(CPC,http://cpc.cbi.pku.edu.cn/)预测AC244502.3⁃201 的编码能力,结果表明其不具备蛋白编码的能力(图2A)。进一步利用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)分 析AC244502.3⁃201 的序列,结果显示AC244502.3⁃201的序列中不含有>100 个氨基酸的开放阅读框(图2B),进一步证实AC244502.3⁃201 不具备编码蛋白的能力。在PTC 细胞系(BCPAP 和TPC1)中,核浆分离RNA 实验结合qRT⁃PCR 检测AC244502.3⁃201细胞定位,结果显示AC244502.3⁃201 主要定位于细胞浆(图2C)。
2.3 细胞水平敲低AC244502.3⁃201 的表达抑制PTC 细胞的增殖前面结果已表明AC244502.3⁃201的表达量在BCPAP和TPC1中升高更为明显,所以选择BCPAP 和TPC1 细胞用来做敲低实验验证生物学功能。采用Smart silencer 敲低AC244502.3⁃201 的表达,qRT⁃PCR 实验结果显示Smart silencer能显著降低细胞内AC244502.3⁃201 的表达(P<0.05,图3A)。CCK⁃8检测结果显示敲低AC244502.3⁃201 表达后细胞活力较对照组明显降低(P<0.05,图3B)。EdU 实验结果显示敲低AC244502.3⁃201表达的细胞在24 h 之后EdU 标记的阳性细胞数目较对照组明显减少(P<0.05,图3C)。克隆形成实验结果显示敲低AC244502.3⁃201 表达之后细胞集落数目显著低于对照组(P<0.05,图3D)。
2.4 细胞水平敲低AC244502.3⁃201 的表达抑制了PTC 细胞的迁移和侵袭在PTC 细胞系(BC⁃PAP 和TPC1)中敲低AC244502.3⁃201 表达,Tran⁃swell 实验证明敲低AC244502.3⁃201 表达后,无论是细胞的侵袭还是迁移能力都较对照组显著下降(P<0.05,图4A、4B)。
2.5 敲低AC244502.3⁃201 表达抑制了NF⁃κB 信号通路在PTC 细胞系(BCPAP 和TPC1)中敲低AC244502.3⁃201 表达后通过qRT⁃PCR 检测增殖、侵袭相关基因的表达水平,发现MYC、CCND1、MMP9及VEGF的表达均明显下调(P<0.05,图5A,5B)。考虑这些基因是NF⁃κB 信号通路的下游效应分子,进一步通过NF⁃κB 信号通路报告质粒分析AC244502.3⁃201 是否调控NF⁃κB 信号通路,结果发现AC244502.3⁃201 敲低显著抑制NF⁃κB 信号通路活性(P< 0.05,图5C)。同时提取相应细胞的核蛋白,发现AC244502.3⁃201 敲低显著抑制NF⁃κB p65 入核(P< 0.05,图5D)。以上结果表明AC244502.3⁃201 调控NF⁃κB 信号通路。
3 讨论
LncRNAs 本身不具有编码蛋白的能力,长期以来被认为是不具有生物学功能的“转录噪音”[12]。近年来大量的研究发现lncRNAs 广泛参与细胞的各种生物学行为如分化[13]、增殖[14]、衰老[15]、自噬[16]等,在基因转录翻译及或转录后调控等个方面发挥重要的调控作用。在PTC 中已经证实多种lncRNAs 的差异表达并在PTC 的发生发展中发挥重要作用,如lncRNA HIT000218960 能够增强HM⁃GA2 表达进而促进PTC 的恶性进展[17],而BANCR在PTC 中低表达起抑癌基因的作用[18]。然而这些差异表达的lncRNAs 中大部分的功能和分子机制还未被深入了解。

图2 AC244502.3⁃201 的基本生物学特征Fig.2 Characters of AC244502.3⁃201
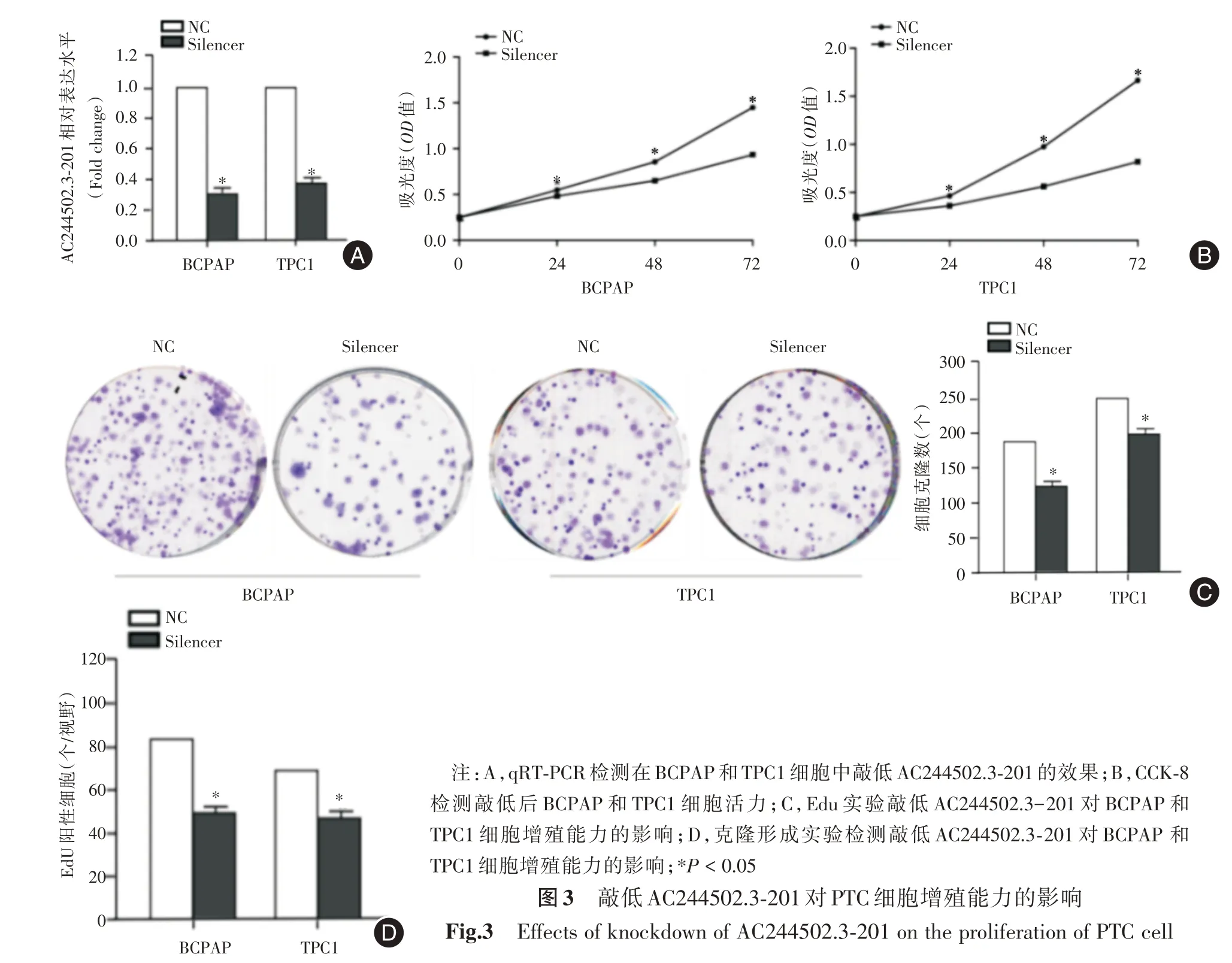
图3 敲低AC244502.3⁃201 对PTC 细胞增殖能力的影响Fig.3 Effects of knockdown of AC244502.3⁃201 on the proliferation of PTC cell
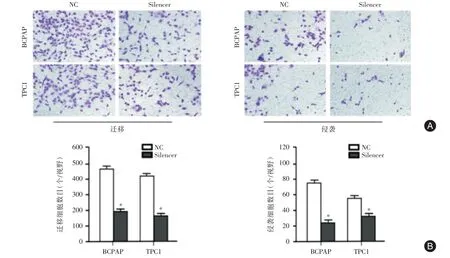
图4 敲低AC244502.3⁃201 对PTC 细胞迁移和侵袭能力的影响Fig.4 Effects of knockdown AC244502.3⁃201 on the migration and invasion of PTC cell
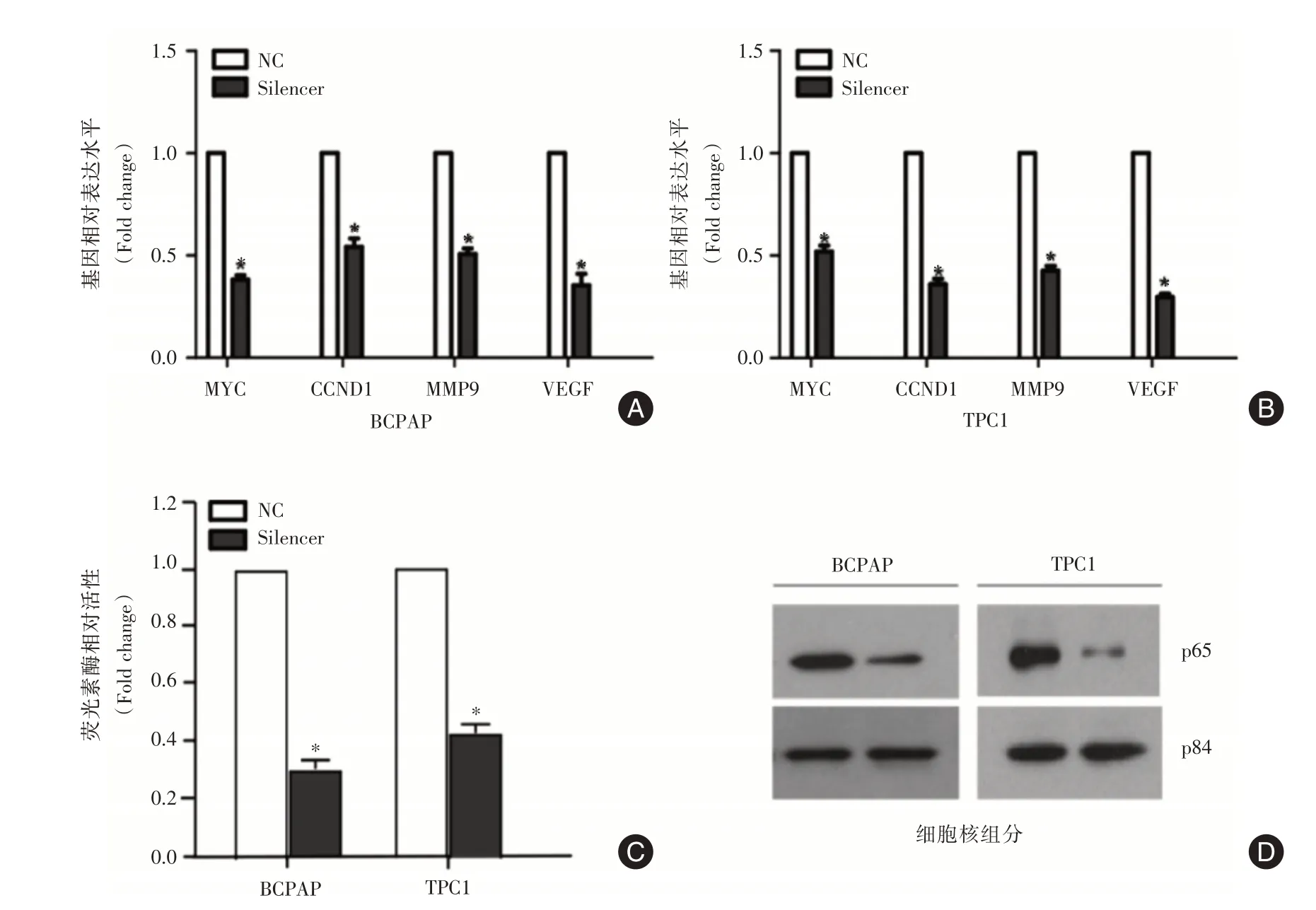
图5 敲低AC244502.3⁃201 表达对NF⁃κB 信号通路的影响Fig.5 Effects of knockdown AC244502.3⁃201 on the NF⁃κB signal pathway
关于AC244502.3⁃201 在肿瘤中的作用目前尚无相关报道。本研究通过对TANRIC 的数据和收集的PTC 患者的癌及癌旁组织进行分析,发现AC244502.3⁃201 在PTC 组织中表达明显上调。并进一步验证了相较于人正常甲状腺细胞,其在PTC 细胞系的表达也明显上调。这些提示了AC244502.3⁃201 在PTC 的发生发展中可能具有重要作用。然后明确了其作为长链非编码RNA 的生物学特性。并进一步通过多种体外实验证实了敲低AC244502.3⁃201 能够抑制PTC 细胞增殖、侵袭和迁徙能力,这证明了AC244502.3⁃201 能调控PTC 的生物学功能。既往研究证实NF⁃κB 信号通路参与PTC 的发生发展。如安石榴苷能够通过NF⁃κB 信号通路抑制BCPAP 细胞的衰老[19]。也有报道证实了lncRNAs 是NF⁃κB 信号网络中的重要一员[20]。然而在PTC 中lncRNAs 与NF⁃κB 信号通路的关联尚未被深入研究。本实验证实敲低AC244502.3⁃201 抑制了NF⁃κB 信号通路的活化,同时NF⁃κB 信号通路下游增殖及侵袭转移相关的基因的表达也被抑制。这些结果表明AC244502.3⁃201 通过调控NF⁃κB 信号通路参与PTC 的恶性进展。本研究首次阐明了AC244502.3⁃201 在PTC 中的表达、生物学功能及相关分子机制,为PTC 发生发展的理论添加了新的内容,同时为寻找可能的PTC 新的治疗靶点提供依据。
本研究的实验结果证实了AC244502.3⁃201 参与PTC 的发生发展,本研究不足之处:首先缺乏过表达AC244502.3⁃201 的相关细胞实验;其次缺乏体内动物模型的实验证据;另外AC244502.3⁃201调控NF⁃κB 通路的具体分子机制还需要进一步深入研究。后续将通过AC244502.3⁃201 过表达的细胞模型及体内动物模型中进一步验证其生物学功能,同时将深入探讨明确AC244502.3⁃201 调控NF⁃κB 信号通路的具体分子机制。由于lncRNAs发挥生物学功能常常与其亚细胞定位相关,因此结合AC244502.3⁃201 位于细胞浆和此前报道的lncRNAs 发挥生物学功能的相关分子机制[21-22],AC244502.3⁃201 可能作为分子支架在细胞浆中与NF⁃κB 信号通路中的重要调控分子结合发挥作用;也有可能作为诱饵吸附调控NF⁃κB 信号通路的microRNA 发挥作用。还需相关研究(RNA⁃pull down 结合质谱分析等)进一步探讨AC244502.3⁃201调控NF⁃κB信号通路的具体机制。
综上所述,本研究证实了AC244502.3⁃201 在PTC 中高表达,在BCPAP 和TPC1 细胞中敲低AC244502.3⁃201 表达能够抑制NF⁃κB 信号通路活性及下游相关基因的表达,最终抑制细胞增殖、侵袭和迁移。研究结果为理解PTC 发生发展的分子机制和可能治疗靶点提供新的内容。
