基于AR/SREBP⁃1/ACC1信号通路探讨雄激素诱导金黄地鼠皮脂代谢异常的发病机制
2020-05-22任威威薛兵方惠敏王迪任艳青杨彩瑞薛思思成秀梅
任威威 薛兵 方惠敏 王迪 任艳青 杨彩瑞 薛思思 成秀梅
河北中医学院,河北省肝肾病证研究重点实验室(石家庄050091)
痤疮是一种临床较为常见的皮肤病,据文献[1]报道,其影响全球9.4%的人口,已成为世界第8 大流行性疾病。痤疮的产生与青春期皮肤的生理病理变化密切相关,包括皮脂腺增生、皮脂分泌增加、毛囊滤泡过度角化、痤疮丙酸杆菌的定植等,其中雄激素水平升高引起的皮脂分泌异常是加速痤疮产生的关键环节。研究证实,人和许多动物的皮脂腺受雄激素的调控,而双氢睾酮(dihy⁃drotesto⁃ sterone,DHT)是最有效的雄激素[2],当DHT 刺激皮脂腺中雄激素受体(androgen receptor,AR),AR 则向细胞核移位,以二聚体的形式与胆固醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP⁃1)反应元件的特定DNA序列结合[3],进而调节下游靶基因乙酰辅酶A 羟化酶1(acetyl coenzyme A carboxylase 1,ACC1),使脂质分泌增多。SREBP 是参与体内脂质合成的一个重要调节因子[4-5],在肝脏脂质代谢方面研究较多[6],但在皮脂代谢方面研究较少。本实验以耳廓和背部皮脂腺具有高度依赖雄激素特性的金黄地鼠为动物模型[7],通过观察金黄地鼠耳廓皮脂腺状态、检测耳廓局部皮脂主要成分[8]游离脂肪酸(nonesterified free fatty acids,NEFA)和甘油三酯(TG)含量及耳廓组织中AR、SREBP⁃1、ACC1 蛋白表达水平,探索皮脂代谢异常与AR/SREBP⁃1/ACC1 信号通路的关系,为痤疮的治疗提供新的方向。
1 材料与方法
1.1 动物SPF 级雄性金黄地鼠,体质量(100±20)g,北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2016⁃0011。置于昼夜节律采光12 h,通风良好,湿度控制在59% ~65%的人工环境中,饲以全价营养颗粒饲料,自由饮水,1 周后用于实验。本实验方案经河北中医学院实验动物伦理委员会审核,批准号:HBTCM⁃2017⁃09。
1.2 主要试剂与仪器DHT粉剂(大连美仑生物技术有限公司,批号:D0825A);NEFA测试盒、TG测试盒(南京建成生物工程研究所,批号20190826、20190822);通用二步法试剂盒(北京中杉金桥生物技术有限公司,SP⁃9000);抗SREBP⁃1 多克隆抗体、AR 抗体(北京博奥森生物技术有限公司,批号P36956、P10275);ACC1 抗体(武汉三鹰生物技术有限公司,批号21923⁃1⁃AP);GAPDH 抗体(武汉塞维尔生物科技有限公司,批号GB11002)。
游标卡尺(上海量具刀具厂);微量进样器(上海高鸽工贸有限公司);Nanodrop 2000c 超微量分光光度计(美国Thermo 公司);DP72 光学电子显微镜(日本OLYMPUS 公司);ImageQuant LAS⁃4000 化学发光成像分析仪(日本GE 公司)164⁃5052 蛋白电泳和转膜转移仪(美国Bio⁃rad 公司)。
1.3 分组与给药雄性金黄地鼠耳廓和背部皮脂腺天生具有高度依赖雄激素特性,并且金黄地鼠皮脂腺的生理结构,皮肤代谢周期以及皮脂腺形态与人体皮肤相似,因此可作为研究皮脂腺功能和药物抗雄激素作用最佳动物模型[7]。20 只LVG雄性金黄地鼠随机分为两组,即对照组、DHT 组。DHT 粉剂溶解于无水乙醇溶液中,稀释浓度为0.1 mg/mL,用微量进样器取5 μL 的DHT 溶液外涂于金黄地鼠内耳廓中2/3 处,对照组外涂同等剂量无水乙醇溶液,每日1 次,连续给药18 d[9]。
1.4 耳廓组织HE 染色采用直径为9 mm 打孔器取下金黄地鼠耳廓中2/3 处组织,经生理盐水冲洗,滤纸吸干,4%多聚甲醛室温固定后进行石蜡包埋、切片(厚约3 μm)、脱蜡、水化、常规苏木精-伊红染色,光镜下观察两组耳廓组织的病理变化。
1.5 耳廓组织油红O 染色将金黄地鼠耳廓组织加入适当包埋剂进行固定,用冰冻切片机切取8 μm 冰冻组织,进行油红O 染色,苏木素复染,因油红O 为脂溶性,可使组织细胞内中性脂质成分显示为橘红色,因此可通过显微镜观察金黄地鼠耳廓组织脂质分泌情况。
1.6 耳廓组织NEFA 和TG 含量检测取下金黄地鼠耳廓组织,称重后加入9 倍体积生理盐水,进行组织匀浆,提取上清后按照比色法标准操作步骤,检测耳廓组织中NEFA 和TG 的含量。
1.7 耳廓组织AR、SREBP⁃1、ACC1 蛋白含量检测免疫组化:将石蜡切片进行脱蜡、水化、抗原修复(柠檬酸钠加热修复)、抗体孵育、DAB 染色、苏木精复染、PBS 返蓝、树胶封片,显微镜下观察切片染色情况。以PBS 为阴性对照,结果可见细胞核呈蓝色,阳性显色区域为棕黄色。使用图像分析软件Image J 1.8.0,整理分析阳性显色的平均光密度值(IOD/Area)。
Western Blot:提取金黄地鼠耳廓组织总蛋白,BCA 法测定各组蛋白浓度。根据蛋白定量结果进行上样(8 μL)、SDS⁃PAGE 电泳2 h。转膜条件:SREBP⁃1 和AR 半干转法(25 V,30 min);ACC1 湿转法(300 mA,4 h)。经脱脂奶粉封闭1 h 后,加入一抗SREBP⁃1(1∶2 000)、AR(1∶1 000)、ACC1(1∶1 000)置4 ℃过夜,洗膜,加入HRP 标记的山羊抗兔二抗(1∶3 000),采用化学发光法显影。
1.8 统计学方法采用SPSS 20.0 统计软件进行实验数据分析处理,计量资料用均值±标准差表示,组间比较采用独立样本t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 耳廓组织病理变化对照组:金黄地鼠内耳廓皮脂腺分布呈分叶状,排列相对松散,部分腺叶较小。DHT 组:金黄地鼠内耳廓皮脂腺排列较对照组更加紧密,腺叶增大且数目增多。见图1。
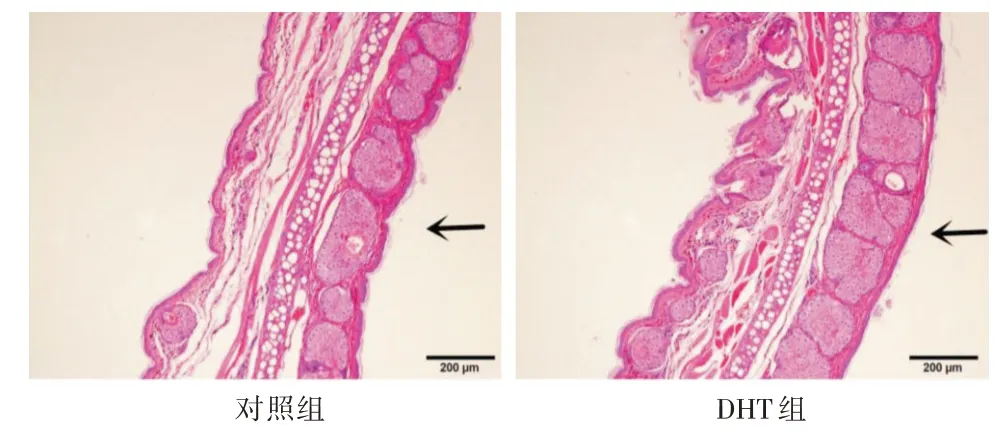
图1 耳廓组织病理图片(HE,×100)Fig.1 Pathological picture of ear tissue(HE,×100)
2.2 耳廓组织油红O 染色结果对照组金黄地鼠耳廓组织皮脂腺细胞胞浆内可见少量团状红色脂滴;DHT 组与对照组比较,皮脂腺细胞内脂滴分泌增多,且融合成片状。见图2。

图2 耳廓组织油红O 染色病理图片(油红O,×400)Fig.2 Pathological picture of oil red O staining in ear tissue(oil red O,×400)
2.3 耳廓组织局部游离脂肪酸(NEFA)和甘油三酯(TG)含量变化DHT 组与对照组比较,金黄地鼠耳廓局部NEFA 和TG 含量均显著升高,差异有统计学意义(P<0.01),见表1。

表1 DHT 对皮脂中NEFA 和TG 含量的影响Tab.1 Effect of DHT on NEFA and TG content in sebum x±s
2.4 耳廓组织AR、SREBP⁃1、ACC1蛋白含量变化
2.4.1 免疫组化法检测结果免疫组化结果显示,AR 阳性染色区域为皮脂腺细胞核,与对照组比较,DHT 组AR 表达量升高,差异有统计学意义(P< 0.01);SREBP⁃1 阳性染色区域为皮脂腺细胞核,与对照组比较,DHT 组SREBP⁃1 表达量升高,差异有统计学意义(P<0.05);ACC1 阳性染色区域为皮脂腺细胞核和细胞浆,与对照组比较,DHT 组ACC1 表达量升高,差异有统计学意义(P< 0.05);免疫组化图片见图3,各组平均光密度值测定结果见表2。

图3 DHT 对AR、SREBP⁃1、ACC1 蛋白表达水平的影响(IHC,×400)Fig.3 Effect of DHT on expression level of AR,SREBP⁃1 and ACC1(IHC,×400)
表2 两组AR、SREBP⁃1、ACC1 平均光密度值Tab.2 Average optical density values of AR,SREBP⁃1 and ACC1 in two groups ±s

表2 两组AR、SREBP⁃1、ACC1 平均光密度值Tab.2 Average optical density values of AR,SREBP⁃1 and ACC1 in two groups ±s
注:与对照组比较,#P<0.05,##P<0.01
组别对照组DHT 组AR 0.262±0.006 0.383±0.027##SREBP-1 0.369±0.016 0.450±0.029#ACC1 0.272±0.009 0.342±0.030#
2.4.2 Western Blot 检测结果与对照组相比较,DHT 组AR、SREBP⁃1、ACC1 蛋白表达均显著升高,差异有统计学意义(P<0.01),见图4。
3 讨论

图4 耳廓组织AR、SREBP⁃1、ACC1 蛋白表达水平比较Fig.4 Comparison of expression levels of AR,SREBP⁃1 and ACC1 proteins in ear tissue
痤疮是一种皮脂腺慢性炎症性疾病,于青春期多见,其临床表现主要有脂溢、粉刺、丘疹、脓疱、结节等[10]。痤疮的产生与皮肤生理病理变化相关,包括皮脂腺增生、皮脂分泌增加、毛囊滤泡过度角化、痤疮丙酸杆菌的定植等,其中雄激素水平升高引起的皮脂分泌异常是加速痤疮产生的关键环节,因此抑制皮脂分泌是治疗痤疮的重要靶点。本实验以雄性金黄地鼠为动物模型,其耳部和背部皮脂腺高度依赖雄激素水平,且生理和解剖结构与人体皮肤相似,因此是研究皮脂腺功能和雄激素效应的最佳动物模型[7]。DHT 为最有效的雄激素[2],实验通过外用DHT 对金黄地鼠耳部皮脂腺进行干预,观察高雄激素刺激下皮脂腺功能和皮脂分泌状态,并进一步研究皮脂代谢异常是否与雄激素诱导AR/SREBP⁃1/ACC1 信号通路的过度激活有关。
人体皮脂主要由NEFA/TG(57%)、蜡酯(26%)、角鲨烯(12%)和胆固醇(2%)组成[8],适量的皮脂可以保护皮肤,防止感染,但皮脂分泌过多则是痤疮形成的重要病理因素[11]。油红O 为脂溶性染料,可使组织中脂滴着色,本实验通过油红O 染色和生化检测皮脂主要成分NEFA 及TG 含量,探讨皮脂分泌情况,结果证实,DHT 组金黄地鼠耳廓组织较对照组脂滴增多,且多融合成片,皮脂主要成分NEFA 和TG 含量均明显升高,说明DHT 可刺激金黄地鼠耳廓皮脂腺,使皮脂分泌增多。
皮脂的分泌与皮脂腺功能密切相关,而皮脂腺功能受雄激素的调控。睾酮是人体中主要的循环雄激素,相关研究[12]表明,其血清浓度水平与皮脂分泌量和痤疮严重程度呈正相关,而睾酮主要是在5⁃α还原酶的作用下转化为更有效力的DHT,并通过与AR 结合,进而刺激皮脂腺细胞增殖。皮脂腺中的基底细胞和分化的皮脂腺细胞均有AR的表达[13],并且有核定位。AR 是一种存在于X 染色体上由雄激素配体激活的细胞内转录因子[14],属于类固醇/核受体超家族[15],当DHT 与AR 结合后,AR 则与热休克蛋白解离,发生构象改变,进而暴露核移位信号。在细胞核内,被激活的AR与雄激素反应元件(androgen response element,ARE)DNA序列结合,从而诱导相关脂质调节基因的转录[16]。SREBPs 是一种调节脂质代谢的重要核转录因子[17],其裂解活化蛋白(SREBP cleavage⁃activating protein,SCAP)内含子上存在ARE[18],因此ARE 与AR 的结合,可以加速SCAP 的转录,促进SREBPs的活化。SREBP⁃1 可与下游靶基ACC 启动子区的固醇调节原件(sterol⁃response element,SRE)DNA序列结合[19-20],ACC 是控制脂肪酸生物合成的第一步限速酶[13],主要存在两种基因形式ACC1 和ACC2[21],ACC1 多存在于脂肪组织中,ACC1 表达升高可间接降低脂肪酸的氧化水平,促进皮脂主要成分NEFA 合成[22]。
雄激素与AR 结合后介导的SREBP 通路与众多疾病有关,SHIN 等[23]研究发现通过抑制SREBP的裂解活化蛋白以及生长因子β,可抑制DHT 诱导的雄激素性脱发。SREBP 通路在肝脏脂质代谢方面同样发挥着重要作用[24-25],但该通路在雄激素诱导的皮脂代谢异常方面研究较少。为进一步探讨DHT 刺激皮脂腺后皮脂分泌增多是否与AR/SREBP⁃1/ACC1 信号通路的调节有关,本实验通过免疫组化和Western Blot 分别检测金黄地鼠耳廓组织AR、SREBP⁃1、ACC1 蛋白表达水平,结果显示,DHT 可使AR、SREBP⁃1、ACC1 蛋白表达水平升高,说明其通过AR/SREBP⁃1/ACC1信号通路的过度激活使金黄地鼠耳廓皮脂分泌增多。本实验研究结果与ROSIGNOLI 等[26]提出的雄激素可通过SREBP 信号通路影响皮脂腺细胞增值和脂质分泌增多的观点相吻合,充分证明AR/SREBP⁃1/ACC1在皮脂代谢方面的重要作用。
综上所述,本实验初步探讨了雄激素可通过AR/SREBP⁃1/ACC1 信号通路调节皮脂分泌的作用机制,为痤疮的临床治疗提供新的思路。
