MALAT1对Aβ1-42诱导PC12细胞损伤及PI3K/Akt通路的影响研究
2020-05-21王小言夏鹰彭俊金虎陈伟明陈晓东聂柳郑忠涛
王小言 夏鹰 彭俊 金虎 陈伟明 陈晓东 聂柳 郑忠涛
阿尔兹海默病(Alzheimer disease,AD)典型病理学改变主要为大脑皮质神经元细胞外有大量淀粉样蛋白斑块形成,β-淀粉样蛋白(amyloid β-protein,Aβ)沉积可引起细胞凋亡,在AD发病机制中起重要作用[1-2]。肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是一种长链非编码RNA(long non-coding RNA,lncRNA),在高糖诱导的内皮细胞炎症、脂多糖(LSP)诱导的炎症、AD及多种癌症中发挥重要作用,且与磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路密切相关[3-7],但MALAT1是否在大鼠肾上腺嗜铬细胞瘤PC12细胞损伤中发挥作用尚鲜有报道。PC12细胞具有神经内分泌细胞的一般特征,广泛作为模型细胞用于神经生理学和药理学研究[8]。本研究通过建立Aβ1-42诱导PC12细胞凋亡损伤模型,旨在观察下调MALAT1表达对PC12细胞凋亡损伤及PI3K/Akt通路的影响,为AD发病机制及靶向治疗提供一定理论参考。
1 材料和方法
1.1 材料大鼠肾上腺嗜铬细胞瘤PC12细胞由中国医学科学院药物研究所提供。
1.2 主要试剂及仪器高级DMEM培养基(12491-023)购自赛默飞世尔科技(中国)有限公司,胎牛血清(FBS,10099141)购自美国Gibco公司,Aβ1-42(SIGMA-A9810)购自美国Sigma,MALAT1及其内参引物序列、MALAT1干扰序列和对照组序列均由广州锐博生物科技有限公司合成,Trizol试剂(R0016)为上海碧云天公司产品,TB Green® Premix Ex TaqTMⅡ(Tli RNaseH Plus,RR820A)、PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(6210A)均购自TaKaRa公司,Lipofectamine® 2000转染试剂盒(11668-1.5 mL)、兔源一抗p-PI3K(MA5-14870)、Cleaved-caspase3(700182)、二抗羊抗鼠IgG(A-11001)、羊抗兔IgG(A-11008)均购自美国Invitrogen公司,兔源一抗AKT(ab18785)、p-AKT(ab38449)、PI3K(ab70912)、Bcl-2(ab185002)、Bax(ab32503)、β-actin抗体(ab179467)购自英国Abcam公司,CCK-8试剂盒(YT128)购自北京百奥莱博生物科技有限公司,AnnexinⅤ-FITC凋亡检测试剂盒(APOAF)购自美国Sigma公司。FACS Canto Ⅱ流式细胞仪购自美国BD公司,FC酶标仪、Forma Steri-Cycle i160 5%(体积分数)CO2培养箱购自美国Thermo Fisher公司,IX73倒置显微镜购自日本Olympus公司等。
1.3 方法
1.3.1PC12细胞培养及分组:PC12细胞复苏后接种于含10%(体积分数)FBS、1%(体积分数)轻链霉素DMEM培养基的细胞培养瓶中,置37℃、5%(体积分数)CO2细胞培养箱中培养,传代消化时用0.25%(质量浓度)胰蛋白酶消化。将对数期生长PC12细胞消化计数后接种于6孔细胞板,每孔约1×106个细胞,培养基2 mL,待细胞汇合至50%~60%时,更换含10mol/L Aβ1-42培养基培养PC12细胞以诱导PC12细胞损伤建立损伤模型[9]。将培养的PC12细胞随机分为正常对照组、模型组、sh-对照组及sh-MALAT1组,每组6个复孔。sh-MALAT1组在模型组处理基础上采用脂质体2000转染试剂转染MALAT1干扰序列(5′-GGCTCTTCCTTCTGTTCTA-3′),以观察干扰MALAT1后对Aβ1-42诱导的PC12细胞损伤的影响;sh-对照组:即干扰组阴性对照,转染MALAT1干扰对照序列(5′-TTCTCCGAACGTGTC-ACGTTTCAAGAGAACGTGACACGTTCGGAGA- A-3′),具体步骤严格按照试剂盒说明书进行;正常对照组:无任何处理正常生长的PC12细胞。各组PC12细胞继续培养至24 h后进行后续试验。
1.3.2MALAT1表达水平检测:收集“1.2.1”中各组PC12细胞,添加Trizol试剂提取总RNA,经纯度及浓度检测合格后反转录合成cDNA,采用实时定量PCR(real-time quantitative PCR,RT-qPCR)试剂盒进行MALAT1扩增,MALAT1上游引物序列为:5′- GTGATGCGAGTTGTTCTCCG-3′,下游引物序列为:5′- CTGGCTGCCTCAATGCCTAC -3′;内参β-actin上游引物序列为:5′- GAGACCTTCAACACCCCAGCC-3′,下游引物序列为:5′- AATGTCACGCACGATTTCCC -3′,每个样品设置3个复孔。反应条件设置:95℃,30 s;95℃,5 s;60℃,34 s,40个循环;添加溶解曲线。MALAT1相对表达量采用2-ΔΔCT法进行分析。
1.3.3PC12细胞存活检测:将对数期生长PC12细胞消化计数后,培养结束后以5×104个/mL接种于96孔细胞板培养24 h后,每孔添加10L CCK-8,培养箱中孵育3 h,酶标仪测定各组PC12细胞各孔570 nm处吸光度值,按下列公式计算细胞存活率:细胞存活率=处理组吸光度/对照组吸光度×100%。
1.3.4PC12细胞凋亡检测:收集各组PC12细胞,添加0.5 mL结合缓冲液混匀悬浮细胞,每个待检样品分别添加5L AnnexinⅤ-FITC、PI,室温避光孵育20 min后,采用流式细胞仪检测PC12细胞凋亡率。
1.3.5PC12细胞PI3K/Akt通路及下游凋亡相关蛋白表达:提取各组PC12细胞总蛋白,采用二喹啉甲酸(BCA)试剂盒检测562 nm处样品蛋白含量。取80g蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),恒压转膜,5%(体积分数)脱脂奶粉室温封闭120 min,PBST冲洗3次,每次20 min。分别添加一抗AKT(1∶1000)、p-AKT抗体(1∶1000)、PI3K抗体(1∶50)、p-PI3K抗体(1∶1000)、Bcl-2抗体(1∶500)、Bax抗体(1∶500)、Cleaved-caspase3抗体(0.1 ~0.2 μg/mL)、β-actin抗体(1∶500),4℃孵育过夜,PBST 缓冲液洗3次,每次 20 min,用适量含2%(质量浓度)脱脂奶粉的PBS稀释辣根过氧化物酶标记的二抗IgG(1∶5000)室温孵育1 h后,洗膜,显色,暗室滴加ECL发光液,曝片拍照,应用Image J图像分析软件分别计算各蛋白条带灰度值,以靶蛋白条带与β-actin蛋白条带比值表示靶蛋白相对表达水平。
1.4 统计学处理采用SPSS20.0统计软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PC12细胞存活率、凋亡率及MALAT1表达比较4组间细胞存活率、凋亡率及MALAT1表达水平比较差异有统计学意义(均P<0.01)。两两比较结果显示,模型组与sh-对照组间MALAT1表达、PC12细胞存活率及凋亡率比较差异无统计学意义(P>0.05);与正常对照组比较,模型组、sh-对照组MALAT1表达水平、PC12细胞凋亡率高(P<0.05),而PC12细胞存活率低(P<0.05);与模型组和sh-对照组比较,sh-MALAT1组MALAT1表达水平、PC12细胞凋亡率减低(P<0.05),而PC12细胞存活率高(P<0.05)。结果见表1和图1。
2.2 各组PC12细胞PI3K/Akt通路及下游凋亡相关蛋白表达4组PC12细胞p-PI3K/PI3K、p-Akt/Akt、Cleaved-caspase3/caspase3、Bax及Bcl-2蛋白表达水平比较差异均有统计学意义(均P<0.01)。两两比较显示,模型组组和sh-对照组PC12细胞上述各蛋白表达水平差异比较均无统计学意义(均P>0.05);与正常对照组比较,模型组、sh-对照组PC12细胞p-PI3K/PI3K、p-Akt/Akt、Bcl-2蛋白表达水平低(均P<0.05),而Cleaved-caspase3/caspase3、Bax蛋白水平高(均P<0.05);与模型组和sh-对照组比较,sh-MALAT1组PC12细胞p-PI3K/PI3K、p-Akt/Akt及Bcl-2蛋白表达水平高(均P<0.05),而Cleaved-caspase3/caspase3、Bax蛋白表达低(均P<0.05)。结果见表2、图2~3。
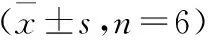
表1 各组PC12细胞存活率、凋亡率及MALAT1表达水平比较
注:MALAT1:肺腺癌转移相关转录本1;与正常对照组比较,aP<0.05;与模型组和sh-对照组分别比较,bP<0.05
图1 各组PC12细胞凋亡流式细胞图

表2 各组PC12细胞不同蛋白相对表达水平比较
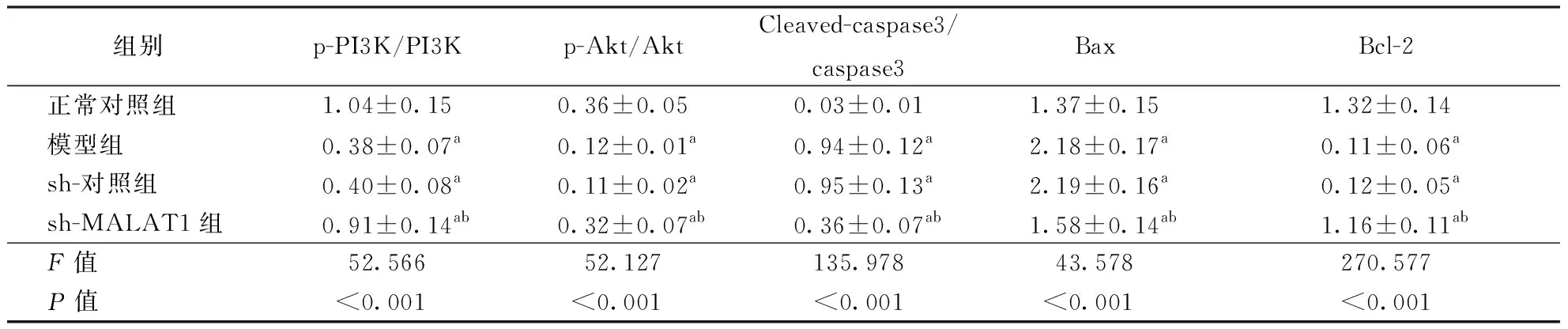
组别p-PI3K/PI3Kp-Akt/AktCleaved-caspase3/caspase3BaxBcl-2正常对照组1.04±0.150.36±0.050.03±0.011.37±0.151.32±0.14模型组0.38±0.07a0.12±0.01a0.94±0.12a2.18±0.17a0.11±0.06ash-对照组0.40±0.08a0.11±0.02a0.95±0.13a2.19±0.16a0.12±0.05ash-MALAT1组0.91±0.14ab0.32±0.07ab0.36±0.07ab1.58±0.14ab1.16±0.11abF值52.56652.127135.97843.578270.577P值<0.001<0.001<0.001<0.001<0.001
注:PI3K:磷脂酰肌醇3-激酶,p-PI3K:磷酸化磷脂酰肌醇3-激酶,Akt:蛋白激酶B,p-Akt:磷酸化蛋白激酶B,caspase3:半胱氨酸天冬氨酸蛋白酶3,Bax:B-细胞白血病淋巴瘤-2-相关X蛋白;Bcl-2:B-细胞淋巴瘤因子2;图2~3同。与正常对照组比较,aP<0.05;与模型组和sh-对照组分别比较,bP<0.05
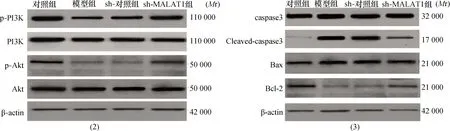
图2 各组PC12细胞p-PI3K/PI3K、p-Akt/Akt蛋白表达条带图 图3 各组PC12细胞Cleaved-caspase3、caspase3、Bax、Bcl-2蛋白表达条带图
3 讨论
AD是一种慢性中枢神经系统退行性疾病,临床多表现为认知和记忆功能减退,好发于中老年人群,且发病率呈逐年增加趋势,是继心血管疾病和肿瘤后引起老年人死亡的第三大病因[10]。目前临床尚无特效治疗药物,因此研究AD发生、发展机制可能对临床寻找AD靶向治疗药物具有重要意义。Aβ是正常细胞内淀粉样前体蛋白(APP)的裂解产物,神经元信息主要通过PI3K/Akt通路进行传导,其下传受阻可导致Aβ异常沉积,Tau样蛋白过度磷酸化,促进神经元凋亡,进而导致AD发生[11]。PC12细胞是大鼠肾上腺髓质嗜铬瘤分化细胞株,能合成多巴胺等儿茶酚胺类物质,且含多巴胺代谢相关酶,在功能和形态上更接近多巴胺能神经元,临床常用于神经药理、病理研究,Aβ1-42诱导PC12细胞损伤已成为研究AD一种常用细胞模型[12]。
MALAT1位于人类染色体11q13.1,是一种致癌性lncRNA,在口腔鳞癌、骨肉瘤等多种肿瘤中表达上调,可促进肿瘤细胞增殖、转移和侵袭等[13-14],还可参与免疫调节过程,在高糖诱导的人脐静脉内皮细胞(HUVECs)中高表达,与炎性反应有关[15]。本研究结果显示,与正常对照组比较,模型组组、sh-对照组MALAT1表达、PC12细胞凋亡率高,而PC12细胞存活率低;与模型组和sh-对照组比较,sh-MALAT1组MALAT1表达水平、PC12细胞凋亡率低,而PC12细胞存活率高,提示P12细胞损伤模型构建成功,Aβ1-42可诱导PC12细胞凋亡,抑制其增殖,可能与MALAT1升高有关,干扰MALAT1后可下调损伤PC12细胞中MALAT1水平,降低PC12细胞凋亡率,促进其存活。
PI3K/Akt通路是一条重要凋亡抑制通路,在神经元损伤存活中发挥重要作用。PI3K活化后可激活下游蛋白Akt,活化后的Akt可调节其下游多种凋亡相关基因,促进凋亡基因失活,进而抑制神经元凋亡。本研究结果显示,与正常对照组比较,模型组、sh-对照组PC12细胞p-PI3K/PI3K、p-Akt/Akt蛋白以及Bcl-2蛋白表达水平低,Bax蛋白表达高,与Aβ1-42组、sh-Crtl组比较,sh-MALAT1组PC12细胞p-PI3K/PI3K、p-Akt/Akt、Bcl-2蛋白表达水平升高,Cleaved-caspase3/caspase3、Bax蛋白表达降低,推测下调MALAT1可能通过促进p-PI3K/PI3K、p-Akt/Akt蛋白表达激活PI3K/Akt通路,磷酸化后的Akt可编码下游凋亡蛋白Cleaved-caspase3/caspase3、Bax、CytC和Bcl-2等蛋白表达,提示下调MALAT1可能通过激活PI3K/Akt通路抑制Aβ1-42诱导的PC12细胞损伤,发挥保护作用。
综上所述,本研究结果显示,下调MALAT1表达可能通过激活PI3K/Akt通路,上调Bcl-2蛋白表达,下调Bax、Cleaved-caspase3蛋白表达抑制Aβ1-42诱导的PC12细胞损伤,这可能对AD发生、发展机制研究及靶向药物研发提供新的靶点,但具体作用机制尚需进一步研究。
