粪菌移植对实验性自身免疫性脑脊髓炎小鼠肠道功能及细胞因子的影响
2020-05-21王志豪李作孝
王志豪 李作孝
多发性硬化(multiple sclerosis,MS)作为一种具有致残性的中枢神经系统慢性脱髓鞘疾病,其病因和发病机制尚未完全明确,可能与病毒感染、自身免疫反应、遗传因素、环境因素有关。近年来研究发现,肠道微生态改变,特别是肠道菌群紊乱、失调与溃疡性结肠炎、肝硬化、MS、系统性自身免疫性疾病等多种疾病有关[1]。肠道与大脑之间存在微生物-肠-脑轴(microbiota-gut-brain axis),肠道菌群可通过此轴调控中枢神经系统发育与功能。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是目前研究MS最常用的动物模型,Cekanaviciute等[2]研究发现,与健康受试者粪便定植的小鼠相比,用MS患者衍生的粪便定植的无菌小鼠会出现更严重的EAE症状。粪菌移植(fecal microbiota transplantation,FMT)是一种重塑肠道正常菌群的方法,通过改变肠道微生物的数量、结构、类型以及对机体的免疫调节,对肠道和非肠道疾病发挥一定治疗作用[3]。本研究通过观察FMT对EAE小鼠发病及肠道功能和细胞因子的影响,旨在探讨FMT对EAE小鼠发病的防治作用。
1 材料和方法
1.1 实验动物选用6~8周龄清洁级SPF级C57BL/6雌性小鼠30只,体重18~22 g,购于北京斯贝福生物技术有限公司〔许可证号:SCXK(京)2016-0002〕。将小鼠随机分为正常对照组、EAE模型组、FMT干预组,每组10只。所有小鼠饲养于西南医科大学忠山校区清洁级动物房内,自由进食及饮用无菌蒸馏水,室温(24±2)℃,12 h明暗交替,实验过程符合《实验动物饲养和使用条例》,且经西南医科大学动物保护与使用机构委员会批准通过。
1.2 主要试剂包括髓鞘少突胶质细胞糖蛋白肽35-55(MOG35-55,上海吉尔生化有限公司),完全福氏佐剂、百日咳毒素(美国Sigma公司),卡介苗冻干粉 (上海瑞楚生物科技有限公司),双歧杆菌、乳杆菌、肠球菌培养基(北京陆桥技术有限责任公司),梭菌、拟杆菌培养基(青岛海博生物技术有限公司),肠杆菌培养基(北京奥博星生物技术有限责任公司),真杆菌培养基(卡迈舒上海生物科技有限公司),酵母菌培养基(北京北纳创联生物技术研究院)及小鼠白细胞介素1β(IL-1β)、IL-6、肿瘤坏死因子α(TNF-α)ELISA试剂盒(武汉科鹿生物科技有限责任公司)。
1.3 方法
1.3.1粪便滤液制备[4-5]:(1)收集粪便:于早晨8:00采用肛门刺激法促使正常对照组小鼠排便,收集每只小鼠新鲜成型粪便2粒,共20粒混匀,称取5 g粪便。(2)粪便混悬液的制备:将小鼠粪便按质量1∶10溶解于无离子水中,置于搅拌器中进行搅拌,取混悬液。(3)过滤:用双层无菌纱布过滤,收集悬液。(4)离心:混悬液以6000 r/min离心20 min(离心半径=10 cm)。(5)重悬:离心后弃掉上清,将沉淀悬浮于50 mL生理盐水,上下颠倒混匀,即为粪便滤液。粪便滤液当天制备当天使用。
1.3.2EAE模型制备:造模前各组小鼠均禁食、禁饮24 h,将MOG35-55溶于PBS液中,稀释为3 mg/mL,卡介苗溶于完全福氏佐剂中,浓度为10 g/L。将上述2种液体按体积1∶1混匀后于冰上持续抽打乳化至油包水状态。用1 mL注射器于小鼠背部皮下注射诱导乳化剂0.2 mL(脊柱两侧任选4点各0.05 mL),于造模当天及2 d后,给予小鼠腹腔注射百日咳菌稀释液0.5 mL,制备EAE模型。正常对照组以同样方式注射等量生理盐水。造模后根据行为学评分标准评分,≥2分即为发病,表示造模成功[6]。FMT干预组于造模第2天起给予当天制备的新鲜粪便滤液0.4 mL灌胃,1次/d,共14 d。正常对照组、EAE模型组小鼠按相同方案给予等量生理盐水灌胃。收集EAE模型组和FMT干预组小鼠发病高峰期(神经功能评分连续3 d无变化)成型粪便(2粒/只),立即至于液氮中并随即转入-80℃冰箱保存。正常对照组小鼠于28 d后以同样方法收集粪便。处死各组小鼠后取尾静脉血和脑组织进行后续实验。
1.3.3小鼠发病情况观察:造模当天起每天早上8:00对各组小鼠发病情况进行观察,确定小鼠发病潜伏期及达高峰期时间,并根据Kono等[7]5分评分法进行神经功能评分:0分为不发病,1分为尾巴无力,2分为轻微后肢无力,3分为严重后肢麻痹,4分为四肢麻痹,5分为濒死或死亡。
1.3.4肠道菌群检测:检测时取各组每只小鼠冻存粪便0.5 g,分别加入稀释液进行连续稀释(10-2~10-7),取20 μL稀释菌液接种于肠杆菌、肠球菌、酵母菌、拟杆菌、双歧杆菌、乳酸杆菌、真杆菌及梭菌的选择性培养基上。前3种为需氧菌,置于37 ℃普通培养箱培养48 h,其余为厌氧菌,置于厌氧培养箱中培养72 h。采用日本光冈肠道菌群分析法进行定性定量检测,以API生化鉴定系统的厌氧菌三级鉴定法鉴定菌种,鉴定细菌至属水平,计数并记录每个平板上的菌落数,求出各平板平均菌落数,并算出平板菌落总数,取均值后计算原始样品每克中的菌落数,最终结果以每克湿粪的菌落形成单位(colony forming unit,CFU)的对数值表示。采用B/E值反映肠道的功能状况,其≥1表示肠道定植抗力正常,≤1表示肠道定植抗力降低,菌群结构发生紊乱。
1.3.5IL-1β、IL-6、TNF-α检测:取各组小鼠尾静脉血、脑组织检测IL-1β、IL-6、TNF-α水平,具体操作步骤按ELISA试剂盒说明书进行。
1.4 统计学处理采用SPSS 25.0统计软件进行统计学分析,符合正态分布的计量资料用均数±标准差表示,两均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,两两比较采用LSD法;计数资料比较采用卡方检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠发病情况正常对照组小鼠未见发病。EAE模型组和FMT干预组小鼠均出现不同严重程度发病,表现为精神萎靡、毛发光泽度降低、脱毛、食欲下降、体重减轻,症状逐渐加重出现尾部下垂,步态不稳,后肢行走无力,甚至瘫痪。各组小鼠均未出现死亡。FMT干预组发病潜伏期、达高峰期时间较EAE模型组延长(P<0.05),神经功能评分较EAE模型组降低(P<0.05)。结果见表1。

表1 两组小鼠发病潜伏期、达高峰期时间、高峰期神经功能评分比较
注:EAE:实验性自身免疫性脑脊髓炎,FMT:粪菌移植;表2~3同
2.2 各组小鼠肠道菌群值与B/E值比较与正常对照组比较,EAE模型组拟杆菌数量及B/E值降低(P<0.05);与EAE模型组比较,FMT干预组肠杆菌数量减少,双歧杆菌数量及B/E值增加(均P<0.05)。结果见表2。
2.3 各组小鼠血清、脑组织IL-1β、IL-6、TNF-α表达与正常对照组比较,EAE模型组小鼠血清及脑组织IL-1β、IL-6、TNF-α水平增高,而FMT干预组其水平较EAE模型组减低(均P<0.05)。结果见表3。
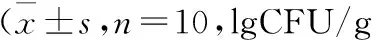
表2 各组小鼠肠道菌群值及B/E值比较 湿粪)
注:CFU:菌落形成单位;与正常对照组比较,aP<0.05;与EAE模型组比较,bP<0.05
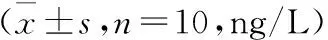
表3 各组小鼠血清及脑组织IL-1β、IL-6、TNF-α水平比较
注:IL-1β:白细胞介素1β;IL-6:白细胞介素6;TNF-α:肿瘤坏死因子α;与正常对照组比较,aP<0.05;与EAE模型组比较,bP<0.05
3 讨论
肠道微生物作为一种新的环境危险因素,在免疫介导的疾病(如MS)中引起了极大关注。研究发现肠道菌群失调、肠功能紊乱在MS发生、发展中发挥一定作用。
人体正常状态下肠道菌群相对平衡且稳定,当环境变化、饮食改变、肠道感染及损伤、情绪变化、药物刺激等相关因素影响下将引起肠道菌群失调,导致有益菌群减少、有害菌群增殖,引起肠道黏膜的损伤,诱发一系列炎症及免疫反应导致免疫功能紊乱,最终参与MS的发病和进展过程。本研究结果显示EAE模型组拟杆菌数量较正常对照组减少,B/E值<1,与既往研究结果基本一致。拟杆菌正常情况下寄居于人和动物的肠道、上呼吸道和生殖道,长期应用广谱抗生素、激素、免疫抑制剂等情况可导致肠道菌群失调或免疫功能紊乱从而引发内源性感染[8]。B/E值反映肠道定植抗力、肠道功能状况,肠道定植抗力对机体免疫力具有重要影响,其水平下降可增加消化道感染、免疫功能紊乱风险[9]。
目前调节肠道菌群的方法有FMT、益生菌、益生元、抗生素等,因FMT具有高安全性和较好疗效故而应用颇为广泛,在自身免疫性肠炎、乙肝、慢性非酒精性肝硬化、自闭症、MS等肠内肠外疾病的治疗中发挥重要作用[10]。FMT能增加肠道有益菌群比例和菌群多样性,维持肠道微环境稳态,并参与菌群与宿主之间的信号交换[11-12]。肠道中的有益菌群如乳杆菌、双歧杆菌可以降低肠道pH值,加强肠道上皮紧密连接,参与肠道生物学屏障、机械屏障的组成,避免肠道致病菌的入侵、生长,减少炎性介质的释放,调节肠道免疫功能,进而减轻肠道炎症反应[13-15]。此外,研究表明FMT可通过改变神经递质、血管活性物质、能量代谢,改善肠道炎症反应,重建肠道菌群对疾病发挥治疗作用[16]。目前有关FMT在MS中的研究及应用较少。Borody等[17]评估了FMT对3例MS患者便秘的疗效发现,FMT可改善患者胃动力,同时对神经系统状况和泌尿功能亦有改善作用。国外一项针对FMT对MS患者干预的前瞻性研究正在进行,最终研究结果尚未公布。本研究结果显示,FMT干预组小鼠B/E值>1,并高于EAE模型组,提示FMT能改善EAE模型小鼠肠道菌群失衡,提高肠道定植抗力。由此可见,FMT在MS研究领域中可能具有一定价值。
生理条件下,肠道微生物群表达的微生物相关分子,能激活免疫细胞表面的识别受体,诱导抗炎介质的分泌,促进肠神经系统的发育和功能完善,有助于维持肠道免疫耐受[18]。同时也能促进机体免疫系统的成熟,通过调节固有免疫和适应性免疫系统来对抗炎症、免疫介导的疾病等[19]。病理状态下,肠道微生物发生组成、结构、数量紊乱,调节上皮细胞之间的连接紧密性降低,增加肠道的通透性,使肠道屏障功能降低。当肠道微生物组紊乱或肠黏膜屏障破坏时,微生物相关分子刺激巨噬细胞和树突细胞产生促炎细胞因子,激活适应性免疫细胞,导致免疫稳态破坏,进而改变血-脑屏障的完整性和功能,触发自身免疫脱髓鞘,并直接与中枢神经系统中的不同类型细胞产生相互作用[20]。细胞因子IL-1β、IL-6、TNF-α是自身免疫性疾病、炎症疾病所共有的促炎因子,参与了EAE、溃疡性结肠炎、系统性红斑狼疮等自身免疫性疾病的病理过程[21-22]。本研究结果显示,FMT可延长EAE小鼠发病潜伏期、达高峰期时间,临床症状减轻,神经功能评分降低,FMT干预组血清、脑组织IL-1β、IL-6、TNF-α表达均低于EAE模型组,提示FMT可改善EAE小鼠肠道菌群紊乱,减轻EAE小鼠炎性反应,进而改善EAE症状,对EAE有一定治疗作用,有望为临床应用FMT治疗MS提供新的实验基础和理论依据。
综上所述,本研究结果显示,FMT可延缓EAE小鼠发病潜伏期和发病达高峰时间,降低神经功能评分,调节肠道菌群,减低炎性因子水平。由于本研究未对FMT的最佳使用时间、剂量频次、实施途径以及其调控机制等进行探讨,因此FMT对MS的确切疗效尚需进一步研究。
