miR-103在急性缺血性脑卒中患者药物疗效及预后评估中的价值
2020-05-21李玮桓张丽刘牧
李玮桓 张丽 刘牧
近年来,急性缺血性脑卒中(acute ischemic stroke,AIS)发病率逐年升高,且其发病有年轻化趋势[1-2]。AIS发病主要由脑血管阻塞所致,造成大脑局灶性神经功能缺损,甚至脑组织死亡[3]。目前,临床多采用营养神经及改善微循环等药物治疗AIS,并取得一定成效。但在AIS治疗疗效评估上仍存在一定不足,如仅通过观察AIS患者症状及体征评价疗效时,难免存在因标准不统一等问题而使疗效的判断结果存在差异,且重复性较差[4]。准确判断AIS患者疗效对于后续治疗及预后均较为重要。既往研究结果显示,微RNA-103(microRNA-103,miR-103)在大脑中动脉梗死大鼠模型血管新生及脑保护方面有一定调节作用[5]。此外,miR-103还被证实可通过靶向调控Piezo1蛋白来调节人脐静脉内皮细胞毛细管的形成及细胞活力[6],亦可通过调节血管内皮细胞损伤促进动脉粥样硬化进展[7]。推测miR-103在AIS患者中亦具有促进血管新生、调节脑细胞活力的功能,可能成为AIS治疗过程中病情及预后的生物标志物。本研究初步探讨了miR-103在AIS患者疗效评价及预后评估中的价值,旨在为AIS的治疗疗效及预后判断提供参考。
1 对象和方法
1.1 对象收集2016年3月至2019年2月华北理工大学附属医院收治的AIS患者106例,其中男72例,女34例,年龄29~76岁,平均(56.27±7.27)岁。患者均符合《中国急性缺血性脑卒中诊治指南2014》[8]诊断标准。纳入标准:(1)经CT/MRI检查排除脑出血;(2)单侧肢体或面部麻木、无力,或出现语言障碍等;(3)首次发病;(4)签署知情同意书。排除标准:(1)患有精神疾病或认知功能障碍性疾病等;(2)肝、肾功能异常;(3)凝血功能异常;(4)住院治疗期间死亡;(5)预后随访失联;(6)合并恶性肿瘤。本研究经华北理工大学附属医院医学伦理委员会批准通过。
1.2 方法
1.2.1临床资料收集:收集患者年龄、性别、体质量指数(body mass index,BMI)、吸烟史、收缩压、舒张压、空腹血糖(fasting plasma glucose,FPG)、总胆固醇(cholesterol total,TC)、三酰甘油(triacylglycerol,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、美国国立卫生研究院卒中量表评分(National Institutes of Health Stroke scale,NIHSS)及发病-治疗时间等资料。
1.2.2血清miR-103水平检测[9]:抽取患者治疗前以及治疗1、3、7、14 d晨起肘静脉血,以3500 r/min离心15 min(离心半径为8 cm),提取上清液,放置于-20℃冰箱待测。采用实时荧光定量PCR法检测血清miR-103水平。取上清液加至总RNA提取试剂盒(日本TaKaRa公司),提取总RNA,并用紫外分光光度计检测其纯度。取2 μg总RNA置于miRNA专用反转录试剂盒(日本TaKaRa公司)中,进行反转录反应,合成cDNA;最后,用SLAN96S型PCR扩增仪(上海宏石公司)进行扩增,反应条件为94℃ 10 min,94℃ 45 s,60℃ 45 s,72℃ 45 s,40个循环。参考GenBank数据库中公布的基因序列。Homo sapiens microRNA miR-103 gene,complete sequence(https://www.ncbi.nlm.nih.gov/nuccore/AF480501.1),序列:5′-AGCAGCATTGTACAGGGCTATGA-3′。Rattus norvegicus microRNA 103a-1 (Mir103a1),microRNA(https://www.ncbi.nlm.nih.gov/nuccore/NR_031861.1),序列:5′-GTACAGGGCTATGAAGGCATTGAGAC-3′。通过比对基因序列,具有同源性。本试验所用引物序列参照文献[5]。miR-103正向:5′-TGATGCTGGTGCTAGAAGT-3′,反向:5′-TCTCCACAGAACAGGCAAG-3′;内参U6正向:5′-CTTCGGCAGCACATATACTAAAAT-3′,反向:5′-CGCTTCACGAATTTGCGTGTCAT-3′。用 2-ΔΔCt表示miR-103水平。
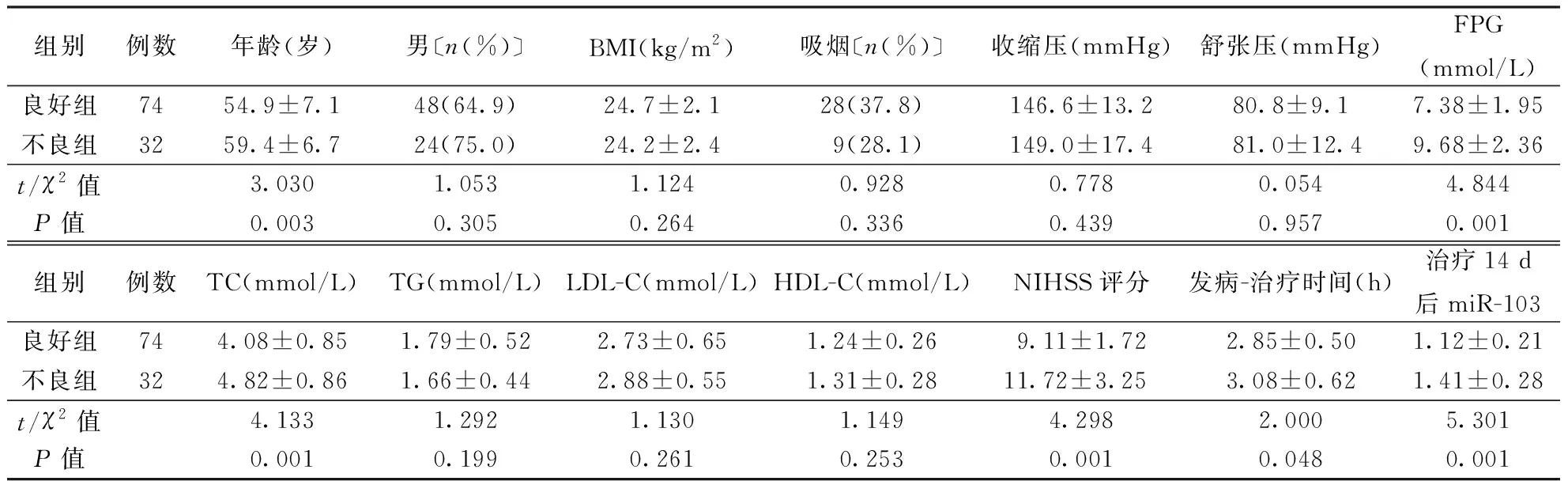
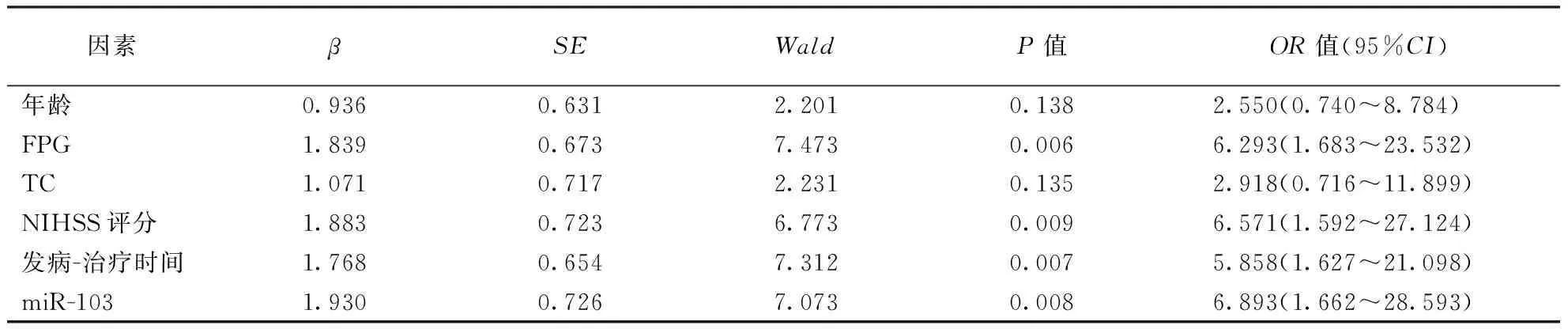
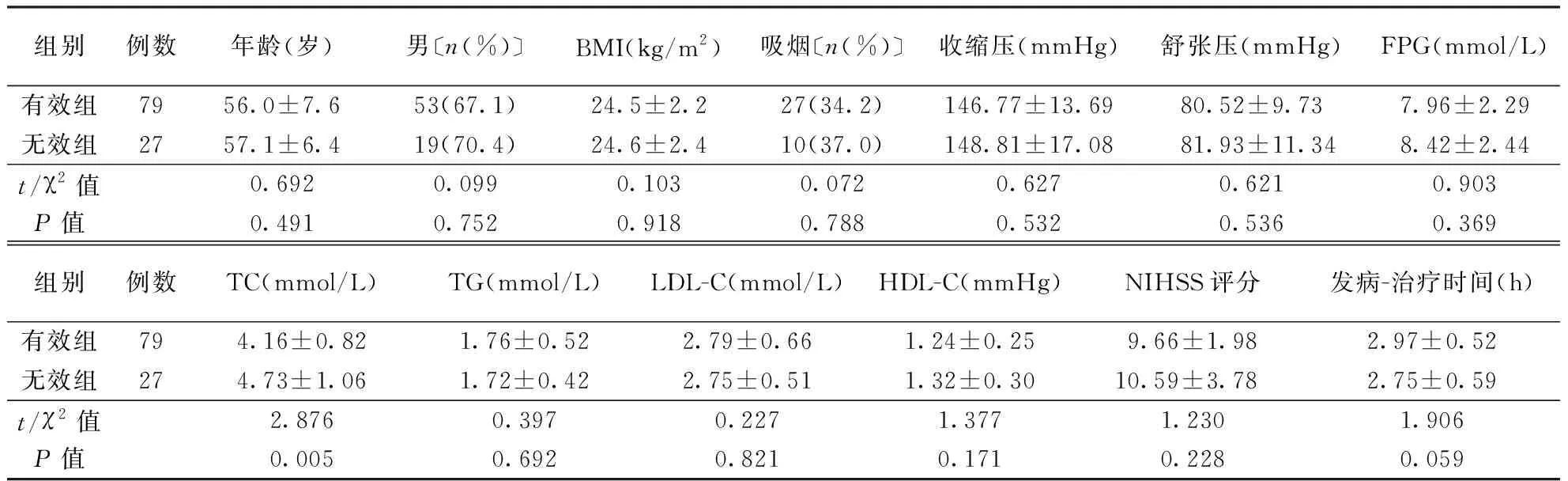
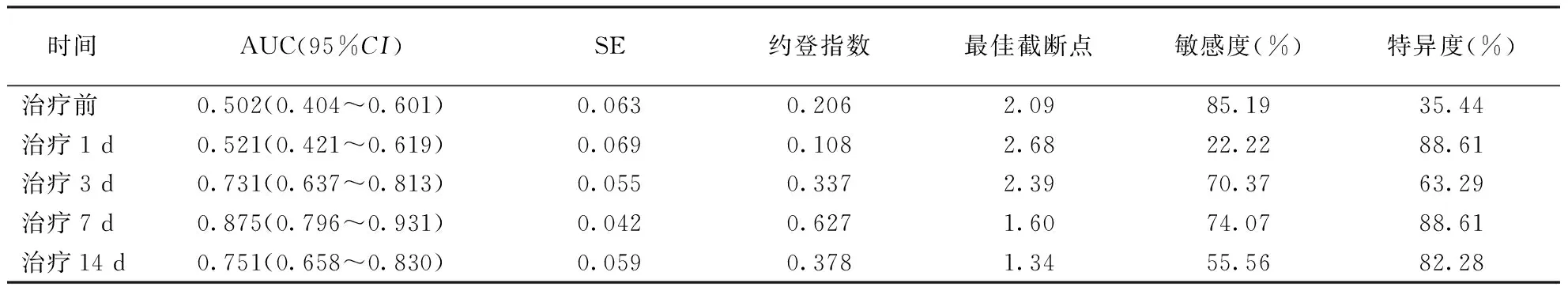
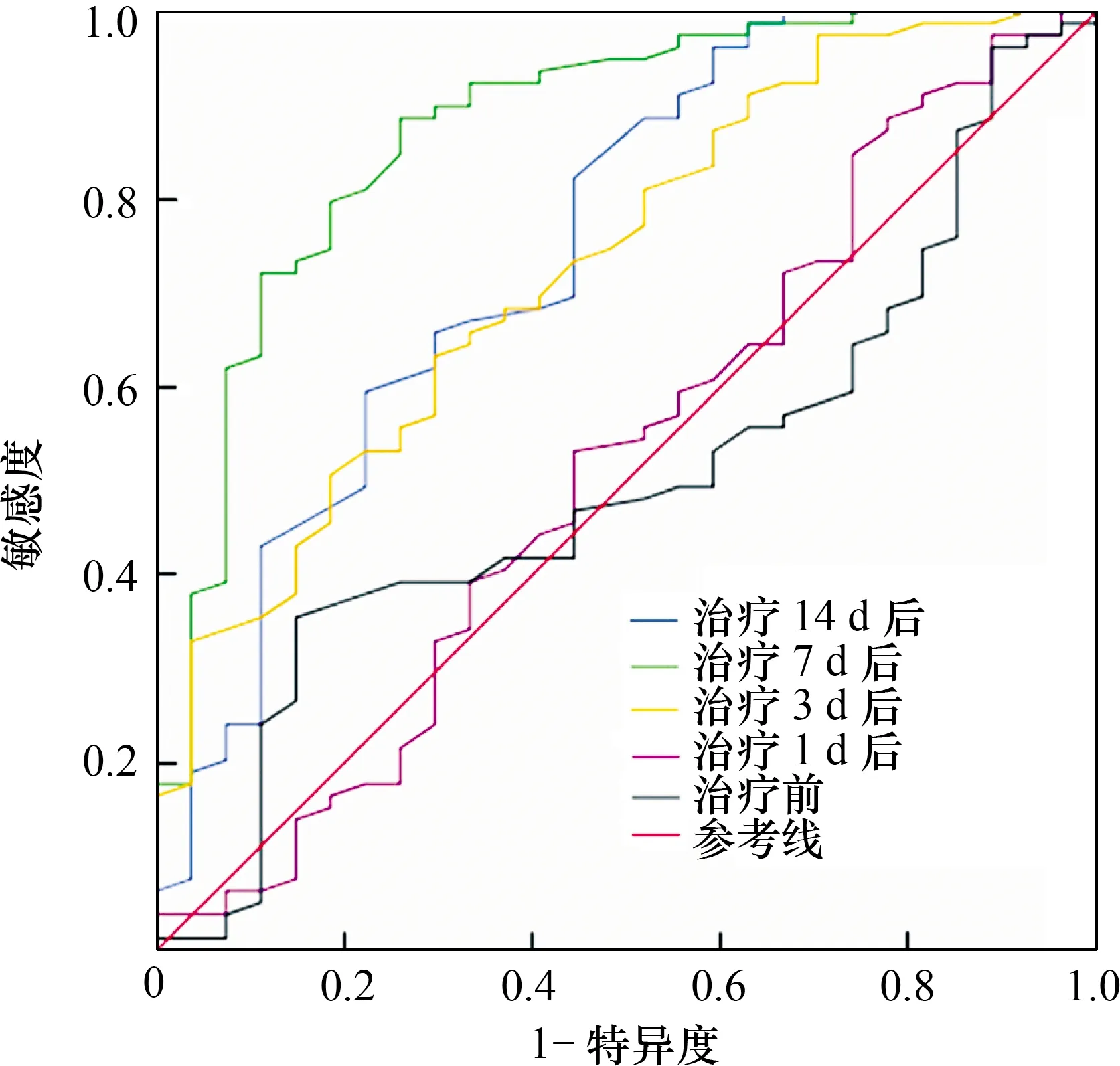
1.2.3治疗及疗效评价[10]:参照《中国急性缺血性脑卒中诊治指南2014》[8]中有关AIS治疗方案进行治疗。给予患者营养神经(依达拉奉)和改善微循环(丁苯酞)治疗,同时根据病情给予如吸氧、抗血小板聚集、降压、降脂及降糖等对症处理。疗效评价[10]:根据AIS患者治疗前和治疗14 d时NIHSS评分变化评价治疗疗效。治愈:NIHSS评分降低>90%;显效:45% 1.2.4随访及预后评价[11]:于患者出院后1周开始随访,每个月随访1次,了解患者出院后恢复情况,随访开始时间为2016-3-30,截至2019-5-28。预后评价:根据AIS患者治疗前后NIHSS评分变化及90 d后改良Rankin量表(mRS)评分评价预后。AIS患者治疗后NIHSS评分降低,且mRS评分≤2分,则预后良好;反之,则预后不良。 1.3 统计学处理采用SPSS23.0软件进行统计分析,服从正态分布的计量资料用均数±标准差表示,两组间比较采用独立样本t检验,多组均数间比较采用重复测量的方差分析,两两比较采用配对样本t检验;计数资料采用卡方检验;采用受试者工作特征(ROC)曲线评价miR-103判断AIS治疗效果的效能;将单因素分析中P≤0.10的因素纳入Logistic回归方程,分析影响AIS患者预后的因素。以P<0.05为差异有统计学意义。 2.1 不同疗效患者临床特征比较经治疗,AIS患者中治愈9例(8.49%),显效49例(46.23%),有效21例(19.81%),无效27例(25.47%)。有效组TC水平低于无效组(P<0.05),而年龄、性别构成、BMI、吸烟史等临床特征比较差异均无统计学意义(P>0.05)。结果见表1。 2.2 两组血清miR-103水平变化两组治疗前后血清miR-103水平变化均存在时间效应(均P<0.05),血清miR-103水平均呈先升高后降低变化(均P<0.05)。有效组治疗3、7、14 d血清miR-103水平均低于无效组(均P<0.01)。结果见表2。此外,有效组患者血清miR-103水平降低幅度(治疗前与治疗14 d时miR-103差值)大于无效组(1.14±0.43比0.88±0.52;t=2.541,P<0.05)。 2.3 miR-103评价AIS治疗效果的价值结果见表3,图1。以AIS患者治疗前后NIHSS评分变化作为评价治疗疗效的金标准。治疗7 d miR-103水平评价AIS疗效的ROC曲线下面积(AUC)为0.875,高于治疗前及治疗1、3、14 d时间点(Z=5.135,P<0.01;Z=4.303,P<0.01;Z=1.968,P<0.05;Z=1.683,P>0.05)。 表1 两组AIS患者临床资料比较 注:AIS:急性缺血性脑卒中,表2~5同。BMI:体重指数,TG:三酰甘油,LDL-C:低密度脂蛋白胆固醇,HDL-C:高密度脂蛋白胆固醇;表4同。FPG:空腹血糖,TC:总胆固醇,NIHSS:美国国立卫生研究院卒中量表评分;表4~5同 表2 两组AIS患者血清miR-103水平比较 注:与组内前一时间点比较,aP<0.05 表3 AIS患者治疗不同时间检测miR-103水平评价疗效的ROC结果 注:AUC:曲线下面积 图1 不同时间点检测miR-103评价AIS患者治疗效果的ROC曲线 2.4 不同预后AIS患者基线资料比较预后良好组74例,不良组32例。预后良好组年龄、FPG、TC、NIHSS评分、治疗14 d后miR-103水平均低于不良组,发病-治疗时间短于不良组(均P<0.05),而性别构成、BMI、吸烟、收缩压等余指标比较差异均无统计学意义(均P>0.05)。具体结果见表4。 2.5 多因素Logistics回归分析影响AIS预后的因素以年龄、FPG、TC、NIHSS评分、发病-治疗时间及miR-103(治疗14 d后miR-103评价AIS患者预后的AUC最大,因此此处为治疗14 d后miR-103)评价AIS患者预后的最佳截断点为界,将其转换为二分类变量。将年龄(≤57岁=0,>57岁=1)、FPG(≤7.36 mmol/L=0,>7.36 mmol/L=1)、TC(≤4.04 mmol/L=0,>4.04 mmol/L=1)、NIHSS评分(≤11分=0,>11分=1)、发病-治疗时间(≤3.27 h=0,>3.27 h=1)及miR-103(≤1.29=0,>1.29=1)作为自变量,将AIS患者预后(预后不良=0,预后良好=1)作为因变量纳入Logistic回归分析,结果显示FPG、NIHSS评分、发病-治疗时间及miR-103水平均与AIS患者预后相关(表5)。 AIS起病较急,多数患者病情均较为严重,常伴有不同严重程度的并发症,如运动、语言等神经功能障碍[12]。MiRNA是一类由20~25个核苷酸组成的非编码RNA,在细胞增殖、分化及凋亡等过程均发挥着重要作用[13]。 本研究发现,不同疗效患者治疗初期血清miR-103水平均有一定程度升高,随治疗时间延长其水平下降,但有效组治疗14 d后血清miR-103水平降低更为明显,推测两组患者治疗前期血清miR-103水平升高可能与急性发病有关,miR-103水平可能与AIS患者治疗疗效存在一定关系。采用ROC曲线分析结果显示,治疗7 d血清miR-103在判断AIS患者疗效的价值最高,其原因可能为治疗7 d后,患者病情趋于稳定,此时血清miR-103水平能够较好地反映治疗期间药物的疗效。进一步分析不同预后AIS患者的miR-103水平,结果显示预后良好组血清miR-103水平低于预后不良组,提示miR-103可能反映AIS患者预后,有望成为AIS预后评估的生物标志物。多因素Logistic回归分析结果显示FPG、NIHSS评分及发病-治疗时间均与AIS患者预后密切相关,这与既往研究结果一致[14-16]。同时,本研究还发现血清miR-103水平也与AIS患者预后密切相关。 表4 不同预后AIS患者临床资料比较 表5 影响AIS患者预后因素的Logistics回归分析结果 miR-103在哺乳动物多数组织中均有表达,在脑组织中其表达水平较高,可调控人大脑皮质中脑源性神经营养因子(BDNF)的表达。BDNF是神经营养因子的一员,在促进脑神经细胞存活、生长及分化中发挥重要作用[17-18]。从幼儿阶段至成年早期过程中,大脑皮质中BDNF水平不断升高,并在成年后维持一定水平,随着大脑皮质的老化,其水平逐渐降低。在上述病理生理过程中,miR-103作为抑制因子可下调大脑皮质中BDNF水平。此外,抑制miR-103表达还可靶向作用于管内皮生长因子进而促进缺血性中风大鼠脑血管生成[5]。近年来,亦有研究发现抑制miR-103表达可阻断张力蛋白同源基因介导的丝裂原活化蛋白激酶信号传导通路,进而抑制动脉粥样硬化所产生的炎症及内质网应激[19]。当缺血性中风发生时,伴随大量炎性细胞因子释放及氧化应激损伤,机体会下调miR-103水平,并可能通过调节BDNF、血管内皮生长因子水平及张力蛋白同源基因介导的丝裂原活化蛋白激酶信号传导通路保护脑神经细胞。AIS治疗药物可降低患者炎性细胞因子及氧化应激相关指标水平,miR-103水平可能与炎性细胞因子及氧化应激相关指标水平存在一定关联,进而反映AIS患者治疗疗效及预后。 综上所述,本文研究结果显示,miR-103与AIS患者治疗疗效及预后均存在一定关系,治疗7 d miR-103水平在评价AIS患者疗效中具有较高价值,而治疗14 d miR-103水平判断预后方面具有较高价值。本研究为单中心研究,样本量较小,关于miR-103与AIS治疗疗效及预后的确切关系尚需深入研究。2 结果
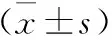
3 讨论