乙型肝炎病毒及其核心抗原对巨噬细胞极化的影响①
2020-05-13伊宏煜张津睿胡海峰陈丽华连建奇
伊宏煜 张津睿 胡海峰 张 野 陈丽华 连建奇
(空军军医大学唐都医院传染病科,西安 710032)
慢性乙型肝炎(chronic hepatitis B,CHB)感染长期以来一直是全球公共卫生安全的重要威胁,尽管随着乙肝疫苗的应用,乙肝病毒(hepatitis B virus,HBV)感染人数逐年下降,但全世界目前仍有大约2.5亿人正在经受着HBV感染所带来的危害[1,2]。乙肝感染的慢性化与机体免疫状态有着非常密切的关系,既往研究证实适应性免疫应答的“耗竭”在HBV慢性化过程中发挥着重要作用,而以巨噬细胞为主的固有免疫应答在乙肝感染慢性化中的作用也成为了研究的热点[3,4]。巨噬细胞是固有免疫系统中重要的一类细胞,它有很强的异质性,在不同刺激条件下,巨噬细胞可向经典活化的M1型巨噬细胞或替代活化的M2型巨噬细胞方向分化[5]。然而,在HBV感染背景下巨噬细胞的极化状态及其免疫应答效应尚缺乏详尽研究。有报道称,HBV感染可以促进巨噬细胞向M2方向分化,并抑制机体免疫反应[6],但另有研究发现,HBV感染后促进巨噬细胞分泌促炎因子从而发挥病毒清除的作用[7,8]。巨噬细胞亚群和自身免疫状态的差异很可能是决定乙肝感染清除或慢性化的重要因素。
研究表明,乙肝相关抗原如表面抗原(hepatitis B surface antigen,HBsAg)和e抗原(hepatitis B e antigen,HBeAg)可抑制巨噬细胞表面模式识别受体(pattern recognition receptors,PRRs)从而削弱巨噬细胞功能,但乙肝核心抗原(hepatitis B core antigen,HBcAg)对巨噬细胞的作用并不明确。研究发现,巨噬细胞表面的Toll样受体2(Toll-like receptor 2,TLR2)能够识别HBcAg并促进巨噬细胞分泌促炎因子[9],而另有研究发现,HBcAg在肝脏枯否细胞(Kupffer cells,KCs)介导的HBV免疫耐受中发挥着重要作用[10]。
本研究分析比较了HBV与HBcAg对PMA诱导的THP-1来源巨噬细胞M1极化相关的CD86、CCR7和M2极化相关的CD206、CD163的表达水平以及THP-1来源巨噬细胞分泌炎症细胞因子水平变化,试图阐明HBcAg对巨噬细胞极化的影响,从而为进一步探索乙肝感染慢性化的免疫学机制提供理论依据。
1 材料与方法
1.1材料 人白血病单核细胞系THP-1、人肝癌细胞系HepG2、HepG2.2.15来自空军军医大学免疫学教研室冻存;佛波酯(PMA)购自Abcam;流式抗体CD86-FITC、CCR7-PE、CD163-FITC、CD206-PE、TLR2-BB515购自BD Biosciences;重组HBcAg购自ProSpec;TNF-α、IL-6、IL-10、TGF-β ELISA试剂盒购自上海西塘生物;Trizol、SYBR Premix Ex Taq试剂盒购自TaKaRa;RT-qPCR所需引物合成自上海生工生物工程。
1.2方法
1.2.1细胞培养 HepG2、HepG2.2.15细胞用含10%胎牛血清、100 U/ml链霉素、100 μg/ml青霉素的DMEM培养基培养,THP-1细胞用含10%胎牛血清、100 U/ml链霉素、100 μg/ml青霉素的RPMI1640培养基培养,细胞均置于37℃,5%CO2培养箱中培养。
1.2.2细胞处理 参照文献[11]的方法,将THP-1细胞以5×105ml-1铺在6孔板,每孔2 ml培养基,同时加入PMA 25 ng/ml刺激THP-1 48 h将其诱导成M0巨噬细胞。预先将贴壁的HepG2、HepG2.2.15以5×105ml-1转移至6孔板大小的Transwell小室上室中,待THP-1分化为巨噬细胞后,将上室移入6孔板,此时上室为HepG2/HepG2.2.15细胞,而下室为THP-1诱导的巨噬细胞,分别共培养24 h,收集下室THP-1细胞提RNA以及流式细胞染色,并收集下室培养上清进行ELISA检测。另取一块6孔板,将THP-1细胞以5×105ml-1铺在6孔板,每孔2 ml培养基,用同样方法诱导巨噬细胞,然后换新鲜培养基,分别加入10 μg/ml重组HBcAg和等体积PBS作对照,培养24 h后收集THP-1提RNA以及进行流式细胞染色,并收集培养上清做ELISA检测。
1.2.3流式细胞仪检测 用细胞刮刀将THP-1细胞收集于离心管,并于管中加入流式抗体(CD86、CD163、CD206、CCR7)孵育,每组用同型对照抗体(iso)做对照,染色结束后,用PBS洗涤2遍,流式固定液固定后用BD流式机进行流式检测,并用FlowJo软件分析结果。
1.2.4RT-qPCR检测THP-1的CD86、CCR7、CD 163、CD206、TNF-α、IL-6、IL-10、TGF-β等基因的表达情况 收集处理后的THP-1细胞,用Trizol裂解并提取RNA,测定其在260 nm处的吸光度以确定RNA浓度,随后用SYBR法在Bio-Rad上进行qPCR反应,每组基因均以GAPDH为内参,采用2-ΔΔCt法分析基因的相对表达情况。
1.2.5ELISA检测培养上清中TNF-α、IL-6、IL-10以及TGF-β水平 收集与HepG2、HepG2.2.15以及重组HBcAg共培养后的THP-1细胞培养上清,1 000 r/min 离心5 min,取上清,按照ELISA试剂盒说明书操作,在450 nm处测定各组OD值,绘制标准曲线,计算各样本数值。

2 结果
2.1HBV对THP-1巨噬细胞表面极化相关分子表达水平的影响 参考文献[11]将CD86、CCR7作为巨噬细胞M1型极化的标志;将CD163、CD206作为巨噬细胞M2型极化的标志。流式结果显示,与HepG2对照组细胞相比,同分泌HBV的HepG2.2.15细胞共培养24 h后,THP-1巨噬细胞表面CD86、CCR7表达水平升高(图1A);而CD163、CD206表达水平没有差异(图1B)。结果提示,HBV促进THP-1巨噬细胞向M1方向极化。
2.2HBcAg对THP-1巨噬细胞表面极化相关分子表达水平的影响 流式结果显示,10 μg/ml HBcAg刺激后,THP-1巨噬细胞表面CD86、CD163、CD206表达较PBS对照组明显升高,CCR7无明显变化(图2)。结果提示,HBcAg主要促进THP-1巨噬细胞向M2方向极化,但同时也促进M1型巨噬细胞CD86分子的表达。
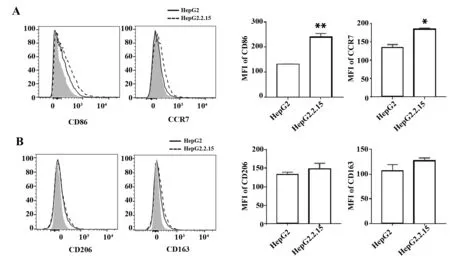
图1 THP-1巨噬细胞分别与HepG2和HepG2.2.15共培养后测定巨噬细胞极化相关表型的变化Fig.1 Changes of phenotypes of macrophages after THP-1 co-cultured with HepG2 and HepG2.2.15 respectivelyNote:Negative/positive gates are classified according to the isotype control.A.Changes of M1 phenotypes of macrophages;B.Changes of M2 phenotypes of macrophages.n=3.*.P<0.05,**.P<0.01.
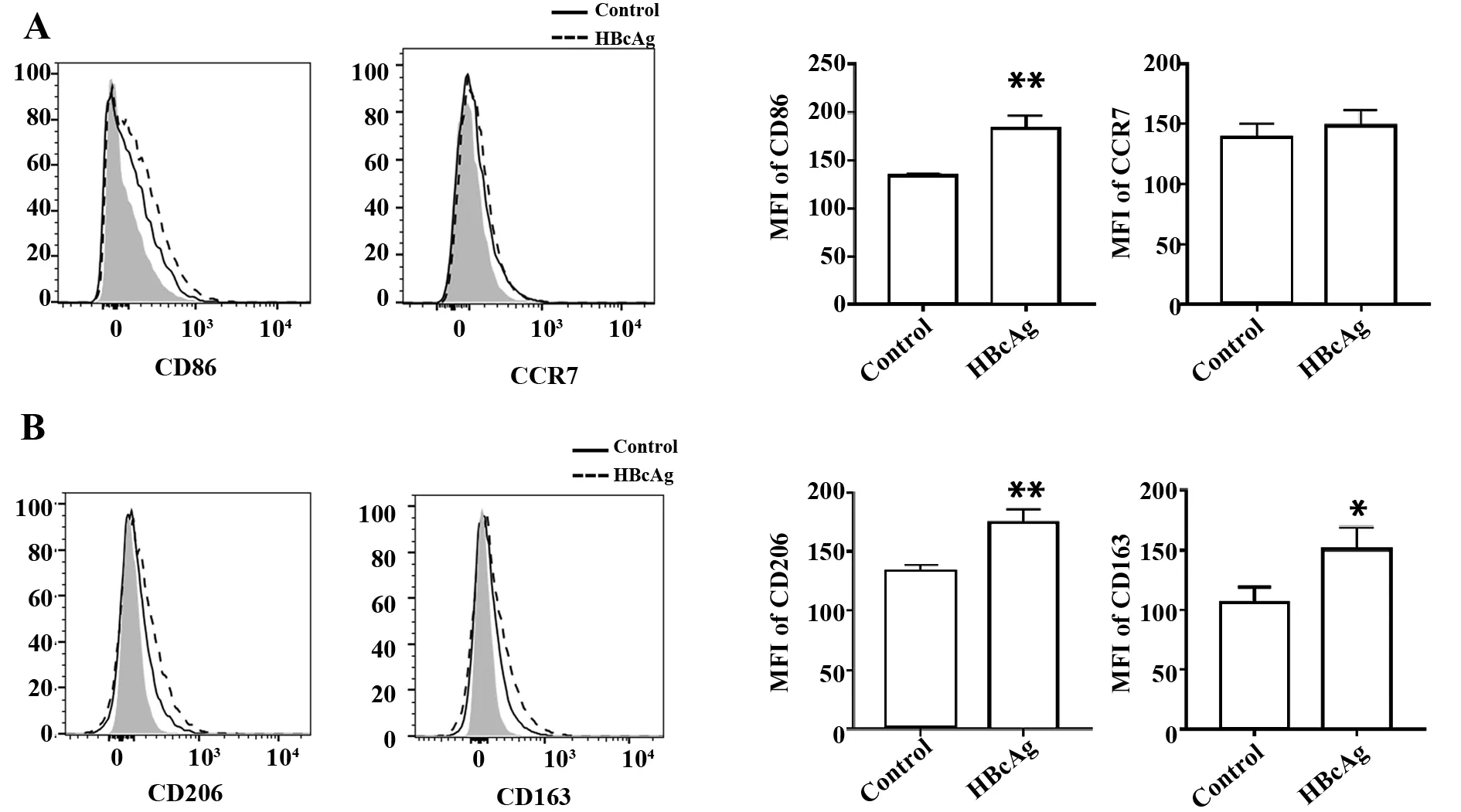
图2 THP-1巨噬细胞与HBcAg共培养后测定巨噬细胞极化相关表型的变化Fig.2 Changes of phenotypes of macrophages after THP-1 co-cultured with HBcAgNote:Negative/positive gates are classified according to isotype control.A.Changes of M1 phenotypes of macrophages;B.Changes of M2 phenotypes of macrophages.n=3.*.P<0.05,**.P<0.01.
2.3HBV以及HBcAg对THP-1巨噬细胞极化相关分子mRNA表达的影响 采用RT-qPCR方法验证HBV以及HBcAg对THP-1巨噬细胞极化相关分子mRNA表达情况。在分别与HepG2细胞和HepG2.2.15细胞共培养24 h后,较HepG2对照组细胞而言,与HepG2.2.15细胞共培养的THP-1巨噬细胞CD86、CCR7的mRNA水平升高;而CD206、CD163的mRNA水平下降(图3A)。 用10 μg/ml HBcAg作用THP-1巨噬细胞24 h后,较PBS对照组而言,THP-1巨噬细胞的 CD86、CCR7的mRNA表达水平无明显变化;而CD206、CD163的mRNA表达水平明显升高(图3B)。
2.4HBV对THP-1巨噬细胞的细胞因子表达水平的影响 在分别与HepG2细胞和HepG2.2.15细胞共培养24 h后,较HepG2对照组细胞而言,与HepG2.2.15细胞共培养的THP-1巨噬细胞TNF-α、IL-6和IL-10的mRNA表达升高,而TGF-β的mRNA表达降低(图4A);而用ELISA测定与HepG 2细胞和HepG2.2.15细胞共培养24 h后的THP-1巨噬细胞培养上清中的细胞因子后发现,TNF-α、IL-6和IL-10的分泌增加,而TGF-β则无统计学差异(图4B)。结果提示,HBV主要促进THP-1巨噬细胞分泌促炎因子。
2.5HBcAg对THP-1巨噬细胞的细胞因子表达水平的影响 在HBcAg共培养环境下,测定THP-1巨噬细胞相关细胞因子的mRNA表达情况。结果发现,与PBS对照组相比,HBcAg处理组能够促进THP-1巨噬细胞中IL-10、TGF-β以及TNF-α的mRNA表达水平(图5A)。收集共培养24 h后THP-1的细胞培养上清进行ELISA检测,发现TGF-β、IL-10和TNF-α的分泌增加,而IL-6无统计学差异(图5B)。结果提示,HBcAg主要促进THP-1巨噬细胞分泌抑炎因子,但同时也使部分促炎因子(如TNF-α)表达升高。
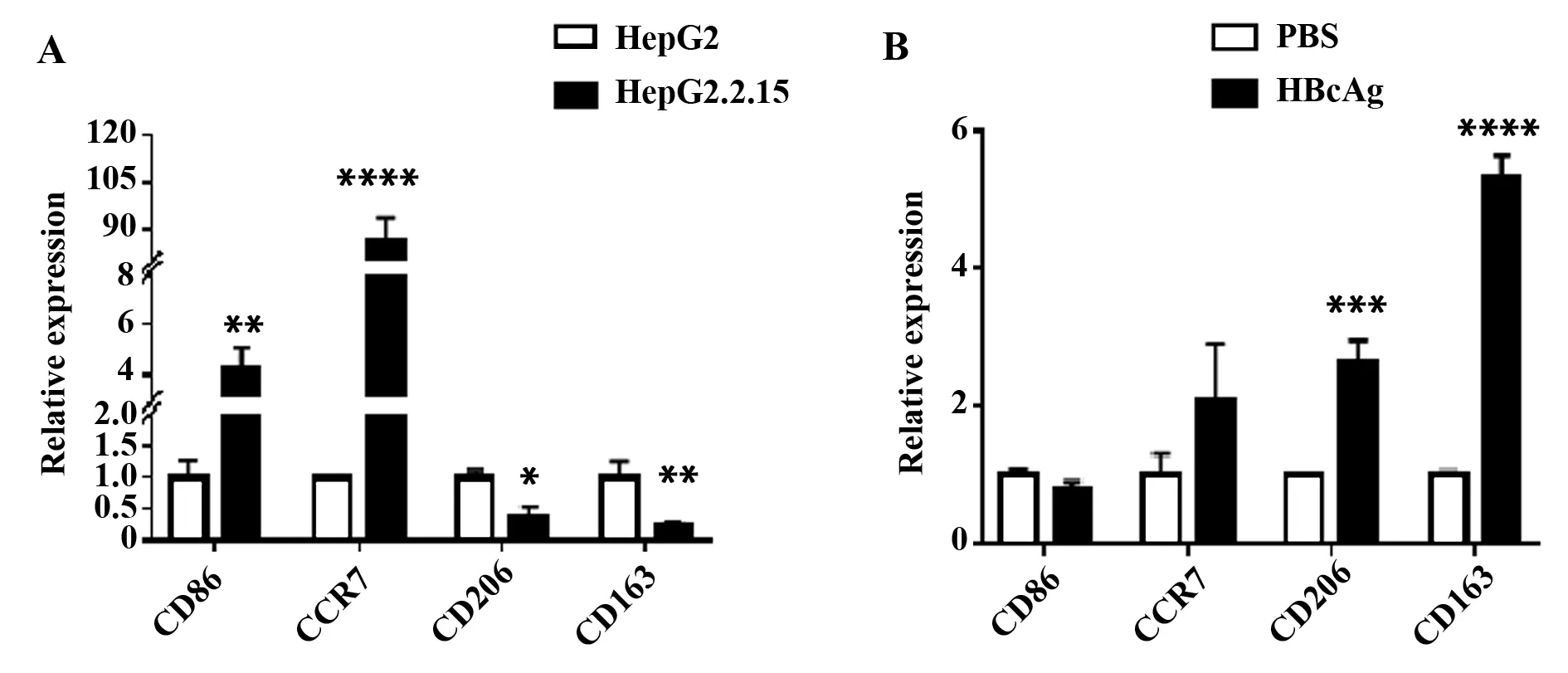
图3 THP-1巨噬细胞分别与HepG2/HepG2.2.15(A)以及HBcAg(B)共培养后巨噬细胞极化相关表型的mRNA表达水平的变化Fig.3 mRNA expression level of phenotypes after THP-1 co-cultured with HepG2/HepG2.2.15(A) and HBcAg(B) respectivelyNote:A.mRNA expression level of M1 or M2 phenotypes when co-cultured with HepG2/HepG2.2.15;B.mRNA expression level of M1 or M2 phenotypes when co-cultured with HBcAg.n=3.*.P<0.05,**.P<0.01,***.P<0.001,****.P<0.000 1.
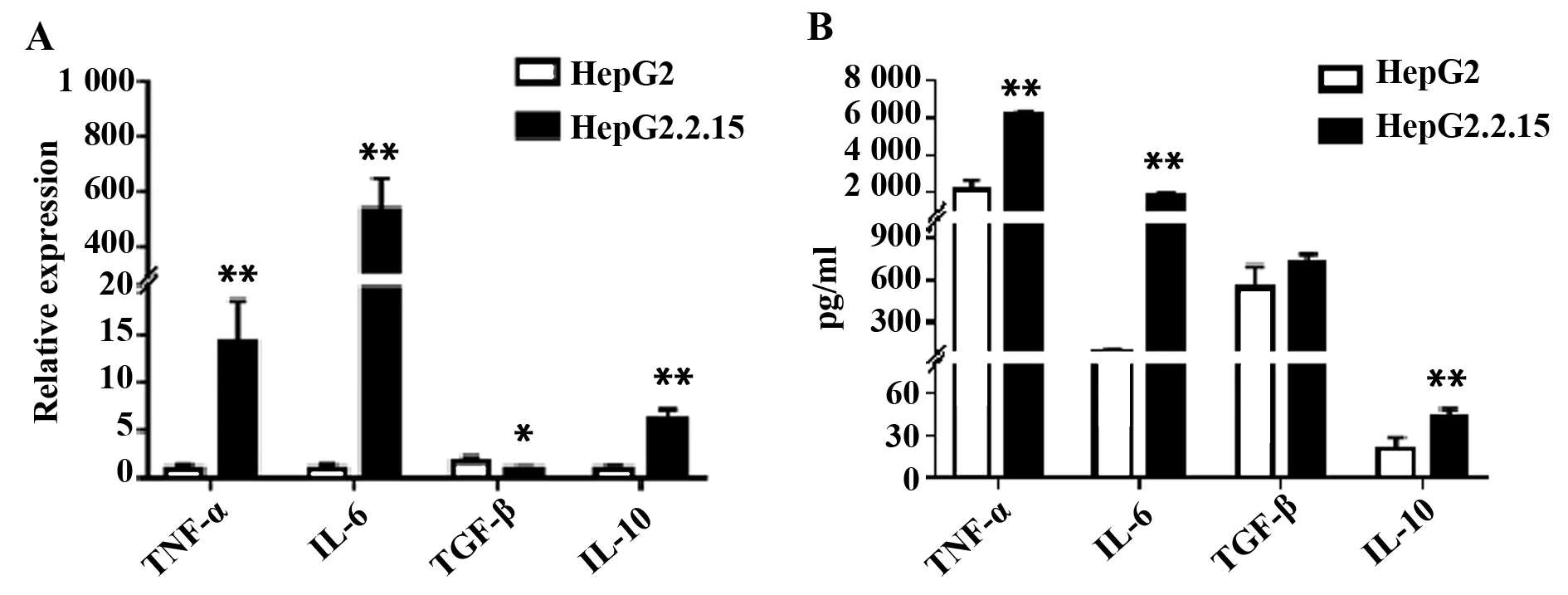
图4 THP-1巨噬细胞分别与HepG2/HepG2.2.15共培养后相关细胞因子的mRNA表达(A)以及细胞因子分泌水平(B)的变化Fig.4 mRNA expression(A) and secretion level(B) of cytokines after THP-1 co-cultured with HepG2/HepG2.2.15 respectivelyNote:A.mRNA expression level of cytokines when co-cultured with HepG2/HepG2.2.15 for 24 h respectively;B.Changes of cytokines secreted by THP-1 co-cultured with HepG2/HepG2.2.15 for 24 h respectively.n=3.*.P<0.05,**.P<0.01.
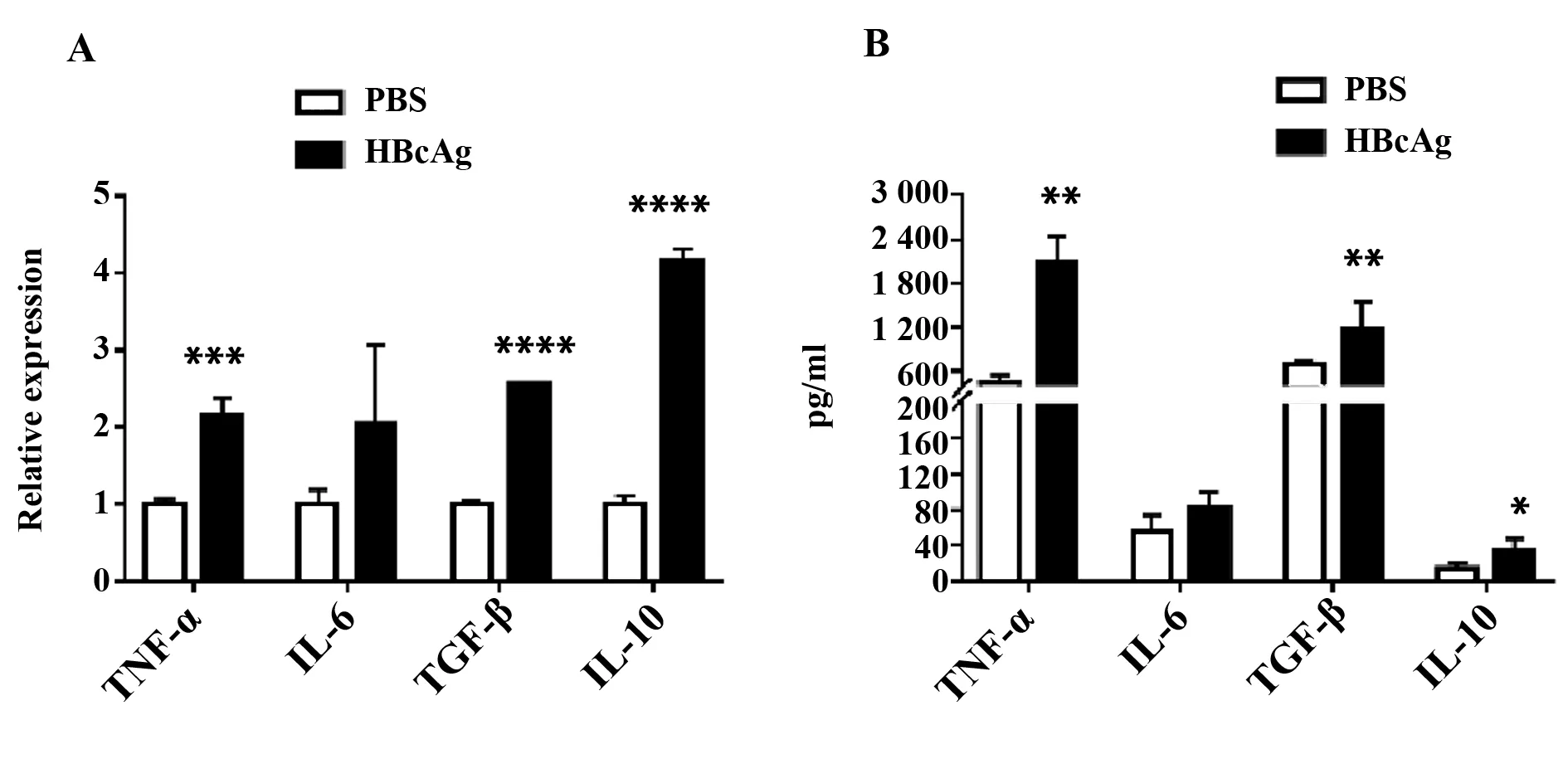
图5 THP-1巨噬细胞与HBcAg共培养后相关细胞因子的mRNA表达(A)以及细胞因子分泌水平(B)的变化Fig.5 mRNA expression(A) and secretion level(B) of cytokines after THP-1 co-cultured with HBcAgNote:A.mRNA expression level of cytokines when co-cultured with HBcAg for 24 h;B.Changes of cytokine secreted by THP-1 co-cultured with HBcAg for 24 h.n=3.*.P<0.05,**.P<0.01,***.P<0.001,****.P<0.0001.
3 讨论
乙肝病毒被认为是一种“隐匿性病毒(stealth virus)”,感染HBV后机体损伤主要是因为病毒所诱发的免疫炎症反应所引起,而非病毒对肝细胞的直接破坏[1,12]。研究发现,机体免疫反应不仅在HBV感染的病理损伤中发挥重要作用,在病程的慢性化过程中也有举足轻重的影响,而巨噬细胞作为重要的固有免疫细胞,在慢性乙肝感染中的作用日益凸显[13]。
由于巨噬细胞存在高度的异质性,它的极化与其功能有着密切关系,然而在慢性乙肝感染中,巨噬细胞的极化状态与功能存在着诸多矛盾观点。一方面,肝脏的枯否细胞主要表达M2型巨噬细胞极化标志,可通过分泌IL-10、TGF-β等细胞因子或上调抑制性受体PD-1的表达介导CD8+T细胞功能耗竭,从而抑制机体抗病毒免疫效应[10,14,15],这种免疫耐受状态能够保护机体免受免疫炎症的损伤,但也促进了乙肝病毒的免疫逃逸。有研究者将HBV耐受的小鼠体内枯否细胞清除后,随着感染时间的延长,处于免疫耐受状态的小鼠抗病毒免疫得以恢复,并逐步清除了 HBV病毒感染[16]。另一方面,有报道称在感染HBV后,外周血中Ly6Chi单核细胞能够迁移至肝脏并分化为促炎的M1型巨噬细胞,释放炎症因子,从而促进HBV清除,发挥重要的抗病毒作用[17,18]。在急性HBV感染中,巨噬细胞主要发挥促炎作用清除病毒,然而,在慢性HBV感染中,为了维持免疫微环境稳态,防止过度的炎症反应对肝脏的损伤,巨噬细胞更趋向于向M2方向极化[6,18]。与既往研究类似,我们的研究结果表明,用含有HBV病毒的细胞培养上清刺激巨噬细胞后,能够促进其向促炎的M1方向极化并释放大量炎症因子,这提示HBV病毒感染能够激活巨噬细胞的抗病毒反应[7]。
为了进一步阐述巨噬细胞在慢性乙肝中的极化状态和功能,越来越多的研究着眼于HBV相关抗原的作用。体外实验表明,HBsAg和HBeAg能够抑制巨噬细胞上TLR所介导的固有免疫反应,削弱巨噬细胞的免疫应答,从而使HBV逃脱免疫清除[4,19]。但目前为止,针对慢性乙肝感染中HBcAg对巨噬细胞的功能和表型的影响尚存在一定争议。HBcAg分子量为21 kD,它包裹HBV的前基因组RNA(pgRNA)并形成HBV的核衣壳蛋白[20],小鼠体内实验证实,HBcAg可通过TLR2通路来促进KCs分泌抑炎因子IL-10并导致T细胞耗竭从而介导乙肝的免疫耐受[10];但近来有团队发现,相较转染了携带有HBV完整基因质粒的小鼠而言,转染HBcAg缺陷的HBV质粒的小鼠,其HBV感染持续时间更长,提示HBcAg的缺失可能限制了免疫系统对HBV的清除[16,21]。本实验发现,HBcAg对巨噬细胞的影响十分复杂。一方面HBcAg刺激能够使得部分巨噬细胞向抗炎的M2方向极化,并分泌抑炎因子(如TGF-β、IL-10等)导致免疫耐受;另一方面也能够促进部分巨噬细胞分泌促炎因子(如TNF-α)导致病毒清除。HBcAg对THP-1巨噬细胞极化和功能的复杂影响,反映了巨噬细胞在HBV慢性感染中的抗炎/促炎的“双刃剑”作用,同时也说明了乙肝慢性感染机制的复杂性。此外,考虑到不同个体表现出的巨噬细胞异质性可能对乙肝病毒及乙肝相关抗原存在不同反应性,并最终导致疾病转归和预后的差异,针对HBcAg对巨噬细胞的极化和功能的影响尚需纳入更多实验进一步验证。
综上所述,通过比较HBV和HBcAg对巨噬细胞表型和功能的影响,我们发现HBV能够使巨噬细胞向M1型方向极化,而HBcAg的作用主要促进巨噬细胞向M2极化,同时也上调CD86和TNF-α等M1型巨噬细胞标志的表达。这种对巨噬细胞极化和功能的差异效应可能在乙肝慢性化过程中发挥重要作用,值得未来进一步的探索研究。
