新化合物TDB通过PI3K/Akt通路抑制人肝癌SMMC-7721细胞增殖并诱导其凋亡①
2020-05-13林春华劳基通杨照新田树红
林春华 肖 敏 劳基通 杨照新 田树红 符 健
(海南医学院,海南省药物临床前药理毒理学研究重点实验室,海口 571199)
我国原发性肝癌约占全球的55%,病死率居恶性肿瘤第二位[1-3]。目前主要的治疗手段包括手术、放疗、化疗等,但由于大多数肝癌早期的诊出率低,往往错过手术时机,而放化疗毒副作用大,临床应用受到诸多限制,肿瘤患者仍然难以获得令人满意的生存收益[4-6]。因此,开发新的低毒、高效的抗肿瘤药物对于肝癌治疗手段的补充或替代都有着非常重要的意义。
苯并噁唑类化合物是一类有着广泛生物活性的苯并杂环化合物,具有显著的抗肿瘤、抗菌、抗炎、杀灭植物病毒功效和配位性能等[7-10]。TDB是一种以苯并噁唑为母体优化合成得到的新化合物,化学名称为5-{[7-(金刚烷胺-1-基)-6-(2-甲氧乙氧基甲氧基)]-萘-2-基}-苯并[d]噁唑-2-胺,已取得国家专利证书,专利号CN201410355850.3[11]。前期实验证实TDB对结肠癌、胃癌、肝癌和肾癌细胞的增殖具有明显的抑制作用[11]。而增殖过度和凋亡受阻正是肿瘤发病的主要机制之一[12]。因此,本研究通过观察TDB对人肝癌SMMC-7721细胞增殖、凋亡和细胞周期的影响,以及对磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/Akt)信号通路的作用,初步探讨TDB抗肝癌的作用机制,为其开发成为抗肝癌新药提供理论依据。
1 材料与方法
1.1材料 TDB(化学结构见图1)由海南道武生物医药技术有限公司合成,纯度>99%;人肝癌SMMC-7721细胞购自中国科学院上海细胞库;RPMI1640培养基购自美国Hycolon公司;胎牛血清购自美国Gibco公司;MTT购自美国Sigma公司;AnnexinV-FITC凋亡试剂盒和碘化丙啶(PI)购自美国BD公司;BCA蛋白定量试剂盒、Bax、Bcl-2抗体购自中国碧云天公司;Caspase-3、Cleaved Caspase-3、Akt、p-Akt(Ser473)、p-Akt(Thr308)等抗体购自美国Cell Signaling Technology 公司;LY294002 PI3K抑制剂购自美国APExBIO公司。
1.2方法
1.2.1细胞培养 将人肝癌SMMC-7721细胞复苏后,采用含10%胎牛血清的RPMI1640培养基培养于37℃、5%CO2培养箱,取对数生长期的细胞用于后续实验。
1.2.2MTT检测细胞增殖 取生长良好的对数生长期SMMC-7721细胞以2×103个/孔的密度接种于96孔板中,贴壁培养24 h。分别采用浓度为5、10、12、15、18、20 μg/ml的TDB溶液分别作用于人肝癌SMMC-7721 细胞,另设不加TDB处理的空白对照组。分别培养 24、48、72 h后将板取出,每孔加入20 μl 5 mg/ml的MTT溶液,继续培养4 h后小心吸弃培养上清液,加入150 μl/孔的DMSO,低速振荡10 min,然后酶标仪测定492 nm波长下各孔的OD值。检测各组细胞在不同时间、不同浓度下的增殖情况,并计算50%抑制浓度(IC50)。

图1 新化合物TDB的化学结构Fig.1 Chemical structure of new compound TDB
1.2.3细胞形态观察 将药物处理48 h后的细胞置于倒置显微镜下观察(×400)。
1.2.4流式细胞仪检测细胞周期和细胞凋亡
1.2.4.1收集细胞 取生长良好的对数生长期的肝癌SMMC-7721细胞以1×105个/孔的密度接种于6孔板中,贴壁培养24 h后,分别加入5、10、15 μg/ml的TDB溶液处理,另设不加TDB处理的空白对照组,继续培养 48 h。用胰酶消化,并用PBS液洗涤2遍收集细胞。
1.2.4.2细胞周期的检测 将收集好的细胞加入预冷的 70%乙醇固定过夜。次日,弃乙醇,PBS洗涤1次后加入PI染液,避光染色30 min,1 h内上机测细胞周期。
1.2.4.3细胞凋亡的检测 将收集好的细胞分别重悬于100 μl缓冲液,再加入AnnexinⅤ-FITC 5 μl和PI染料5 μl,轻轻混匀,避光室温反应15 min后加入300 μl 缓冲液,1 h内上机检测细胞凋亡。
1.2.5Western blot检测Bax、Bcl-2、Cleaved Caspa-se-3、Akt、p-Akt(Ser473)、p-Akt(Thr308)的蛋白表达情况 取生长良好的对数生长期的肝癌SMMC-7721细胞,分别加入不同浓度的TDB处理,另设不加TDB处理的空白对照组。48 h后收集细胞,加入细胞裂解液后冰上裂解30 min,于4℃ 13 000 r/min离心10 min,取上清蛋白溶液,使用BCA试剂盒进行蛋白定量。取制好的总蛋白进行SDS-PAGE电泳,湿转法转移到PVDF膜上。脱脂牛奶封闭后,加入一抗,于4℃孵育过夜。次日TBST洗膜3次,用辣根过氧化物酶标记的二抗室温孵育 2 h。ECL显影,用凝胶成像系统拍照,使用Image J软件进行灰度值分析,以目的蛋白条带的灰度值与内参条带灰度值的比值表示目的蛋白的相对表达量。
1.2.6TDB联合LY294002共处理对SMMC-7721细胞凋亡的影响 以PI3K 抑制剂 LY294002(20 μmol/L)单独以及联用TDB(15 μg/ml)分别作用于肝癌SMMC-7721细胞,与不加TDB处理的空白对照组比较,贴壁培养48 h 后,采用流式细胞仪检测细胞凋亡。

2 结果
2.1TDB对细胞增殖的影响 MTT法检测结果显示(图2),不同浓度TDB作用于人肝癌SMMC-7721细胞24、48、72 h后,能明显抑制细胞增殖,且呈现浓度和时间效应。分别计算不同处理时间24、48、72 h的IC50值为13.35 μg/ml、10.69 μg/ml、4.84 μg/ml。取5、10、15 μg/ml TDB作用于SMMC-7721细胞48 h进行后续实验检测。
2.2TDB对细胞形态学的影响 不同浓度TDB作用于人肝癌SMMC-7721细胞48 h后,在倒置相差显微镜下可见(图3):空白对照组SMMC-7721细胞呈单层、梭形贴壁生长,生长旺盛,细胞间结构紧密,形态规则,边界清楚。TDB处理组,随着浓度的增加,贴壁细胞减少,细胞间隙变大,细胞体积缩小,出现皱缩、变圆、脱落漂浮于培养基现象。
2.3TDB对细胞凋亡的影响 流式细胞仪检测结果显示(图4、表1),TDB可以促进细胞凋亡。5 μg/ml TDB处理组凋亡率与空白对照组比较,差异无统计学意义(P>0.05)。随着TDB浓度的升高,细胞凋亡率呈浓度依赖升高,其中10 μg/ml、15 μg/ml TDB处理组细胞总凋亡率明显高于空白对照组(P<0.01)。
2.4TDB对细胞周期的影响 流式细胞仪检测结果显示(图5、表2),与空白对照组比较,5 μg/ml TDB处理组细胞周期无明显改变(P>0.05),均大部分在G0/G1期。10 μg/ml、15 μg/ml TDB处理组明显阻滞于S期(P<0.01),G0/G1期细胞比例明显下降(P<0.01),呈现浓度依赖性。

图2 TDB对SMMC-7721细胞增殖的影响Fig.2 Effect of TDB on cell proliferation of SMMC-7721

图3 TDB对SMMC-7721细胞形态学的影响Fig.3 Effect of TDB on cell morphology of SMMC-7721
2.5TDB对Bax、Bcl-2、Cleaved Caspase-3蛋白表达的影响 凋亡相关蛋白检测结果显示(图6),与空白对照组比较,10 μg/ml、15 μg/ml TDB处理组的Cleaved Caspase-3、Bax蛋白表达水平随浓度的增大而上调(P<0.01),Bcl-2蛋白表达水平及Bcl-2/Bax比值随浓度的增大而下降(P<0.01)。5 μg/ml TDB处理组Cleaved Caspase-3蛋白及Bax蛋白表达水平均略高于空白对照组,Bcl-2蛋白表达水平略低于空白对照组,以上差异均无统计学意义(P>0.05);该组Bcl-2/Bax比值小于空白对照组(P<0.05),趋势与10 μg/ml、15 μg/ml组一致。以上结果提示,10 μg/ml、15 μg/ml浓度下TDB能明显促进SMMC-7721细胞发生凋亡,与流式细胞仪检测凋亡结果基本一致。

图4 TDB对SMMC-7721细胞凋亡的影响Fig.4 Effect of TDB on cell apoptosis of SMMC-7721Note:Compared with control,**.P<0.01.



GroupsDose(μg/ml)Apoptosis rate(%)Control-10.99±0.84TDB1514.28±1.63TDB21033.50±3.651)TDB31556.23±3.601)
Note:Compared with control,1)P<0.01.
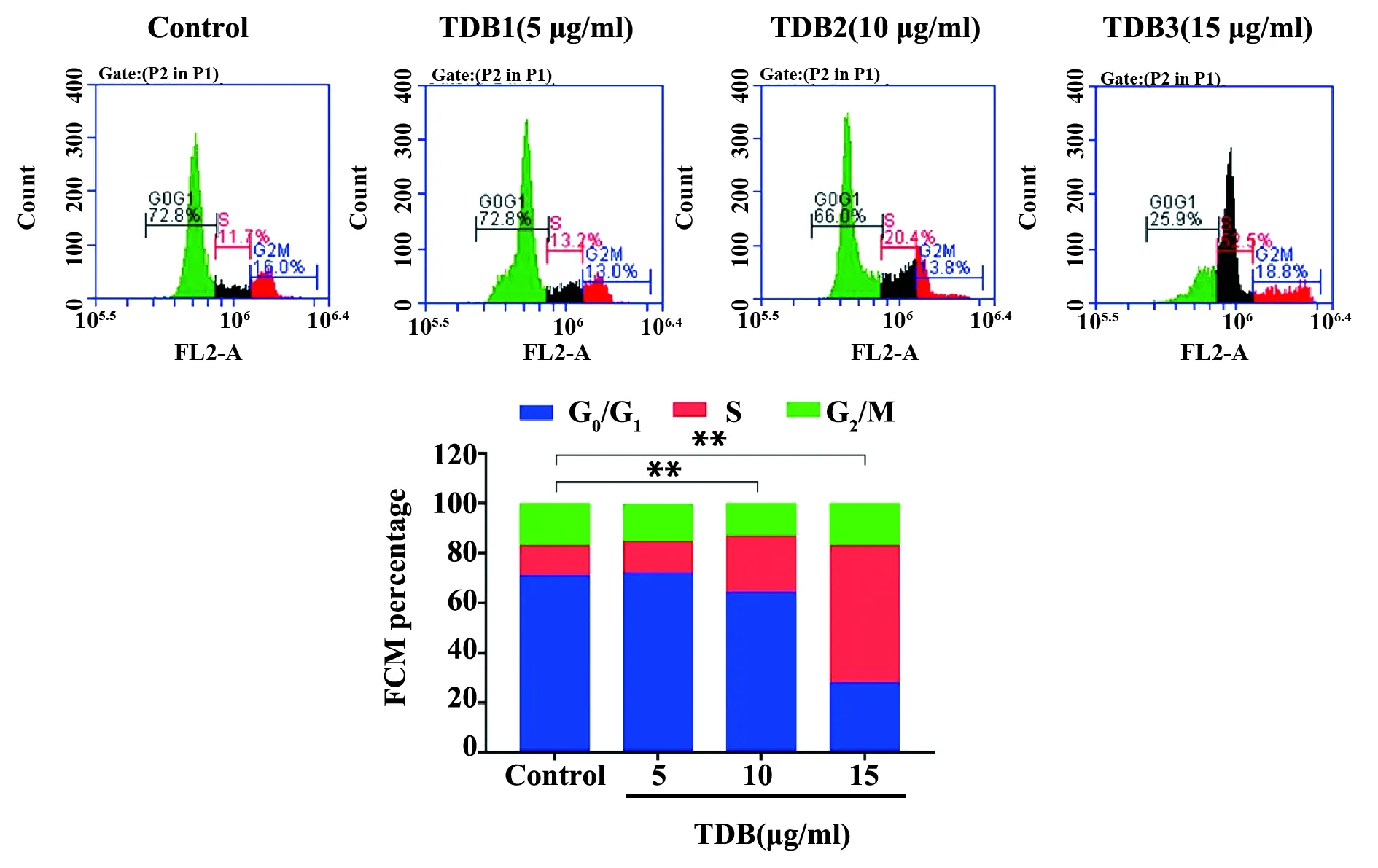
图5 TDB对SMMC-7721细胞周期的影响Fig.5 Effect of TDB on cell cycle of SMMC-7721Note:Compared with control,**.P<0.01.
2.6TDB对Akt、p-Akt(Ser473)、p-Akt(Thr308)



GroupsDose(μg/ml)G0/G1(%)S(%)G2/M(%)Control-70.89±1.7712.11±1.0116.96±1.49TDB1571.76±0.9912.92±0.4215.00±1.86TDB21064.23±1.671)22.64±2.461)13.17±0.90TDB31527.60±2.691)55.32±2.501)17.03±3.49
Note:Compared with control,1)P<0.01.
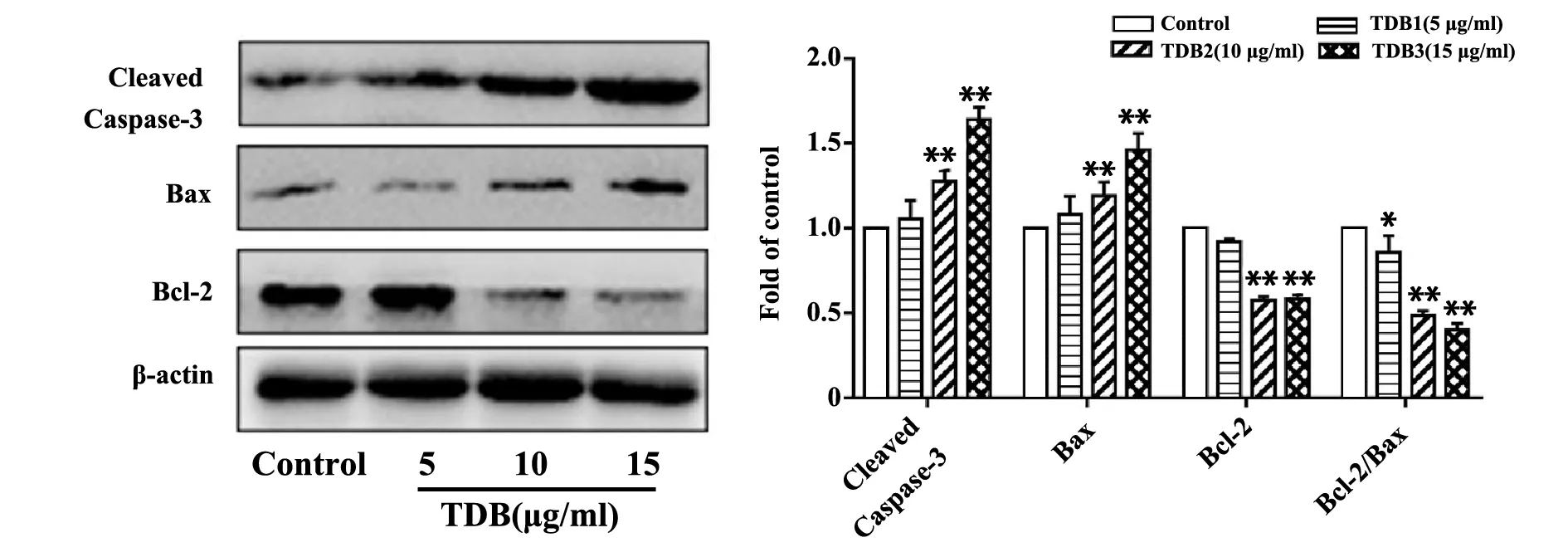
图6 TDB对Bax、Bcl-2、Cleaved Caspase-3蛋白表达的影响Fig.6 Effect of TDB on expression of Bax,Bcl-2 and Cleaved Caspase-3Note:Compared with control,*.P<0.05,**.P<0.01.
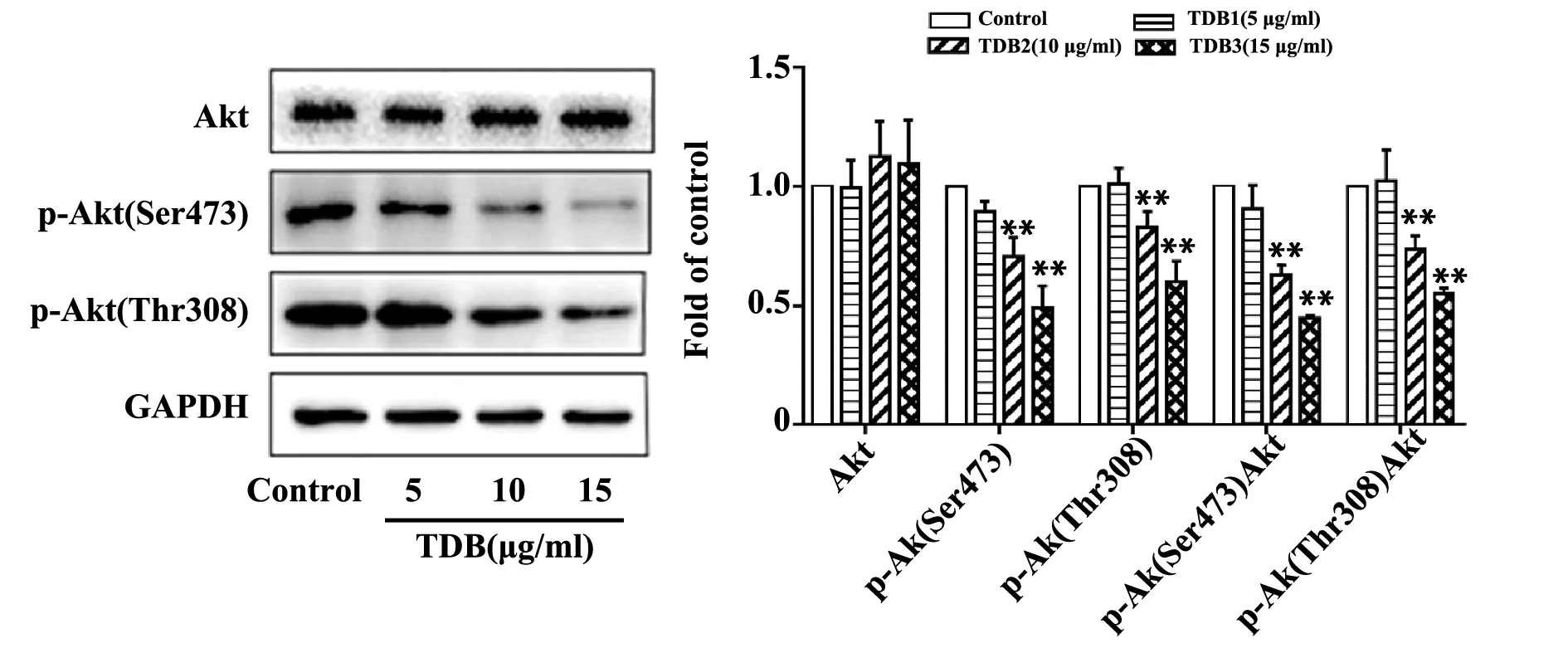
图7 TDB对Akt、p-Akt(Ser473)、p-Akt(Thr308)蛋白表达的影响Fig.7 Effect of TDB on expression of Akt,p-Akt(Ser473),p-Akt(Thr308)Note: Compared with control,**.P<0.01.
蛋白表达的影响 PI3K/Akt信号通路相关蛋白检测结果显示(图7),10 μg/ml、15 μg/ml TDB处理组p-Akt(Ser473)、p-Akt(Thr308)蛋白表达水平均低于空白对照组,随浓度的增大而下调(P<0.01),而Akt总蛋白相对表达量未见明显变化(P>0.05)。同时,计算p-Akt/Akt,与空白对照组比较,10 μg/ml、15 μg/ml TDB处理组随浓度的增大而比值下降(P<0.01)。而5 μg/ml TDB处理组Akt、p-Akt(Ser473)、p-Akt(Thr308)以及p-Akt/Akt比值与空白对照组比较,差异均无统计学意义(P>0.05)。以上结果提示,TDB可能通过抑制SMMC-7721细胞PI3K/Akt信号通路的活化,发挥诱导细胞凋亡的作用。
2.7TDB联合LY294002共处理对SMMC-7721细胞凋亡的影响 流式细胞仪检测结果显示(图8,表3),TDB组、LY294002组以及TDB联合LY294002组的细胞凋亡率均高于空白对照组(P<0.01),TDB联合LY294002组细胞凋亡率高于TDB组、LY294002组(P<0.01)。结果表明,TDB可能通过抑制PI3K/Akt信号通路促进SMMC-7721细胞凋亡。

图8 TDB联合LY294002共处理对SMMC-7721细胞凋亡的影响Fig.8 Effect of TDB combined with LY294002 on cell apoptosis of SMMC-7721Note:Compared with control,**.P<0.01;compared with TDB+LY294002,##.P<0.01.



GroupsDoseApoptosis rate(%)Control-13.75±1.722)TDB15 μg/ml34.18±3.901)2)LY29400220 μmol/L57.23±4.111)2)TDB+LY29400215 μg/ml+20 μmol/L72.76±3.561)
Note:Compared with control,1)P<0.01;compared with TDB+LY294002,2)P<0.01.
3 讨论
原发性肝癌作为一种常见的恶性肿瘤,严重危害着人类的健康。尽管目前有着多种治疗手段,但效果并不理想。因此寻找新的抗肿瘤药物或治疗方案已成为研究者们的共同目标。
本课题组前期研究结果表明,苯并噁唑类新型化合物TDB对人结肠癌HT-29细胞和人肝癌Bel-7402细胞具有良好的抗肿瘤活性,但具体的作用机制尚有待进一步研究。
细胞过度增殖和凋亡受阻是肿瘤发生的重要生物学基础。细胞增殖和凋亡的失衡会造成细胞蓄积,分化不全,最终导致肿瘤的形成[13]。Bcl-2家族属于凋亡相关蛋白,其家族成员Bcl-2、Bax通过调控线粒体膜的通透性来影响细胞色素C的释放和下游 Caspase-3蛋白酶的活化,分别发挥着抗凋亡和促凋亡作用[14-17]。细胞接受凋亡信号后,促凋亡因子Bax和Bak会发生寡聚化,在线粒体表面构成跨线粒体膜的孔,导致膜电位降低,线粒体的通透性增强,凋亡因子释放进而激活下游效应型 Caspases,最终导致细胞凋亡。而过度表达的抗凋亡分子Bcl-2能与Bax形成异源二聚体,阻止线粒体上孔的形成,对抗Bax的促凋亡作用[18]。其中,Caspase-3 作为Caspase 级联反应下游最关键的凋亡执行者,其活化是细胞凋亡开始的标志[19]。
本研究采用不同浓度的TDB处理人肝癌SMMC-7721细胞48 h,探讨了TDB对肝癌细胞增殖、凋亡和细胞周期的影响。实验结果表明,与空白对照组比较,10 μg/ml、15 μg/ml TDB处理组可显著抑制SMMC-7721细胞的增殖,将细胞阻滞于S期,并明显促进细胞凋亡。而5 μg/ml TDB处理组对细胞活性、周期和凋亡均未见明显影响,考虑TDB浓度过低,未达到适宜的作用浓度。与此同时,凋亡相关蛋白的检测结果表明,10 μg/ml、15 μg/ml 处理组明显上调Bax、Cleaved Caspase-3表达水平,下调Bcl-2表达水平。提示TDB能通过下调Bcl-2、上调Bax的表达水平,激活Caspase蛋白酶家族的酶解级联反应,上调了Cleaved Caspase-3表达水平,进而促进了SMMC-7721细胞凋亡。
近年来,随着对肿瘤的深入研究,以肿瘤发生和发展相关的信号通路的关键分子为靶点的肿瘤治疗策略已成为抗肿瘤研究的一个重要方向[20]。PI3K/Akt信号通路在多种肿瘤的发生、存活、发展和转移中发挥重要的调控作用,能促进肿瘤细胞的增殖与存活[21-23]。研究表明,在人类广泛的肿瘤谱中均可观察到PI3K/Akt 信号通路的异常活化[24]。蛋白激酶B(Akt)是PI3K/Akt信号通路中重要的信号分子,具有磷酸激酶活性。被PI3K激活后的Akt[例如:p-Akt(Ser473)、p-Akt(Thr308)]可诱发下游一系列底物,如凋亡相关蛋白Bad、Caspase-9、p53、NF-κB改变[25]。p-Akt能磷酸化Bad的Ser136位点,促使Bad与Bcl-2或Bcl-xl解离,上调抗凋亡蛋白Bcl-2 水平,发挥抗凋亡作用;也可以磷酸化Caspase-9前体的Ser196位点,导致其活性被抑制,下调下游凋亡执行蛋白Caspase-3的表达,抑制细胞凋亡[26,27]。
因此,为进一步探讨TDB促进肝癌SMMC-7721细胞凋亡可能的作用机制,本研究检测了PI3K/Akt信号通路的主要蛋白分子Akt、p-Akt(Ser473)、p-Akt(Thr308)的表达情况。结果提示,10 μg/ml、15 μg/ml TDB处理组的p-Akt(Ser473)、p-Akt(Thr308)蛋白水平明显下调,而Akt总蛋白水平未见明显变化;p-Akt/Akt的比值呈浓度依赖性下降。另外,采用PI3K抑制剂LY294002联合TDB共处理SMMC-7721细胞,细胞凋亡检测结果提示,TDB、LY294002均能明显促进肝癌细胞凋亡,在实验浓度下TDB促凋亡作用比LY294002强,且TDB联合LY294002组促凋亡作用更优于TDB处理组和LY294002处理组。提示TDB可能通过抑制PI3K/Akt信号通路活性,促进SMMC-7721细胞凋亡。
综上所述,本研究表明TDB 具有抑制肝癌SMMC-7721细胞增殖和诱导凋亡作用,其作用机制可能与TDB抑制PI3K/Akt信号通路的活化,下调抗凋亡蛋白Bcl-2水平、上调促凋亡蛋白Bax的表达,激活下游效应型 Caspases促进凋亡有关。对于TDB具体如何作用于PI3K/Akt信号通路,以及是否仍涉及其他信号通路的作用机制,尚需要进一步深入研究。
