骨髓间充质干细胞移植在急性肝衰竭中的应用效果及对IL-10水平的影响研究①
2020-05-13李文武鲍传裕李元明
李文武 鲍传裕 李元明
(海南省人民医院急诊内科,海口 570311)
急性肝衰竭(acute liver failure,ALF)是指肝脏合成、排泄、解毒与生物转化功能发生不同程度障碍,部分患者可由失代偿引起,导致肝脏产生严重的损伤[1]。ALF病因复杂,且发病后短期能引起剧烈的肝功能丧失,引起大量干细胞坏死,严重者将会引起肝昏迷[2]。我国ALF患者主要由病毒性肝炎引起,临床多以传统药物治疗为主,虽然能改善患者症状,但是治疗预后较差[3]。近年来,随着医疗技术的不断发展,干细胞移植开始用于ALF患者中,其具有操作简单、应用灵活、免疫源性弱,再加上治疗费用低等特点,成为肝脏移植后急性肝衰竭有效的治疗方法[4]。ALF的发生、发展是一个多因素过程,常涉及多种炎症因子与细胞因子,其发病机制与肝细胞凋亡存在紧密联系[5]。当机体感染后炎症因子能介导肝细胞凋亡、坏死,再加上自身调节抗炎因子的释放,能抑制免疫完成炎症反应的调控[6,7]。IL-10来源于Th2和部分调节性T细胞,能抑制Th1细胞应答与合成细胞因子,能抑制巨噬细胞的抗原提呈功能与细胞因子的合成,能促进B细胞增殖、分化及抗体产生[8]。目前,临床上对于骨髓间充质干细胞在ALF中的作用机制及对IL-10水平的影响研究较少[9]。因此,本文采用病例随机对照方法开展研究,探讨骨髓间充质干细胞移植在急性肝衰竭中的应用效果及对IL-10水平的影响,现报道如下。
1 材料与方法
1.1材料
1.1.1主要试剂与仪器 全自动生化分析仪(Beckman Coulter公司);水合氯醛(吉林省康达动物药液有限公司);苏木素伊红(HE)染色试剂盒(碧云天生物技术研究所);中性树脂(北京中山生物技术有限公司);生物组织石蜡包埋机(湖北亚光医用电子技术有限公司);兔抗大鼠CD45、CD44、CD29、CD90(美国Abcam公司);流式细胞仪(美国Beeton Dickinson公司);外科手术器械(成都市科汇医疗器械有限责任公司)。
1.1.2实验动物 选择42只SD大鼠作为试验对象,雌雄不限,体质量245~304 g,平均(281.68±8.74)g,动物合格证号:SCXK-2014-0016。所选动物均由动物实验中心提供,SD大鼠常规饲养,自由摄食、饮水,光照12 h,建模前12 h禁食。2只2周龄SD大鼠完成骨髓间充质干细胞的分离制备;40只SD大鼠中随机取10只设为假手术组;剩余30只大鼠制备大鼠急性肝衰竭动物模型。建模成功后随机将大鼠分为模型对照组(n=15)和治疗组(n=15)。
1.2方法
1.2.1骨髓间充质干细胞的分离制备及鉴定 ①细胞的分离与培养:选择2只2周龄的SD大鼠,以断颈方式处死,并放置在75.0%乙醇中连续进行20 min 浸泡,采用紫外灯完成超净台的消毒。上述操作完毕后在超净台上取大鼠股骨、胫骨,去除附着的皮肉后采用PBS进行浸泡、冲洗。取剥离干净的股骨头,将其两端切开,采用5 ml注射器抽取无血清DMEM培养基,将骨髓细胞冲出,用离心管收集,50 μm网筛过滤。离心后去除上层清液,加入DMEM中连续10次吹打,使得细胞分布均匀,再次离心后进行多次洗涤,吹打均匀后加入小培养瓶,加入含10.0%FBS的低糖DMEM培养基中进行培养。37℃下常规放入培养箱中,24 h后首次换液,此后每3 d换液一次,观察细胞形态、数量,待细胞融合80.0%后进行传代培养,取第三代骨髓间充质干细胞备用[10]。②细胞鉴定:常规条件培养下加入低糖DMEM培养基、10.0%胎牛血清进行培养,待细胞融合80.0%以上后加入胰酶进行消化,制成单细胞悬液,采用PBS吹打离心,清洗2次后获得骨髓间充质干细胞,电子显微镜下观察细胞并完成细胞计数,每份细胞样本保证达到106级;向细胞中加入MSCs表面标记的兔抗大鼠CD45、CD44、CD29、CD90,采用流式细胞仪进行分析[11]。
1.2.2急性肝衰竭动物模型建立及处理 ①急性动物模型建立:取参与建模的SD大鼠30只,建模前12 h禁食,6 h禁水。采用浓度为10.0%水合氯醛进行麻醉,剂量0.3 ml/100 g,在麻醉状态下取10.0%D-氨基半乳糖1.4 g/(kg·次)与0.005%脂多糖20 μg/kg经腹腔注射,制备大鼠急性肝衰竭动物模型[12,13]。建模成功后随机将大鼠分为模型对照组(n=15)和治疗组(n=15)。②处理方法:假手术组与模型对照组腹腔注射等体积生理盐水,治疗组经尾静脉注射第三代骨髓间充质干细胞1.4×107细胞/kg。
1.2.3观察指标 ①骨髓间充质干细胞形态与鉴定:观察分离制备的骨髓间充质干细胞形态与干细胞表面标志物CD45、CD44、CD29、CD90表达情况。②肝功能水平:分别在移植前、移植后48 h收集血液样本,1 726 g离心35 min,血清分离后采用全自动生化分析仪完成大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)及白蛋白(ALB)水平[14,15]。③炎症因子水平:取上述分离的血清标本,采用酶联免疫吸附试验完成大鼠TNF-α、IL-6、IL-10水平[16,17]。④肝脏组织切片HE染色:各组大鼠干预后48 h每组取大鼠5只,以断颈法处死,立即开腹切除肝脏组织,剪成体积为0.5 cm3小块,去除多余的血迹、组织,放置在中性福尔马林溶液中,固定。石蜡包埋后制备4 μm切片,完成HE染色,在光镜下观察组织的病理学变化[18]。

2 结果
2.1参与者数量分析 本研究中纳入SD大鼠42只,SD大鼠42只中2只用于骨髓间充质干细胞的分离、制备,剩余40只大鼠中30只参与建模,建模后恢复良好,所有大鼠数据全部进入结果分析,中途无脱落,未见死亡。
2.2骨髓间充质干细胞形态与鉴定 电子显微镜结果显示:分离制备的细胞多呈梭形生长,有粗大的突起,且细胞培养后5 d可见细胞成纤维样生长并向瓶底克隆;传代后细胞呈长梭形、纺锤形,未见细胞分化,见图1。
流式细胞仪结果表明:分离制备的细胞中CD29+占99.5%、CD44+占96.4%、CD90+占96.70%,而CD45+仅为0.60%,说明获得的细胞纯度较高,符合骨髓间充质干细胞特性,见图2。
2.3各组大鼠肝功能水平比较 治疗组与模型对照组干预前各肝功能水平均无统计学意义(P>0.05);治疗组移植后ALT、AST、TBIL水平均低于模型对照组(P<0.05);治疗组移植后ALB水平高于模型对照组(P<0.05),治疗组与模型对照组ALT、AST、TBIL水平均高于假手术组(P<0.05);治疗组与模型对照组ALB水平均低于假手术组(P<0.05),见表1。

图2 骨髓间充质干细胞流式细胞术鉴定Fig.2 Identification results of bone marrow mesenchymal stem cells by flow cytometry
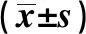
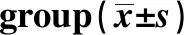

GroupsALT(U/L)AST(U/L)TBIL(μmol/L)ALB(g/L)Therapy groupBefore transplantation346.32±25.981)241.68±21.771)17.67±2.141)16.32±2.121)After transplantation 35.39±3.231)2)3) 70.32±5.731)2)3)1.71±0.961)2)3)36.49±3.581)2)3)Model control groupBefore transplantation349.63±27.641)240.53±21.561)17.32±2.151)16.33±2.141)After transplantation 435.29±34.631)3) 332.14±24.391)3)19.66±2.181)3)13.29±2.111)3)Prosthetic surgery group23.52±2.0934.31±3.69 1.21±0.8445.79±4.52
Note:Compared with the prosthetic surgery group,1)P<0.05;compared with the model control group,2)P<0.05;compared with before transplantation,3)P<0.05.
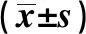
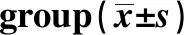
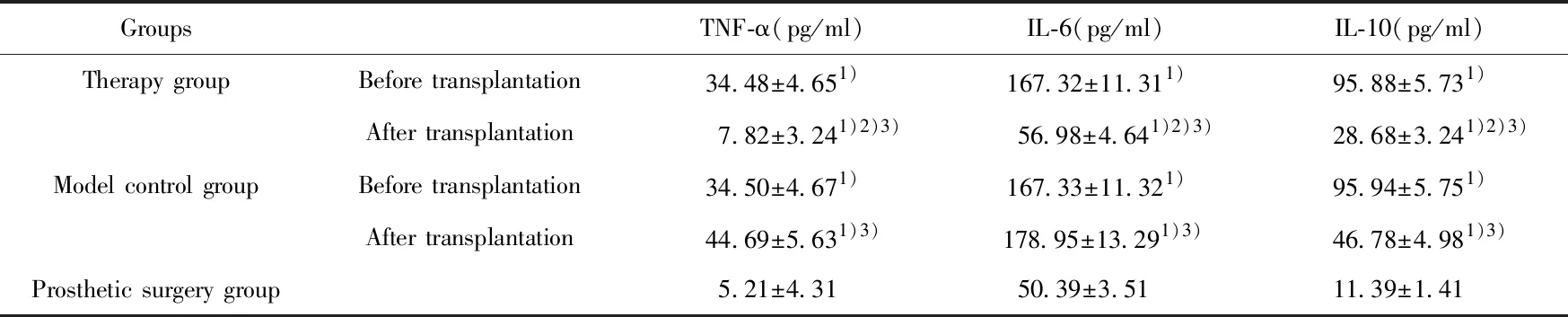
GroupsTNF-α(pg/ml)IL-6(pg/ml)IL-10(pg/ml)Therapy groupBefore transplantation34.48±4.651)167.32±11.311)95.88±5.731)After transplantation7.82±3.241)2)3) 56.98±4.641)2)3)28.68±3.241)2)3)Model control groupBefore transplantation34.50±4.671)167.33±11.321)95.94±5.751)After transplantation44.69±5.631)3)178.95±13.291)3)46.78±4.981)3)Prosthetic surgery group5.21±4.3150.39±3.51 11.39±1.41
Note:Compared with the prosthetic surgery group,1)P<0.05;compared with the model control group,2)P<0.05;compared with before transplantation,3)P<0.05.
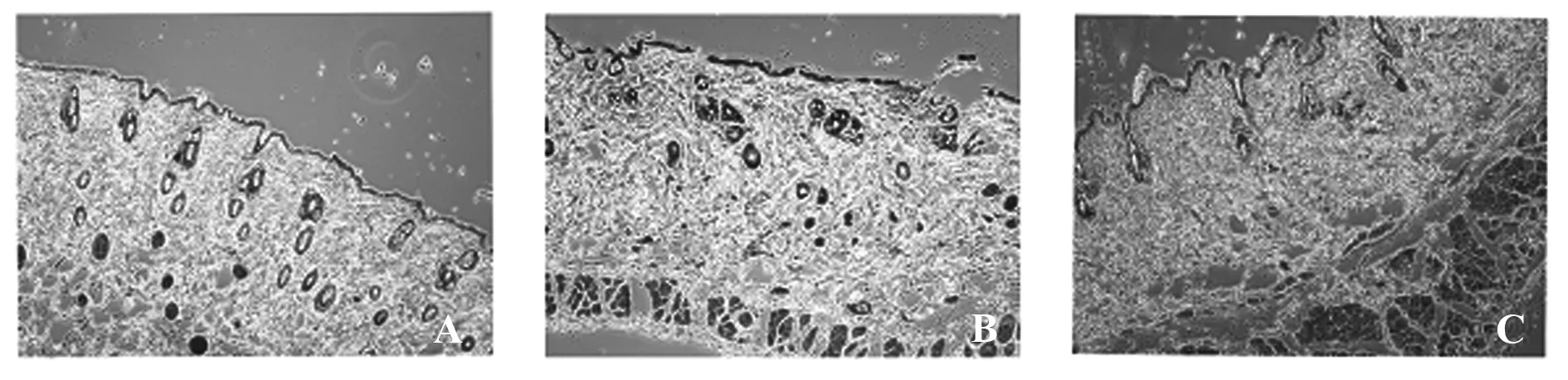
图3 各组SD大鼠的HE染色(×100)Fig.3 HE staining of each group of SD rats(×100)Note: A.The model control group;B.The treatment group;C.The prosthetic surgery group.
2.4各组炎症因子比较 治疗组与模型对照组移植前各炎症因子比较均无统计学意义(P>0.05);治疗组移植后炎症因子TNF-α、IL-6及IL-10水平均低于模型对照组(P<0.05);治疗组与模型对照组移植前、后炎症因子TNF-α、IL-6及IL-10水平均高于假手术组(P<0.05),见表2。
2.5各组大鼠肝组织HE染色 假手术组未参与建模,HE染色下肝细胞分布均匀、饱满,未见炎症反应;假手术组HE染色下肝小叶结构严重破坏,肝细胞膨胀、肿大,可见大量炎症细胞浸润;治疗组HE染色下肝细胞受到破坏,存在部分炎症细胞聚集,肝细胞略微肿大,见图3。
3 讨论
肝衰竭是临床上常见的重症肝病,其病因相对较多,主要是由于肝细胞、肝脏内相关细胞过度死亡引起[19]。临床研究表明:肝脏大面积坏死与肝细胞凋亡、微循环障碍等有关,导致细胞过度凋亡[20]。肝脏移植术是急性肝衰竭的首选治疗方法,能有效改善患者症状,降低临床死亡率,但是该手术治疗时肝脏供体数量较少,且移植后存在明显的免疫排斥反应。近年来,随着医疗技术的不断发展,骨髓间充质干细胞移植开始用于急性肝衰竭研究中[21]。骨髓间充质干细胞是一种源于中胚层的全能干细胞,具有自我更新能力强,定向分化作用,能在特定条件下向骨、软骨、成神经细胞等方向发展,且细胞亦具有较强的免疫调节作用。临床研究表明:骨髓间充质干细胞来源相对较广,如:脐带、脂肪、胎盘、外周血等,取材相对容易、便于自体移植[22]。因此,本研究以SD大鼠作为对象,采用密度梯度离心法+贴壁筛选分离法完成骨髓间充质干细胞的分离与培养及鉴定,电子显微镜结果显示:分离制备的细胞多呈梭形生长,有粗大的突起,且细胞培养后5 d可见细胞成纤维样生长并向瓶底克隆;传代后细胞呈长梭形、纺锤形,未见细胞分化;流式细胞仪结果表明:分离制备的细胞中CD29+占99.5%、CD44+占96.4%、CD90+占96.70%,而CD45+仅为0.60%,说明获得的细胞纯度较高,符合骨髓间充质干细胞特性,从而能为本研究顺利进行奠定基础。
本研究中,以SD大鼠作为对象,完成大鼠ALF动物模型建立,并给予大鼠骨髓间充质干细胞移植,结果表明:治疗组移植后ALT、AST、TBIL水平均低于模型对照组(P<0.05);治疗组移植后ALB水平高于模型对照组(P<0.05),治疗组与模型对照组ALT、AST、TBIL水平均高于假手术组(P<0.05),说明骨髓间充质干细胞移植能改善急性肝衰竭大鼠肝功能水平,利于大鼠恢复。主要是由于骨髓间充质干细胞来源的细胞因子能防止肝细胞坏死,提高急性肝衰竭生存率[23]。骨髓间充质干细胞具有抑制肝细胞凋亡、促进肝细胞增殖的作用,能通过旁分泌作用,分泌多种细胞生长因子,从而能促进肝细胞再生,抑制炎症反应及细胞凋亡[24]。国内学者研究表明:在急性肝衰竭早期阻断其细胞凋亡、促进肝再生有助于提高患者生存率[25]。本研究中,假手术组未参与建模,HE染色下肝细胞分布均匀、饱满,未见炎症反应;假手术组HE染色下肝小叶结构严重破坏,肝细胞膨胀、肿大,可见大量炎症细胞浸润;治疗组HE染色下肝细胞受到破坏,存在部分炎症细胞聚集,肝细胞略微肿大,说明骨髓间充质干细胞移植能减轻肝细胞破坏、受损,降低炎症反应。肝衰竭的发生、发展是一个多因素过程,常伴有炎症因子的共同参与[26]。TNF-α是一种能直接杀死肿瘤细胞而对正常细胞无明显毒性的细胞因子,由激活的巨噬细胞产生,能抑制成骨细胞活性,提高破骨细胞因子表达水平[27]。IL-6是由活化T细胞、成纤维细胞产生的淋巴因子,能使得B细胞前体产生抗体,有助于集落刺激因子,促进原始骨髓细胞的生长、分化,从而提高自然杀伤细胞的裂解作用[28,29]。IL-10几乎存在于所有的淋巴细胞中,但主要源于单核巨噬细胞、T辅助细胞,释放大量免疫介质,抑制单核细胞释放炎症介质。TNF-α、IL-6及IL-10在正常人体中表达水平相对较低或不表达,但是对于急性肝衰竭者,持续的应激反应容易增加TNF-α、IL-6及IL-10水平,并产生瀑布联级反应,加剧疾病发展[30]。本研究中,治疗组移植后炎症因子TNF-α、IL-6及IL-10水平均低于模型对照组(P<0.05),说明骨髓间充质干细胞移植能降低肝衰竭炎症因子水平,从根本上控制疾病发展。综上所述,骨髓间充质干细胞移植用于肝衰竭中能提高肝功能水平,能降低IL-10水平,减轻肝脏局部炎症细胞聚集,从而缓解肝脏组织病理损伤,能为急性肝衰竭治疗提供理论依据。
