中药饮片鹿血晶对巨噬细胞的免疫调节作用研究①
2020-05-13李京蔓潘宇晨夏晓雨侯亚义
李京蔓 潘宇晨 夏晓雨 李 丹 窦 环 侯亚义
(南京大学医学院,南京 210093)
自古以来,我们中国人就重视养生保健。宋元时期,以动物乳汁、血液为代表的液体补品开始流行,贵族间盛行喝鹿血,“养巨鹿日刺其血和酒以饮”。清朝皇帝喝鹿血,将其作为壮阳、养生补品来服用。鹿血晶系鹿血经炮制加工干燥后制得的产品。鹿血泛指鹿科动物梅花鹿和马鹿的血液,其主要化学成分包括蛋白质、氨基酸、酶类、维生素、脂肪酸及激素类等物质[1,2]。近年来的研究表明,鹿制品如鹿血、鹿角盘等具有延缓衰老、抗疲劳、增强免疫力、抗氧化、消炎镇静等功能[3,4]。
固有免疫系统是机体低于外界病原体的有力屏障[5],巨噬细胞作为一种重要的固有免疫细胞,能够通过释放炎症因子,杀伤外来病原体并将其吞噬,保护机体免遭侵害[6]。对巨噬细胞的免疫功能进行适当调节能够帮助机体抵抗疾病[7]。本文旨在研究鹿血晶对小鼠巨噬细胞系RAW 264.7的免疫调节作用及其可能机制,为鹿血晶作为保健中药材的应用提供科学依据。
1 材料与方法
1.1材料 RAW 264.7细胞系购自中国科学院典型培养物保藏委员会细胞库;鹿血晶冻干粉来自苏州红冠庄国药股份有限公司(批号:S1810012);DMEM高糖培养基、青霉素、链霉素及 FBS 均购自美国 Gibco;CCK-8 试剂购自日本 DOJINDO;一氧化氮检测试剂盒购自上海碧云天;IL-1β ELISA检测试剂盒购自北京达科为生物技术有限公司;IL-6 ELISA检测试剂盒购自南京福麦斯生物技术有限公司;磷酸化IKK-α/β及磷酸化P65抗体均购自美国 CST;GAPDH抗体购自美国 Proteintech;FITC荧光素购自上海阿拉丁生化科技股份有限公司;反转录试剂购自南京诺唯赞生物科技有限公司。
1.2方法
1.2.1细胞培养 在生物安全柜中,将RAW 264.7细胞接种于直径60 mm细胞培养皿中,加入3 ml含10%FBS、1%双抗的DMEM培养基,置于37℃、5%CO2培养箱中培养,贴壁生长。每1~2 d换一次液,细胞数大于1×107ml-1时按1∶5或1∶6传代一次,使细胞保持圆整、透亮的形态,取对数生长期细胞用于实验。
1.2.2鹿血晶水溶液的制备 向20 ml去离子水中加入1 g鹿血晶冻干粉末,充分混匀后于37℃水浴加热至无明显颗粒状物质存在。再次混匀后用200目尼龙滤布过滤掉不溶物,滤液在超净台内用0.22 μm孔径的滤器过滤,得到无菌鹿血晶水溶液。
1.2.3CCK-8实验 使用终浓度为0、31.25、62.5、125、250、500、1 000、2 000、4 000 μg/ml的鹿血晶水溶液处理RAW 264.7细胞,1 h后加入LPS(100 ng/ml)刺激,置于37℃、5%CO2培养箱中培养。24 h后,弃去上清,每孔加入10 μl CCK-8试剂和90 μl DMEM培养基,置于37℃、5%CO2培养箱中培养,至颜色变为橙黄色。放入酶标仪,于450 nm波长下测定吸光度A450,细胞活力计算方式为:细胞活力(%)=[A450(加药)-A450(空白)]/[A450(空白对照)-A450(空白)]×100%。
1.2.4qRT-PCR实验 将RAW 264.7细胞接种于24孔细胞培养板中,贴壁生长至汇合度为50%~60%,加入鹿血晶水溶液使其终浓度为250、500、1 000 μg/ml,培养1 h后,加入LPS使终浓度为100 ng/ml,培养24 h后,Trizol法提取总RNA。RNA用适量DEPC水溶解,Nanodrop测定RNA浓度和纯度,依据反转录试剂说明书将其反转录成cDNA,程序为50℃ 15 min、85℃ 5 s、4℃ ∞。
qRT-PCR实验操作如下:(1)10 μl qRT-PCR反应体系:5 μl cDNA、4 μl PowerUp SYBR Green Master Mix(Thermo Fisher Scientific)、1 μl 引物(正义链0.5 μl、反义链0.5 μl)。(2)qRT-PCR反应程序(采用三步法):①预变性:55℃ 2 min、95℃ 10 min;②循环40次,72℃时收集信号:95℃ 30 s、60℃ 30 s、72℃ 30 s;③熔解曲线:95℃ 15 s、60℃ 30 s、95℃ 15 s;采用Applied BioSystems 7300 Sequence Detection System 进行检测并分析,以GAPDH为内参,根据各个基因的Ct值结果,以2-ΔΔCt法计算,得到目的基因的相对表达量。
1.2.5一氧化氮检测和ELISA实验 将RAW 264.7细胞接种于24孔细胞培养板中,贴壁生长至汇合度为50%~60%,加入鹿血晶水溶液使其终浓度为250、500、1 000 μg/ml,培养1 h后,加入LPS使终浓度为100 ng/ml。培养24 h后,收集培养基,7 500 g离心5 min,小心吸取上清到新EP管中,依照试剂盒说明书对培养基上清中的一氧化氮、IL-1β和IL-6含量进行检测。
1.2.6Western blot实验 将RAW 264.7细胞接种于6孔细胞培养板中,贴壁生长至汇合度为80%~90%,加入鹿血晶水溶液使其终浓度为250、500、1 000 μg/ml,培养1 h后,加入LPS使终浓度为100 ng/ml,培养30 min后,提取总蛋白。上样20 μl于10%聚丙烯酰胺凝胶(SDS-PAGE),以 80 V恒压电泳,待溴酚蓝指示剂跑出浓缩胶后加压至120 V,直到溴酚蓝泳出分离胶下缘。350 mA恒流冰浴转移2 h。将转膜后的 PVDF 膜放入5%BSA 封闭液中低速摇床封闭2 h。用洗膜缓冲液(tris buffered saline tween,TBST)高速摇床洗膜15 min,连续4次。制作孵育袋,加入5%BSA稀释的一抗液,4℃低速摇床孵一抗过夜。用TBST 洗膜4次后,浸泡于5%BSA稀释的二抗液,低速摇床孵二抗2 h。用TBST洗膜4次后,曝光仪曝光、拍照、软件分析图像。
1.2.7大肠杆菌吞噬实验 将RAW 264.7细胞接种于24孔细胞培养板中,贴壁生长至汇合度为70%~80%,加入鹿血晶水溶液使其终浓度为500 μg/ml,培养1 h后,每孔加入5×107个FITC标记的大肠杆菌,共同培育6 h。收集细胞进行流式细胞术检测,用FITC的平均荧光强度(MFI)表示吞菌能力的大小,或固定、制片,于荧光共聚焦显微镜下观察、拍照。

2 结果
2.1鹿血晶提高炎症状态下RAW 264.7细胞的细胞活力 使用不同浓度的鹿血晶处理RAW 264.7细胞,而后加入LPS(100 ng/ml)进行刺激,24 h后通过CCK-8法进行检测,结果如图1所示。与LPS组相比,鹿血晶不会损伤炎症状态下巨噬细胞的细胞活力,且125~4 000 μg/ml浓度范围内的鹿血晶对其活力均有明显提高。结果表明,一定浓度的鹿血晶能够提高LPS刺激下的RAW 264.7细胞活力。
2.2鹿血晶抑制炎症状态下RAW 264.7细胞炎症因子mRNA的表达 通过qRT-PCR实验检测鹿血晶对LPS刺激下RAW 264.7细胞炎症因子iNOS、IL-1β、IL-6的mRNA表达水平的影响,结果如图2所示。与LPS组相比,低(250 μg/ml)、中(500 μg/ml)、高(1 000 μg/ml)三个浓度的鹿血晶水溶液均能够明显抑制LPS诱导的RAW 264.7细胞中iNOS、IL-1β、IL-6表达水平的上调,且呈剂量依赖性。结果表明,鹿血晶能够抑制LPS刺激下巨噬细胞炎症因子的表达。
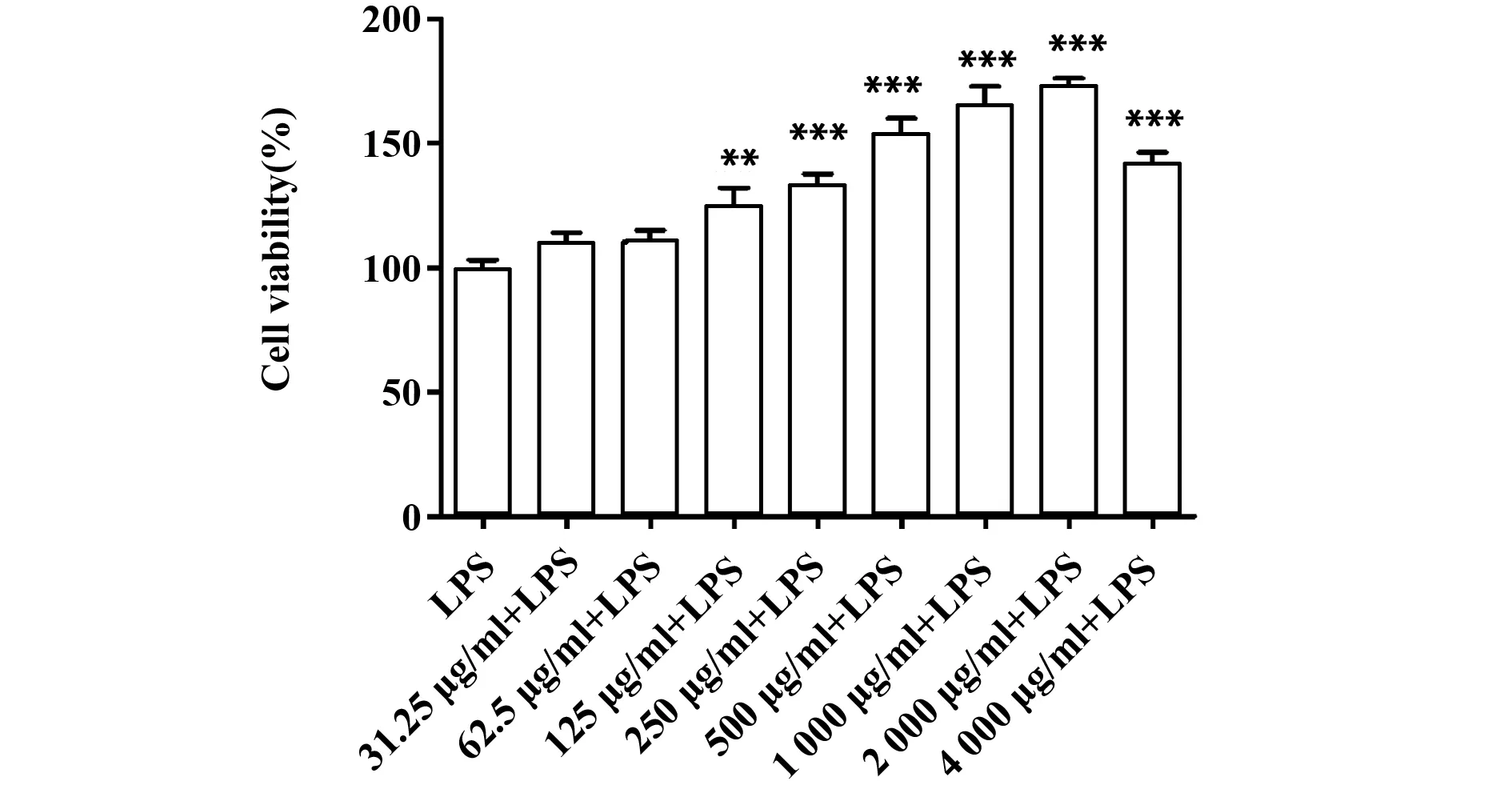
图1 鹿血晶对RAW 264.7细胞活力的影响Fig.1 Effects of deer blood crystal on viability of RAW 264.7 cellsNote: **.P<0.01,***.P<0.001.

图2 鹿血晶对RAW 264.7细胞内炎症因子表达的影响Fig.2 Effects of deer blood crystal on inflammatory cytokines expression of RAW 264.7 cellsNote: *.P<0.05,**.P<0.01,***.P<0.001.
2.3鹿血晶抑制炎症状态下RAW 264.7细胞炎症因子的释放 收集鹿血晶和LPS共同处理后RAW 264.7细胞的培养基上清,通过ELISA实验检测鹿血晶对RAW 264.7细胞炎症因子一氧化氮(NO)、IL-1β、IL-6释放量的影响,结果如图3所示。与LPS相比,低(250 μg/ml)、中(500 μg/ml)、高(1 000 μg/ml)三个浓度的鹿血晶水溶液均能够明显抑制RAW 264.7细胞在LPS诱导下NO和IL-6的释放,且呈剂量依赖性,但对IL-1β无明显作用。结果表明,鹿血晶能够抑制LPS刺激下巨噬细胞炎症因子的释放。
2.4鹿血晶抑制炎症状态下RAW 264.7细胞NF-κB信号通路的活化 通过Western blot实验检测鹿血晶对炎症状态下RAW 264.7细胞内NF-κB信号通路蛋白表达的影响,结果如图4所示。与LPS组相比,鹿血晶能够明显降低炎症状态下RAW 264.7细胞内磷酸化IKK-α/β和磷酸化P65蛋白的表达,说明鹿血晶能够抑制LPS引起的NF-κB信号通路的活化。结果表明,鹿血晶通过NF-κB信号通路影响巨噬细胞炎症因子的表达与释放。

图3 鹿血晶对RAW 264.7细胞内炎症因子释放的影响Fig.3 Effects of deer blood crystal on inflammatory cytokines release of RAW 264.7 cellsNote: **.P<0.01,***.P<0.001.

图4 鹿血晶对RAW 264.7细胞内NF-κB相关蛋白表达的影响Fig.4 Effects of deer blood crystal on NF-κB-related proteins expression in RAW 264.7 cellsNote: *.P<0.05,**.P<0.01,***.P<0.001.
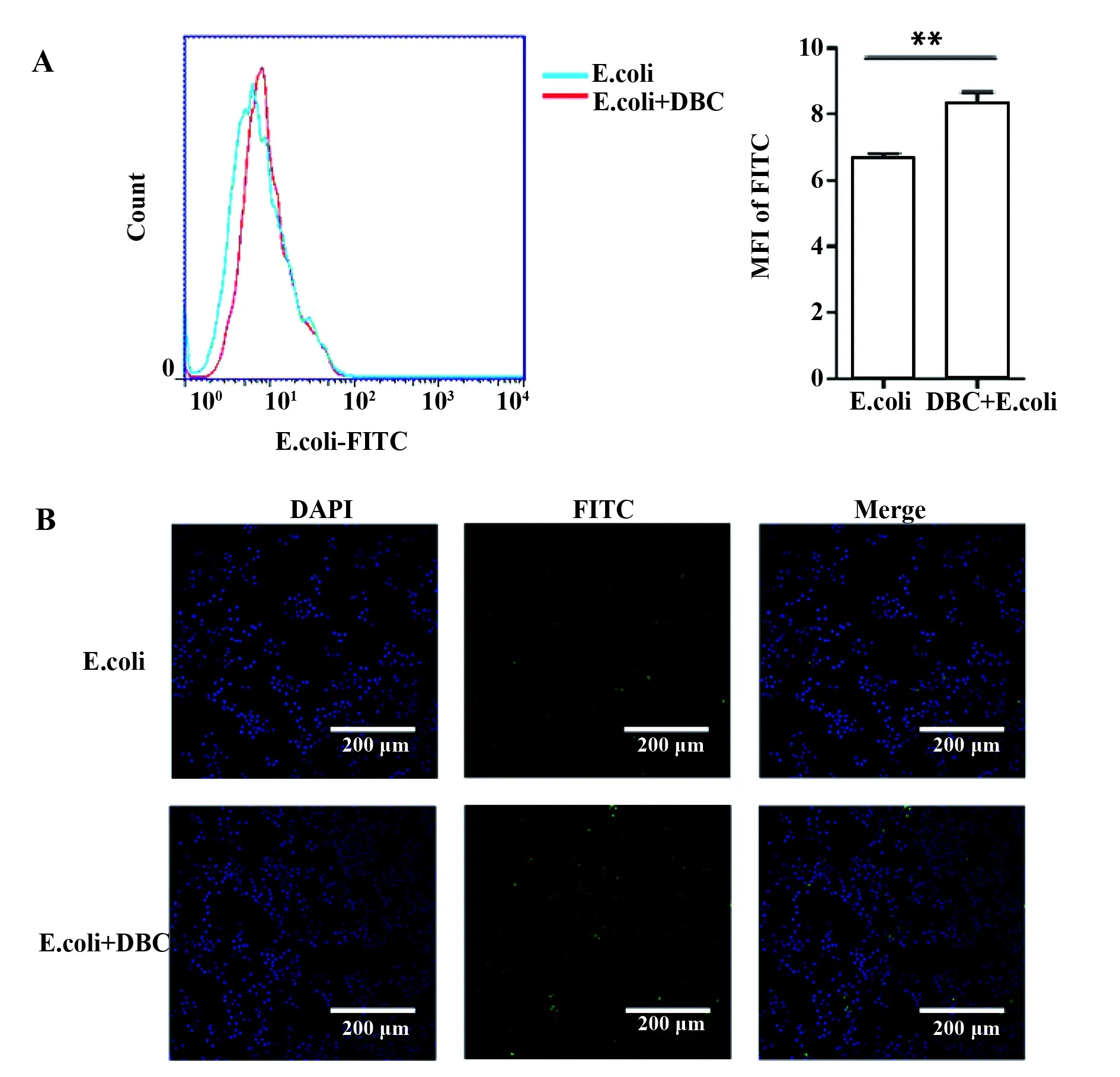
图5 鹿血晶对RAW 264.7细胞吞噬大肠杆菌能力的影响Fig.5 Effect of deer blood crystal on ability of RAW 264.7 cells to phagocytose E.coliNote: **.P<0.01.
2.5鹿血晶能够促进RAW 264.7细胞对细菌的吞噬作用 利用500 μg/ml鹿血晶预处理RAW 264.7细胞后,加入标记FITC荧光素的大肠杆菌刺激,6 h后通过流式细胞术检测RAW 264.7细胞吞噬大肠杆菌的能力,结果如图5A所示。与未加入鹿血晶而仅仅加入大肠杆菌刺激的E.coli组相比,鹿血晶能够明显提高RAW 264.7细胞内FITC的平均荧光强度。免疫荧光试验得到了同样的结果,如图5B所示。结果表明,鹿血晶能够提高巨噬细胞吞噬大肠杆菌的能力。
3 讨论
鹿血晶系鹿血经炮制加工干燥后制得的产品。鹿血具有抗衰老、补气补血、调节免疫、促进伤口愈合等功效[3,4]。本次研究,我们证明了一定浓度范围内的鹿血晶不会降低炎症状态下巨噬细胞系RAW 264.7的细胞活力,甚至能够提高其细胞活力。这说明鹿血晶作为一种保健品,适量服用不会对身体产生毒性,具体服用剂量还需要通过动物实验以及药代动力学研究获得。
巨噬细胞作为一种重要的固有免疫细胞,能够通过释放炎症因子,杀伤外来病原体并将其吞噬,保护机体免遭侵害[6]。免疫力低下的人如婴幼儿、老年人等更容易受到病原体的感染[8,9]。通过检测RAW 264.7细胞对大肠杆菌的吞噬能力发现,鹿血晶能够促进巨噬细胞吞噬大肠杆菌,这意味着鹿血晶能够提高巨噬细胞的免疫防御能力。
炎症是一把双刃剑,可控的炎症有利于抵御外来病原体的入侵,但持续的炎症往往会造成组织损伤、伤口无法愈合、发热,甚至演化成癌症[10,11]。因此,炎症发生与炎症消散之间需要建立微妙的平衡,必要时需要药物辅助。巨噬细胞是炎症的重要参与者,其过度激活会造成持续的炎症。本次研究中发现,鹿血晶能够显著抑制LPS诱导的炎症状态下RAW 264.7细胞炎症因子iNOS、IL-1β、IL-6的表达与释放,说明鹿血晶具有抑炎作用。
NF-κB信号通路是介导免疫细胞参与炎症反应的重要通路,它的活化能够引起免疫细胞产生和释放炎症因子[12,13]。Western blot实验结果表明,鹿血晶能够抑制炎症状态下RAW 264.7细胞内的NF-κB信号的活化,说明鹿血晶能够通过抑制巨噬细胞NF-κB信号通路的活化从而发挥抑炎作用。
综上,鹿血晶能够增强巨噬细胞吞噬大肠杆菌的能力,并且在不影响细胞活力的同时作用于NF-κB信号通路,抑制炎症状态下巨噬细胞炎症因子的表达与释放。
