右美托咪定调节MAPK/ERK-CREB通路对大鼠海马神经元凋亡的保护作用
2020-05-11朱建坡
朱建坡, 梁 冰
神经系统疾病常发生于中枢神经、周围神经、植物神经系统,主要以运动、感觉和植物神经功能障碍为主要症状的疾病[1,2]。研究表明,丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路与神经系统性疾病密切相关,抑制MAPK信号通路可以减少海马神经元损伤和凋亡[3,4]。右美托咪定(dexmedetomidine,DEX)是一种α-2肾上腺素能受体激动剂,研究表明,DEX可减轻大鼠慢性神经病理性疼痛,抑制MAPK、磷酸化细胞外调节蛋白激酶(phosphoryltion of extracellular regulatory protein kinases,pERK)、磷酸化环磷腺苷效应元件结合蛋白(phosphoryltion of cAMP response element binding protein,pCREB)表达,推断DEX通过调控MAPK/ERK-CREB通路对海马神经元凋亡起保护作用[5]。本实验通过对大鼠构建癫痫持续状态(status epilepticus,SE)模型机构建立一种神经系统疾患,观察DEX对SE大鼠行为及MAPK/ERK-CREB通路的影响,以初步探究DEX对SE大鼠海马神经元凋亡保护作用。
1 材料与方法
1.1 实验动物 健康Sprague-Dawley SPF级雄性大鼠40只,6~8周龄,体重200 g左右,由中国医科大学附属盛京医院实验动物中心提供,动物许可证号:2016PS260K。饲养条件:温度(22±2)℃,湿度40%~70%,每笼5只,自由摄食饮水,常规饲养1 w进行实验。本研究对于大鼠处理均符合实验动物福利与伦理委员会原则。
1.2 试剂及仪器 DEX(国药准字H20090248)购自江苏恒瑞医药股份有限公司;Nissl染色试剂盒(货号:WLA128)购自万类生物有限公司,TUNEL试剂盒(货号:C1086)购自碧云天生物技术研究所;GAPDH抗体(货号:ab181602)、p-ERK抗体(货号:ab79483)、p-CREB抗体(货号:ab220798)、caspase-3抗体(货号:ab13847)、Bax抗体(货号:ab32509)、Bcl-2抗体(货号:ab182858)均购自美国Abcam公司;毛果芸香碱(货号:MB5259)购自美仑生物有限公司;氯化锂(货号:L1110)、阿托品(货号:AT100)购自美国Spectrum公司;地西泮(货号:BZ2886)购自上海恪敏生物科技有限公司;辣根过氧化物酶标记的二抗(货号:BHR101)购自北京博尔西科技有限公司;BCA蛋白浓度检测试剂盒(货号:P0010S)购自上海碧云天公司;蛋白电泳及电转移装置(型号:AU5800)购自北京市六一仪器厂;酶联免疫分析仪(型号:EVO75)购自澳大利亚Techan公司;超低温冰箱(型号:MDF-U32V)购自美国Thermo公司。
1.3 实验方法
1.3.1 大鼠SE模型构建[6]及分组 大鼠SE模型构建:大鼠腹腔注射3 mmol/kg 氯化锂,24 h后同一部位注射50 mg/kg毛果芸香碱,观察大鼠行为,根据癫痫发作Racine分级进行判断,大于4级,表明癫痫模型点燃成功。发作持续15 min后腹腔注射1 mg/kg阿托品,40 min后给予10 mg/kg地西泮腹腔注射直至发作终止从而进行控制。将大鼠随机分为正常对照组、阳性对照组、SE组、SE+DEX组,每组各10只。SE模型构建成功后,SE+DEX组大鼠腹腔注射1 μmol/L DEX;SE组、正常对照组腹腔注射同量0.9%氯化钠液;阳性对照组大鼠腹腔注射1 μmol/L苯巴比妥,药物干预24 h后留取标本。根据改良后Racine分级[7]:正常状态,0级;出现双目紧闭,面部细纤维肌束发生颤动(如耳朵和胡须等部位),伴随吸气动作,1级;出现点头频率,面部肌束颤动明显,2级;前肢单肢发生抽搐,3级;前肢均发生阵挛,身体无直立,3.5级;前肢均发生阵挛,身体直立,4级;身体强直,伴随肢体倒向一侧,4.5级;出现强直阵挛,身体直立且背部倒地,5级。
1.3.2 动物行为学观察 给药后,对所有大鼠按Racine评分标准分别进行评分,每20 min作为一个评分时间点,连续观测,监测120 min,记录并计算各组大鼠Racine评分。
1.3.3 样品采集 给药24 h后,每组随机抽取5只腹腔注射1%戊巴比妥钠麻醉后,采用20 ml生理盐水和4%多聚甲醛40 ml经心脏灌注,取脑后采用4%多聚甲醛浸泡过夜,大脑标本在4%多聚甲醛固定24 h进行常规脱水、透明、石蜡包埋,制备海马组织蜡块置于4 ℃冰箱保存。用石蜡切片机作冠状切面连续切片,切片厚度约为4 μm,主要用于Nissl法和TUNEL法检测。另将每组剩余5只大鼠常规麻醉后,迅速断头取脑组织,在4 ℃条件下钝性分离大鼠双侧海马组织,迅速置于液氮罐中保存,用于Western blot检测。
1.3.4 Nissl法检测细胞损伤 将1.3.3中制备石蜡切片于二甲苯、不同浓度乙醇中浸泡,1%甲苯胺蓝染色40 min,后分色,脱水至透明后,封片,最后于显微镜下观察并对尼氏阳性的细胞进行计数。
1.3.5 TUNEL法检测细胞凋亡 将1.3.3中制备的石蜡切片于二甲苯、不同浓度乙醇中浸泡5 min后,用蛋白酶K室温消化1 h后,按TUNEL试剂盒说明书将切片进行染色、终止反应、封片等,于荧光显微镜下观察细胞凋亡数目。经TUNEL染色的阳性细胞呈棕黄色或棕褐色。
1.3.6 Western blot法检测大鼠海马组织中MAPK/ERK-CREB通路相关蛋白、凋亡相关蛋白表达 从液氮罐中取出海马组织,然后按照1∶5(wt/vol)加入500 μl细胞裂解液用玻璃研磨器研磨海马组织,裂解30 min后提取组织蛋白,离心取上清液即总蛋白,用BCA法检测蛋白浓度后,进行SDS聚丙烯酰胺凝胶电泳,转膜后加入一抗(MAPK、pERK、pCREB、caspase-3、Bax、Bcl-2、GAPDH抗体,1∶1500),4 ℃孵育过夜,次日洗膜后加二抗(1∶5000)室温孵育2 h,TBST洗膜,加ECL发光液,在凝胶成像系统中拍照。
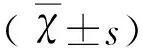
2 结 果
2.1 各组大鼠的行为学观察 与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠Racine分值显著增加(P<0.05),与SE组相比,阳性对照组、SE+DEX组大鼠Racine分值显著降低(P<0.05)(见表1)。
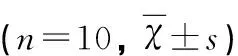
表1 各组大鼠Racine分值
与正常对照组比较*P<0.05;与SE组比较#P<0.05
2.2 各组大鼠海马神经元损伤及凋亡情况
2.2.1 细胞损伤结果 正常对照组大鼠海马区神经元边缘清晰,排列整齐,胞浆中可见尼氏小体;SE组大鼠海马区神经元缺失严重、排列松散,胞浆深浅不一,核仁消失或不明显;阳性对照组、SE+DEX组,神经元缺失减少,排列较规律(见图1)。对大鼠海马神经元计数分析结果显示,与正常对照组相比,SE组、阳性对照组、SE+DEX组大鼠海马神经元数显著减少(P<0.05);与SE组相比,阳性对照组、SE+DEX组大鼠海马神经元数显著增加(P<0.05)(见表2)。
2.2.2 细胞凋亡结果 SE组、阳性对照组、SE+DEX组大鼠海马区神经椎体细胞固缩。TUNEL阳性细胞计数分析结果显示,与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠海马区棕褐色阳性细胞显著增加(P<0.05);与SE组相比,阳性对照组、SE+DEX组大鼠海马区棕褐色阳性细胞显著减少(P<0.05)(见图2、表3)。
2.3 各组大鼠海马组织中MAPK/ERK-CREB通路相关蛋白表达结果比较 与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠海马组织中MAPK、p-ERK、p-CREB蛋白表达量显著升高(P<0.05);与SE组相比,阳性对照组、SE+DEX组大鼠海马组织中MAPK、p-ERK、p-CREB蛋白表达量显著降低(P<0.05)(见图3、表4)。
2.4 各组大鼠海马组织中凋亡相关蛋白表达结果比较 与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠海马组织中caspase-3、Bax、Bax/Bcl-2蛋白表达量显著升高(P<0.05),Bcl-2蛋白表达量显著降低(P<0.05);与SE组相比,阳性对照组、SE+DEX组大鼠海马组织中caspase-3、Bax、Bax/Bcl-2蛋白表达量显著降低(P<0.05),Bcl-2蛋白表达量显著升高(P<0.05)(见图4、表5)。
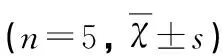
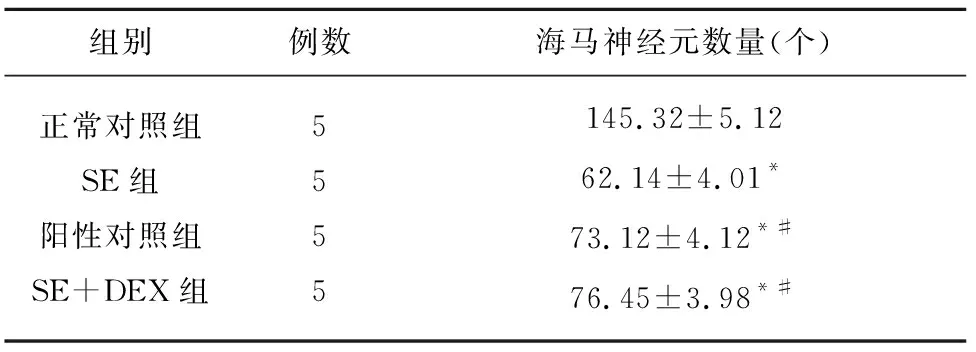
组别例数海马神经元数量(个)正常对照组SE组阳性对照组SE+DEX组5555145.32±5.1262.14±4.01*73.12±4.12*#76.45±3.98*#
与正常对照组比较*P<0.05;与SE组比较#P<0.05
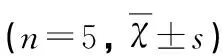
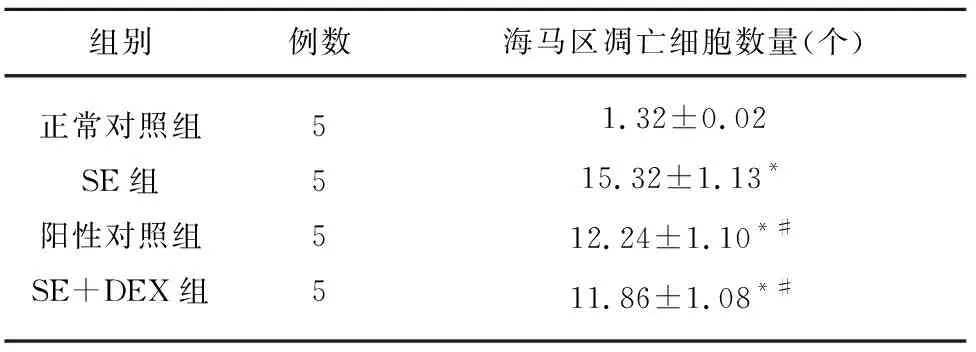
组别例数海马区凋亡细胞数量(个)正常对照组SE组阳性对照组SE+DEX组55551.32±0.0215.32±1.13*12.24±1.10*#11.86±1.08*#
与正常对照组比较*P<0.05;与SE组比较#P<0.05
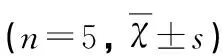
表4 各组大鼠海马组织中MAPK/ERK-CREB通路相关蛋白表达结果
与正常对照组比较*P<0.05;与SE组比较#P<0.05
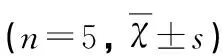
表5 各组大鼠海马组织中凋亡相关蛋白表达结果
与正常对照组比较*P<0.05;与SE组比较#P<0.05
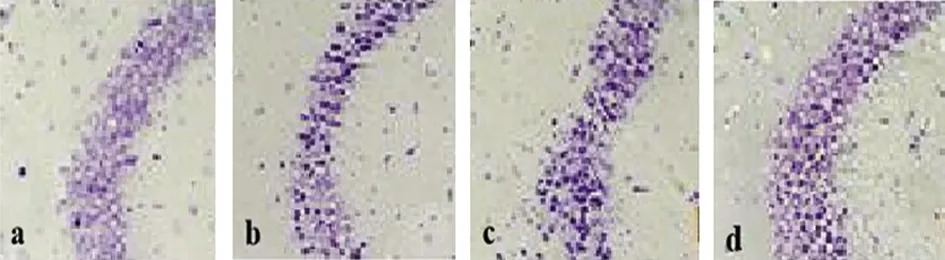
a:正常对照组;b:SE组;c:阳性对照组;d:SE+DEX组
图1 各组大鼠海马神经元Nissl染色图
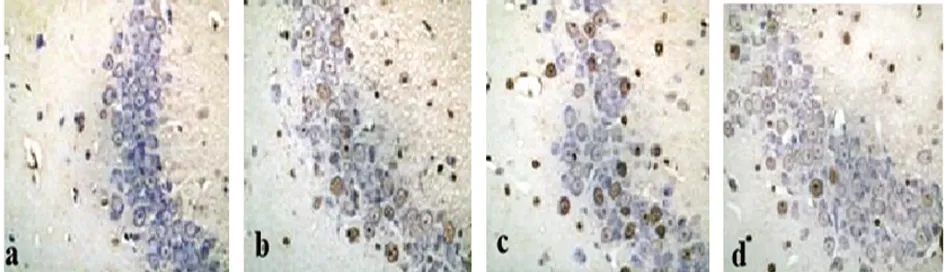
a:正常对照组;b:SE组;c:阳性对照组;d:SE+DEX组
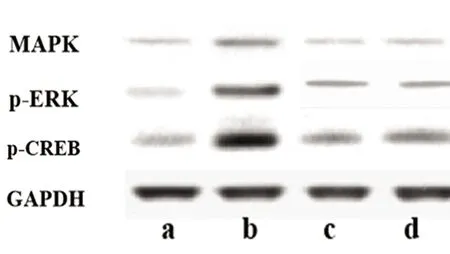
a:正常对照组;b:SE组;c:阳性对照组;d:SE+DEX组
图3 各组大鼠海马组织中p-ERK、p-CREB蛋白表达图
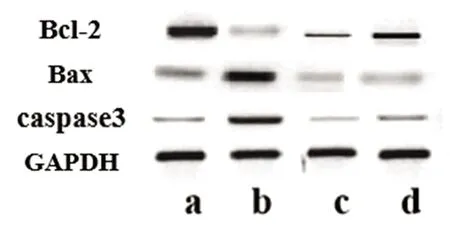
a:正常对照组;b:SE组;c:阳性对照组;d:SE+DEX组
图4 各组大鼠海马组织中凋亡相关蛋白表达图
3 讨 论
神经性疾病发生会引起患者瘫痪、共济失调、肌萎缩侧索硬化、头痛、反射异常、肌萎缩、排尿、排粪、性功能障碍等症状。SE属于神经性疾病,是由多种病因共同引起的一种慢性脑部疾病[8]。随着社会发展、饮食习惯变化,神经性疾病的发病率逐年升高,严重影响人们的身体健康和生活质量[9]。临床上对于神经性疾病治疗,多以药物控制为主,但目前药物对智力、运动功能、情绪等方面造成严重的副作用,因此找寻找新的药物对神经性疾病的治疗具有重要意义。DEX主要是作用于中枢神经及周围神经系统,有镇静、镇痛、抑制交感神经活动等作用,临床多与镇静、镇痛药物联合使用进行麻醉[10],最近有研究表明DEX对SE有良好的治疗作用[11]。本研究通过观察各组大鼠的行为学发现,与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠Racine分值显著增加;与SE组相比,阳性对照组、SE+DEX组大鼠Racine分值显著降低,提示SE大鼠模型构建成功,DEX对SE大鼠有一定治疗作用。SE是一种以中枢神经功能障碍为特征的脑部疾病,由于海马区的脑神经元过度兴奋,持续频繁的兴奋会造成脑内神经递质等化学物质发生病变所引起的。丁秀芳等[12]研究发现,SE可导致海马区神经元损伤。本研究发现,与正常对照组相比,SE组、阳性对照组、SE+DEX组大鼠海马区神经元缺失严重,核仁消失或不明显,神经椎体细胞固缩,大鼠海马神经元数显著减少,海马区棕褐色阳性细胞显著增加,提示SE发生会引起海马神经元数减少,海马神经元凋亡增加。研究表明,DEX可以抑制海马神经元损伤[13]。本研究发现,与SE组相比,阳性对照组、SE+DEX组大鼠海马神经元数显著增加,海马区棕褐色阳性细胞显著减少,提示DEX可以抑制海马神经元数减少和海马神经元凋亡。
caspase-3是一种剪切酶,在细胞凋亡中不可缺失,Bax属于Bcl-2家族,是凋亡促进基因,Bcl-2是抗凋亡基因,Bax可以与Bcl-2形成二聚体结构[14]。早期研究发现,Bax/Bcl-2比例可以表明细胞凋亡的强弱,本研究发现,与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠海马组织中caspase-3、Bax、Bax/Bcl-2蛋白表达量显著升高,Bcl-2蛋白表达量显著降低,提示caspase-3、Bax、Bcl-2蛋白表达与细胞凋亡密切相关。研究表明,降低海马区Bax、caspase-3表达,提高Bcl-2表达,DEX可以抑制AD大鼠海马区内细胞凋亡[15,16]。本研究发现,与SE组相比,阳性对照组、SE+DEX组大鼠海马组织中caspase-3、Bax、Bax/Bcl-2蛋白表达量显著降低,Bcl-2蛋白表达量显著升高,提示DEX可能通过抑制caspase-3、Bax表达,促进Bcl-2蛋白表达,抑制细胞凋亡。
MAPK家族主要作用是将细胞外信号传导到细胞内部与ERK1/2在脑部海马区发挥重要作用[17]。ERK通路可以激活CREB使其发生磷酸化,调控神经元发育、兴奋、凋亡等过程[18]。本研究发现,与正常对照组相比,SE、阳性对照组、SE+DEX组大鼠海马组织中MAPK、p-ERK、p-CREB蛋白表达量显著升高,提示MAPK、p-ERK、p-CREB蛋白表达与SE发生密切相关。研究表明,抑制MAPK信号通路对海马神经元毒性损伤起到一定的保护作用[19]。本研究发现,与SE组相比,阳性对照组、SE+DEX组大鼠海马组织中MAPK、p-ERK、p-CREB蛋白表达量显著降低,提示DEX可以抑制MAPK、p-ERK、p-CREB表达,推测DEX可能通过抑制MAPK/ERK-CREB通路抑制海马神经元凋亡,对海马神经元损伤发挥保护作用。
综上所述,DEX可能通过抑制MAPK/ERK-CREB通路抑制海马神经元凋亡,对其发挥保护作用。需进一步研究DEX调控MAPK/ERK-CREB通路治疗神经性疾病有效性及其调控其他信号通路的可能作用机制。
