仅仅表现为双下肢无力的GBS 2例报告
2020-05-11王楠楠钟春娟万顺伦
王楠楠, 钟春娟, 万顺伦
吉兰-巴雷综合征(Guillain-barre syndrome,GBS)是一种自身免疫介导的周围神经病变,主要累及多数脊神经根和周围神经,临床上急性或亚急性起病,以四肢弛张型瘫痪、腱反射消失、脑脊液出现蛋白-细胞分离为主要特点。典型病例不难诊断,但变异型GBS临床上少见,容易误诊、漏诊。近年来,不断有各种变异型GBS的报道[1,2],其表现复杂多样,特别是以双下肢无力为首发症状并仅仅局限于下肢无力的GBS更为少见,国内尚未报道。本文报道我院收治的2例仅仅表现为双下肢无力的GBS患者的临床资料,并复习相关文献,以提高对该病的认识。
1 病例资料
病例1:患者,男性,64岁,因“双下肢无力2 d”于2019年5月4日入院。患者入院前2 d突然出现双下肢无力,远端为重,站立、行走困难,无其他伴随症状。发病前曾有饮酒史,无上感、腹泻等病史。查体:血压120/80 mmHg,心肺腹(-)。神经系统检查:神清,言语正常,颅神经(-),四肢肌张力正常,双上肢远近端肌力5级,双侧屈髋、伸髋肌力5级,双髋外展肌力3级、内收肌力4级,双侧屈膝肌力5级,右侧伸膝4级,左侧伸膝5级,双足背屈4级,跖屈4级,内旋5级,双足外旋3级,四肢腱反射正常,深浅感觉检查、共济失调、病理征等余项查体均未见异常。辅助检验及检查:血、尿、便常规正常,大便潜血阴性。生化、甲状腺全套、糖化血红蛋白、血凝4项均正常;类风湿病态监测、抗核抗体滴度、抗核自身抗体谱、抗中性粒细胞胞浆抗体、梅毒艾滋病抗体、贫血标志物、肿瘤标志物大致正常。心电图、胸部、全腹部CT、心脏、颈部血管、腹部血管、双下肢动静脉彩超未见异常。头部MRI:腔隙性脑缺血灶(陈旧性)。颈椎MRI:C3-7椎间盘向后突出,颈椎椎管狭窄。胸椎MRI:胸椎椎间盘变性。腰椎MRI:L4-5及L5-S1椎间盘突出伴椎管狭窄。发病第8天腰穿,脑脊液:压力110 mmH2O,无色透明,常规(-),生化:微量蛋白504 mg/L(150~500 mg/L),余正常。血清及脑脊液中神经节苷脂抗体阴性。肌电图:上下肢周围神经传导未见异常,针极肌电图未见神经源性或肌源性损害(见表1、表2)。发病第14天复查腰穿,脑脊液:压力100 mmH2O,常规正常;生化:微量蛋白增高:743 mg/L;复查肌电图:双侧腓总神经、胫神经运动传导速度下降,CMAP波幅在正常范围。左侧胫神经F波潜伏期延长,右侧胫神经F波潜伏期及出现率在正常范围(见表3)。
参考2010年中国吉兰-巴雷综合征诊断标准[1]:(1)常有前驱感染史,呈急性起病,进行性加重,并在2 w左右达高峰;(2)对称性肢体和延髓支配肌肉、面部肌肉无力,重症者可有呼吸肌无力,四肢腱反射减低或消失;(3)可伴有轻度感觉异常和自主神经功能障碍;(4)脑脊液出现蛋白-细胞分离现象;(5)电生理检查提示远端运动神经传导潜伏期延长,传导速度减慢,F波异常,传导阻滞,异常波形离散等;(6)病程有自限性。该患者符合第(1)、(2)、(4)、(5)项。故诊断为吉兰-巴雷综合征,治疗上给予免疫球蛋白0.4 g/(kg·d),共4 d,同时营养神经治疗,患者双下肢肌力逐渐好转,发病第22天复查肌电图双下肢运动神经传导速度及胫神经F波潜伏期恢复正常。3 m后随访,患者双下肢肌力基本恢复正常,查体肌力5级。
病例2:患者,男性,21岁,因“双下肢无力10 d”于2019年7月9日入院。患者入院前10 d出现双下肢远端无力,站立行走尚稳,入院前4 d出现双下肢无力加重,需借助外力站立行走,发病前1 w有腹泻病史。查体:血压126/82 mmHg,心肺腹(-)。神经系统检查:神清语利,颅神经(-),四肢肌张力正常,双上肢肌力5级;双侧屈髋、伸髋、髋外展、内收肌力4级;双侧屈膝、伸膝4级;双足背屈、跖屈、外旋、内收肌力0级;双侧膝反射、双侧跟腱反射消失。深浅感觉检查、共济失调、病理征等余项查体均未见异常。辅助检验及检查:血、尿、便常规正常;生化、肿标全套、甲状腺全套、肝炎全套大致正常。发病第10天腰穿:脑脊液压力、常规、生化正常。血清及脑脊液中神经节苷脂抗体阴性。肌电图:双侧腓总神经、胫神经运动传导速度下降,CMAP波幅下降。双侧腓浅神经、腓肠神经感觉传导速度正常,SNAP波幅在正常范围。双侧正中神经、尺神经运动、感觉传导速度在正常范围,CMAP、SNAP波幅在正常范围。F波:双侧胫神经F波未引出,双侧尺神经F波出现率在正常范围(见表4)。针极肌电图:双下肢肌肉可见大量异常自发电位,提示双下肢运动神经轴索损害为主(见表5)。发病第21天复查腰穿:脑脊液压力、常规正常;生化:微量蛋白705 mg/L。据2010年中国吉兰-巴雷综合征诊断标准,该患者符合第(1)、(2)、(4)项,同时参考电生理诊断标准:突出特点是运动神经轴索性损害明显,故诊断为吉兰-巴雷综合征,给予免疫球蛋白0.4 g/(kg·d),共5 d,甲钴胺、康复锻炼等综合治疗,患者双下肢肌力逐渐好转,复查神经传导无改善(见表6)。3 m后随访,患者双下肢肌力明显恢复,查体肌力4级。
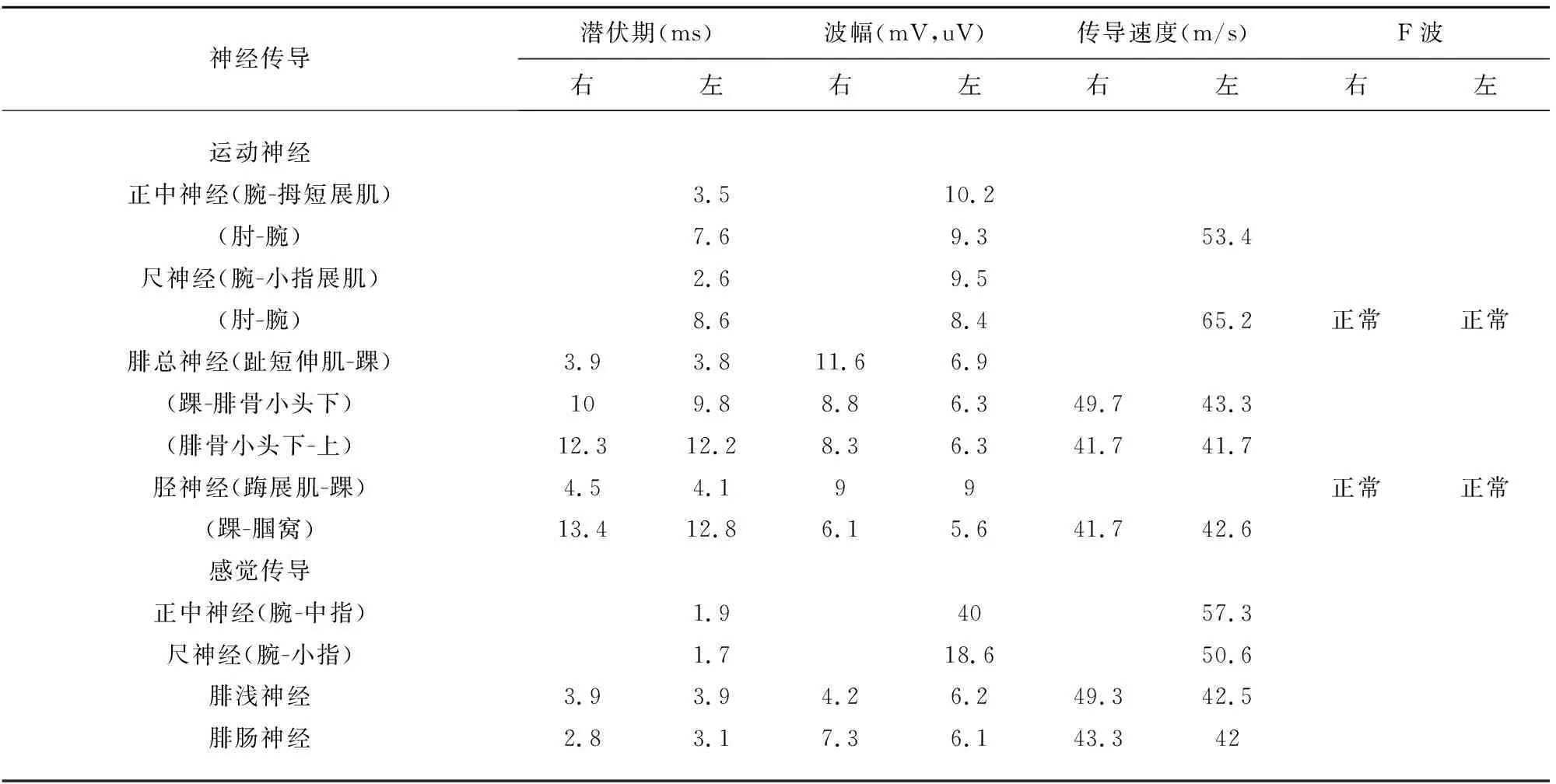
表1 例1发病第8天肌电图结果
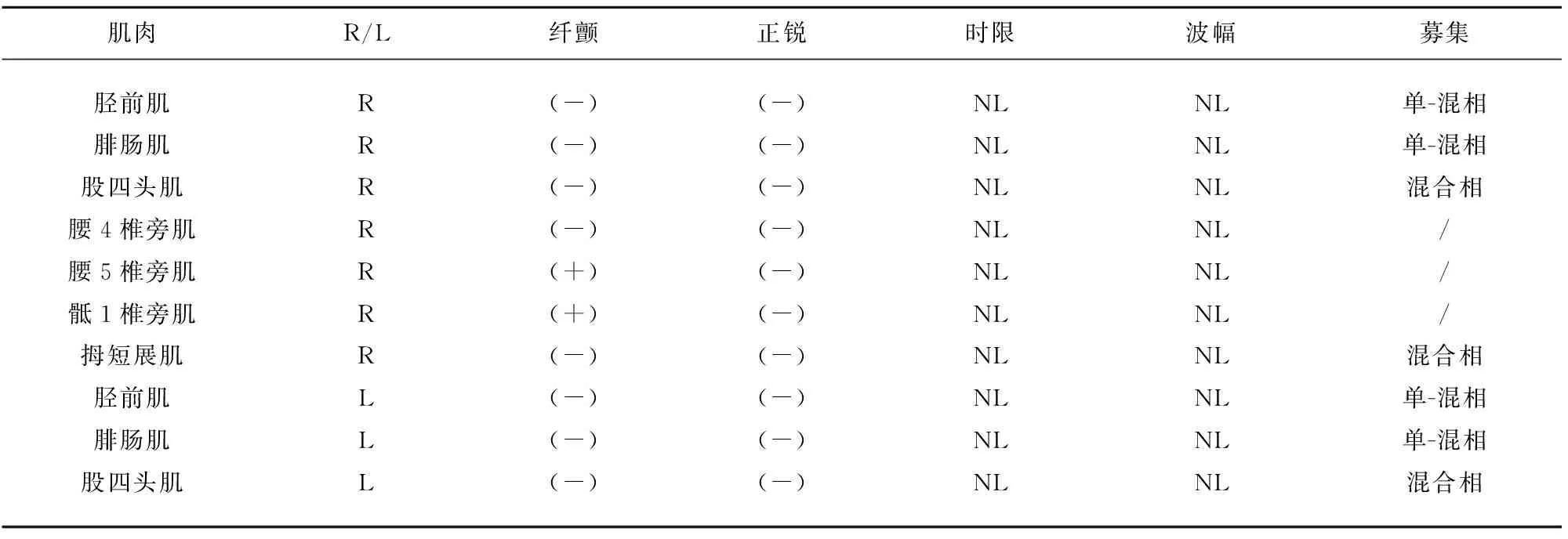
表2 例1发病第8天针极肌电图
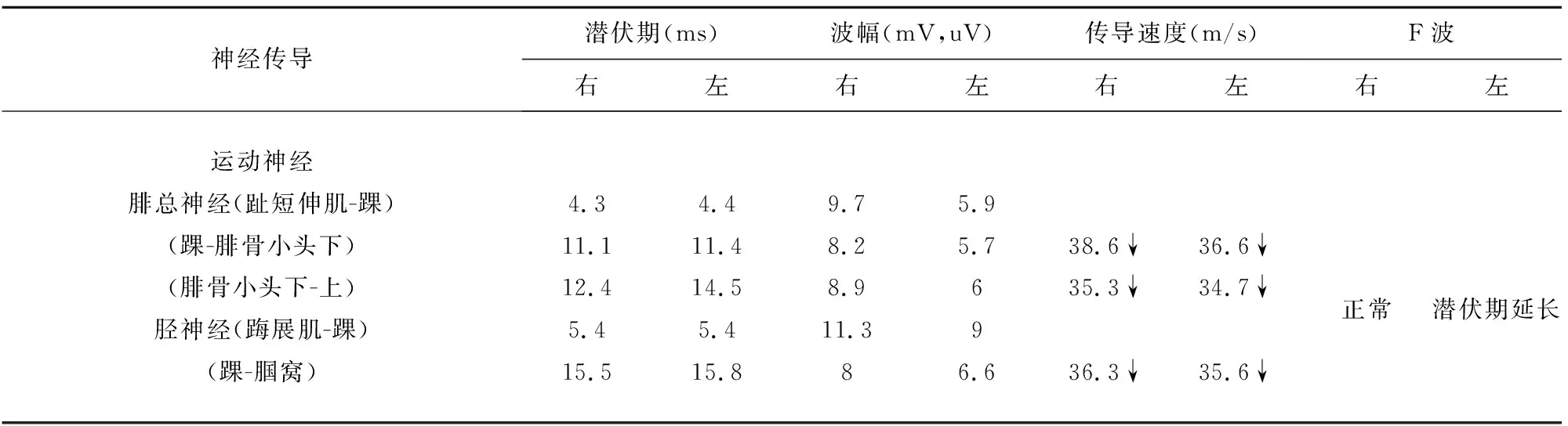
表3 例1发病第14天肌电图结果
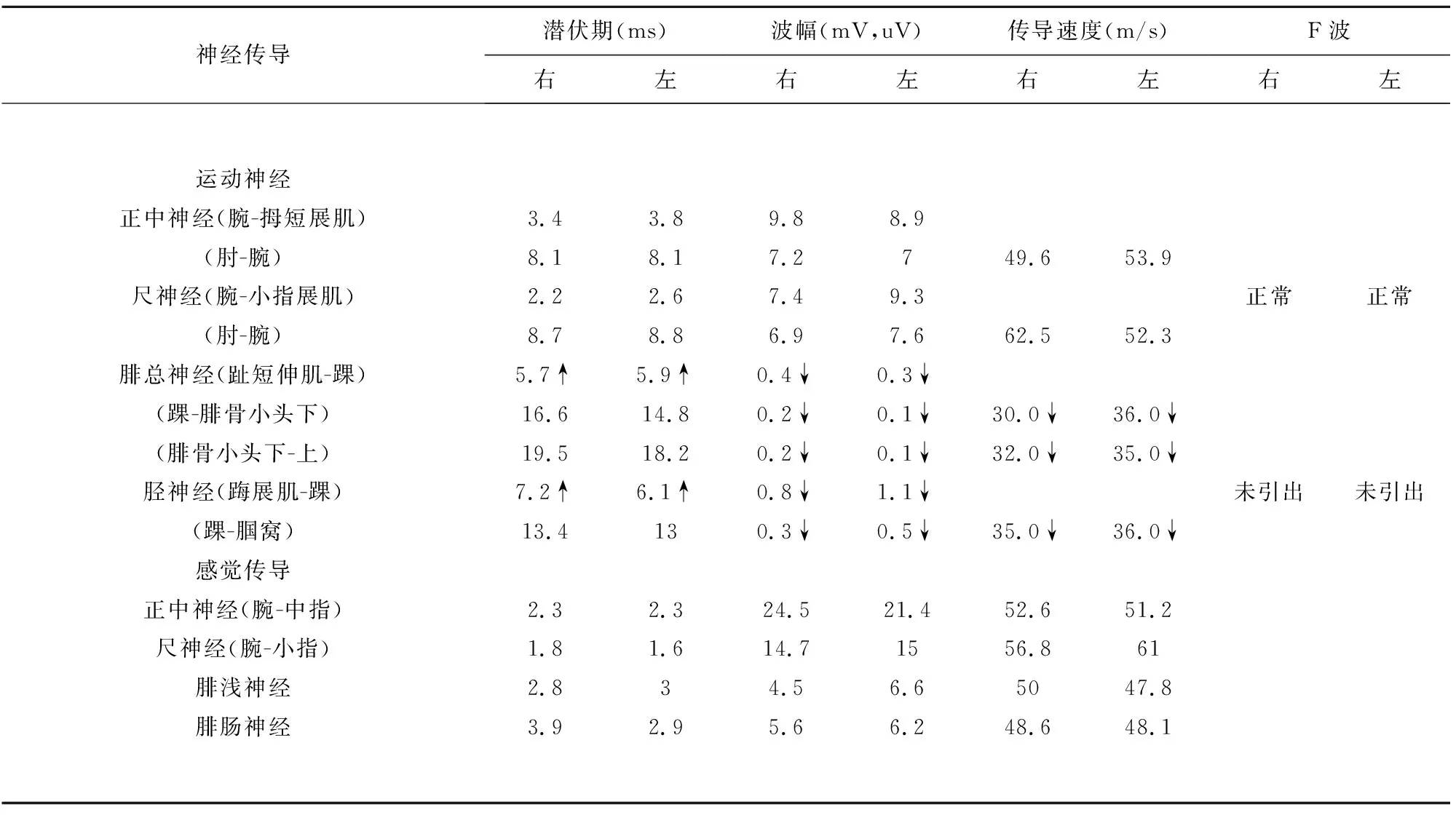
表4 例2发病第10天肌电图结果

表5 例2发病第10天针极肌电图

表6 例2发病第21天肌电图结果
2 讨 论
典型GBS病例比较多见,变异型GBS在临床上少见,后者包括急性运动轴索性神经病(AMAN)、急性运动感觉轴索性神经病(AMSAN)、Miller-Fisher综合征(MFS)、急性感觉神经病(ASN)、急性泛自主神经病(APN)等[1]。另外,还有表现为局限的咽-颈-臂无力型、面瘫伴肢体感觉障碍型、截瘫型GBS[2]。在临床中,截瘫型GBS非常少见,确切的发病率不详,在一项480例GBS患者的研究中,只有8%的患者诊断截瘫型GBS[3]。这种亚型与四肢瘫痪型患者相比,截瘫患者的GBS症状较轻,较少发生颅神经受累和呼吸衰竭,腿部无力症状较轻[4]。Wakerley等[5]进一步描述了截瘫型GBS的临床核心特征:双下肢无力可不对称或单侧无力,腱反射减弱或消失,不伴上肢无力,膀胱功能正常且无明确的感觉平面,周围神经电生理证据可支持诊断。本文报道的2例患者均以双下肢无力为首发症状,并且在整个发病过程中症状仅仅局限于双下肢,并未向上发展累及到上肢、呼吸肌及颅神经。病例1表现为双侧下肢无力,而且受累肌肉的无力程度、范围均不同,呈非对称性,但下肢腱反射基本正常。病例2表现的双下肢对称性无力,腱反射消失。这2例的临床表现与Wakerley报道的基本一致,但又有不同的地方。部分变异型GBS患者其症状为不同临床亚型的重叠,或在病程的不同阶段依次属于不同的临床综合征[2]。不同变异型的GBS其病理生理具有一定的相关性,因此也具有一些共同的临床特点,这些包括前驱感染史、单向病程和对称性颅部及肢体力弱等[4],并且临床上依据肢体和颅神经受累程度和范围作出诊断[2]。脑脊液蛋白-细胞分离现象(蛋白升高,细胞数正常),抗神经节苷脂抗体、及轴索性或脱髓鞘性电生理证据可以支持GBS诊断,但诊断不应对此依赖[4]。Yuki等对213例GBS研究发现,存在腱反射的GBS亚型可见于AMAN或截瘫型GBS[6]。2014年的国际GBS诊断标准中也不再将腱反射减低和/或消失作为核心临床特征。GBS患者在发病急性期,血清可检测到抗神经节苷脂抗体的约占60%[7],AMAN或截瘫型GBS多可检测到抗GMl抗体或抗GDla抗体,提示截瘫型GBS可为临床表现局限的AMAN[2],也就是说截瘫型GBS可以是AMAN发病的不同病程阶段。Nagashima等研究发现截瘫型GBS的肌电图为轴索性神经病[8]。而我们例1为周围神经脱髓鞘损害,所以例1与文献报道并不一致,而与经典型GBS的电生理改变更加相似。结合本文,例1患者急性起病,双下肢无力,脑脊液蛋白-细胞分离,电生理检查提示胫神经F波潜伏期延长,双下肢周围神经脱髓鞘损害。例2患者急性起病,发病前腹泻病史,双下肢对称性无力,脑脊液蛋白-细胞分离,电生理提示轴索损害,针极肌电图失神经改变。且2例患者的发病均为单向病程,不伴上肢无力,影像学检查没有发现异常。随访3 m,下肢肌力基本恢复正常。结合上述国内外文献报道,进一步明确为截瘫型GBS的诊断。
GBS最主要的病因是前驱感染,以上呼吸道感染或胃肠道感染最多见,上呼吸道感染的病原学以病毒居多,如巨细胞病毒(CMV)、非洲淋巴细胞瘤病毒(EBV)等,也有肺炎支原体。胃肠道感染最明确的病原学是空肠弯曲菌(CJ),25%~50%成年患者,且在亚洲国家具有较高的发生率[9]。有研究显示约70%的患者有前驱感染[10]。本文例2发病前1 w有腹泻病史。一些没有前驱感染症状的患者仍可能有隐匿无症状感染[11]。例1患者发病前无明显诱因,但有饮酒史,饮酒是否为GBS发病的诱因,值得我们探讨。
以双下肢无力为首发症状的患者,可以为脊髓受损后出现双下肢无力,同时可伴有感觉、大小便功能障碍。也可以是以神经根及周围神经损害为主,表现为迟缓性下肢无力。针对双下肢无力的GBS,国外文献报道称为Paraparetic Guillain-Barre syndrome,国内文献翻译为截瘫型GBS。结合神经科文献资料对截瘫的描述,本文认为称为下肢无力型GBS更为妥切。当然不管如何命名这种亚型,在诊断时均需与以下疾病鉴别,如腰骶神经丛病、糖尿病性神经病、肿瘤、急性横贯性脊髓炎、脊髓灰质炎、脊髓缺血、脊髓损伤、重症肌无力、肌炎等疾病。还有报道,有36%的患者在肌无力症状出现前2 w,出现不明原因的背痛和下肢疼痛[12,13],这些还需要与腰椎病变等鉴别。截瘫型GBS是GBS的一种亚型,或者说是GBS病程中一个阶段。所以其治疗原则就是GBS的治疗。目前首选人血免疫球蛋白(IVIG),0.4 mg/kg,1次/d,静滴,连续3~5 d,免疫球蛋白的有效机制可能为中和致病性的抗体和抑制自身抗体介导的补体激活[14]。血浆置换(PE),每次血浆交换量为30~50 ml/kg,在1~2 w内进行3~5次。如果要使用免疫球蛋白和PE疗法,尽量越早越好,原则上应在不可逆的神经损害发生之前尽快开始。早期或重症患者中可使用糖皮质激素冲击治疗[1]。总之,在临床上仅仅局限于双下肢无力的患者,应考虑到GBS的可能。及早发现并治疗直接影响到疾病的进展和预后。
