吉西他滨靶向HGF/cMET通路对非小细胞肺癌A549细胞迁移和侵袭的影响
2020-05-09廖子君马婕群张彦兵李索妮
郑 琪,廖子君,马婕群*,张彦兵,李索妮,李 倩,2,白 杰,2
(1西安交通大学医学院附属陕西省肿瘤医院内一科,西安 710061;2西安医学院;*通讯作者,E-mail:503557209@qq.com)
肺癌是我国最常见的恶性肿瘤之一,无论是发病人数还是死亡人数均居所有恶性肿瘤的首位。2015年我国新发肺癌病例733 300人,死亡人数为610 200人[1]。85%左右的肺癌属于非小细胞肺癌(non-small cell lung cancer, NSCLC),超过40%的肺癌患者初诊时就已经发现肺外转移,90%的肺癌患者死于远处转移。因此,抑制肿瘤的侵袭和转移是肺癌治疗的重要组成部分,一定程度上决定着患者的预后。
HGF/cMET信号通路在胚胎形成、血管生成和伤口愈合等生理过程中发挥重要作用。NSCLC中HGF/cMET通路的异常激活较为常见,可导致肿瘤侵袭性增加、病情进展和预后不良,还可以造成肿瘤细胞对分子靶向药物发生耐药,因此抑制HGF/cMET是一种有潜力的肺癌治疗策略[2,3]。
吉西他滨(GEM)是一种常用的化疗药物,广泛用于NSCLC的治疗,然而吉西他滨抑制NSCLC的作用机制尚不完全清楚。既往研究发现,NSCLC患者接受吉西他滨化疗后,外周血中的循环肿瘤细胞(circulating tumor cells, CTCs)数量明显下降,提示吉西他滨对肺癌微转移具有抑制作用[4]。肿瘤细胞的迁移和侵袭能力是发生转移的重要条件,本研究拟探索吉西他滨影响肺癌细胞迁移和侵袭的分子机制。
1 材料与方法
1.1 实验材料
人非小细胞肺癌细胞系A549购自ATCC(American Type Culture Collection,Manassas,VA,USA),细胞冻存于-196 ℃液氮中。
1.2 主要试剂
10%新生小牛血清(美国Invitrogen公司);RPMI 1640培养基(美国Sigma公司);胰蛋白酶(中国宝信生物公司);EDTA(中国北京鼎国公司);DMSO(美国Sigma公司);MTT、RnaseA、碘化丙啶(PI)(美国sigma公司);Annexin Ⅴ-FITC凋亡检测试剂盒(美国BD Bioscience公司);吉西他滨(法国礼来公司);肝细胞生长因子(HGF,美国Sigma公司);人p-cMET兔单克隆抗体、人cMET兔单克隆抗体、β-actin鼠单克隆抗体(美国Santa Cruz Biotechnology);辣根过氧化物酶标记的鼠IgG抗体、辣根过氧化物酶标记的兔IgG抗体(美国Thermo Fisher Scientific,Inc.);其他常规试剂(分析纯)。
1.3 主要仪器
超净工作台(中国天津泰斯特公司);二氧化碳培养箱(美国FORMA公司);电子天平(瑞士梅特勒-托利多公司);荧光显微镜(日本OLYMPUS公司);紫外分光光度计(日本岛津公司);台式高速离心机、倒置生物显微镜、光学显微镜及成像系统(德国Leica公司)、图像信号采集与分析系统(均购自德国Leica公司);冷冻高速离心机(美国Berkman公司);NanoDrop ND-1000分光光度计(美国NanoDrop公司);FASCalibar流式细胞仪(美国FALS CALIBAR BD公司);高通量多功能微板测试系统(德国BMG公司);超声破碎仪VCX500(美国Sonics公司);垂直电泳系统SE260(美国Amersham);水平电泳仪DYCZ-31N、湿法蛋白电转印系统DYCZ-40D(中国北京六一仪器厂);GBOX-HR全自动凝胶成像分析系统(英国SYNGENE公司);6孔细胞培养板(美国Corning,Lowell,MA)。
1.4 实验方法
1.4.1 MTT法检测细胞增殖活力 A549细胞复苏后接种于96孔细胞培养板中,取对数生长期的细胞。A549细胞分别加入加入不同浓度的吉西他滨(0,25,50,75 nmol/L)作用24,48,72,96 h,然后检测OD值;培养结束前4 h,向每孔细胞加入MTT溶液20 μl;弃去培养液,每孔细胞加入150 μl的DMSO,震荡10 min,使甲瓒结晶充分溶解;POLARstar+OPTIMA多功能荧光酶标仪上检测OD值(波长490 nm),以只加培养液的3孔为空白对照组,实验共重复3次。
1.4.2 流式细胞仪检测细胞周期 根据MTT实验结果,确定50 nmol/L为吉西他滨的实验浓度。取对数生长期的A549细胞,接种于6孔细胞培养板中,分为对照组和实验组(GEM 50 nmol/L组),每组4孔(n=4)。复苏冻存的细胞后,显微镜下使用细胞计数板计算细胞浓度,加入细胞培养基稀释调整,使得加样细胞终浓度为1×105/ml;将50 nmol/L的吉西他滨加入A549细胞,加入培养基的细胞作为对照组,孵育48 h;消化、洗涤并收集细胞;细胞中加入预冷的4 ℃、75%酒精溶液固定细胞;离心沉淀细胞,每孔细胞中加入RNase(10 mg/ml)100 μl,室温下孵育10 min;每孔细胞加入100 μg/ml的PI染料100 μl,37 ℃、避光条件下孵育30 min,然后开始流式细胞仪检测;每个样品取104个细胞,细胞中的PI在488 nm处被氩激光激发,其红色荧光通过630 nm滤光片收集,结果用B-D FACSort Cell Quest软件进行DNA分析。
1.4.3 流式细胞仪检测细胞凋亡 A549细胞复苏后,接种于6孔细胞培养板,孵育24 h;实验分为对照组、吉西他滨处理组(50 nmol/L),分别加入细胞培养基和50 nmol/L的吉西他滨,处理24 h后收集细胞;吸取20 ml结合缓冲液,加入60 ml去离子水稀释(稀释比例1 ∶4);PBS洗涤细胞两次,用250 μl结合缓冲液重新悬浮细胞,浓度为1×105/ml;移取100 μl细胞悬液,加入到5 ml流式细胞管中,再向每管中加入5 μl Annexin Ⅴ/FITC和5 μl的PI(20 μg/ml),避光混匀,标记15 min。对照组不加Annexin Ⅴ作校正因子;反应管中加入400 μl PBS缓冲液,流式细胞仪上机检测,光源为488 nm氩离子激光器,FITC受激发后发绿色荧光,PI受激发后发出红色荧光,随机软件分析检测结果。
1.4.4 细胞迁移实验 Transwell在带有8 μm炭膜6孔细胞培养板中浸泡1 h;胰酶消化细胞后,使用不含血清的培养基漂洗2次,计数后配成细胞悬液;每孔加入100 μl细胞悬液(0.9×105细胞/孔);下腔室中加入含有10%胎牛血清的培养基作为刺激因子,37 ℃培养箱中孵育24 h;取出Transwell用PBS漂洗2遍,5%戊二醛固定,4 ℃;PBS冲洗2遍,加入0.1%结晶紫染色,室温下放置30 min;PBS漂洗2遍后用炭刷去除上表面细胞;镜下观察、照相并记录。
1.4.5 细胞侵袭实验 取300 μl无血清培养基,加入30 μl Matrigel并混匀(冰浴上操作),加入上室各100 μl;放入37 ℃培养箱中孵育5 h;胰酶消化细胞,无血清培养基漂洗3次,计数后配成细胞悬液;用无血清培养基洗Matrigel 1次;每孔加入100 μl细胞悬液;下腔室中加入600 μl无血清条件培养基,37 ℃培养箱中孵育24 h;取出Transwell用PBS漂洗2遍,5%戊二醛固定,4 ℃;PBS漂洗2遍后加入0.1%结晶紫染色,室温下放置30 min;PBS漂洗2遍,用炭刷去除那些未能通过小孔的细胞;侵袭的细胞被固定、染色并计数。
1.4.6 免疫蛋白印迹(Western blot) 收集各组细胞,置入RIPA细胞裂解液中提取细胞总蛋白,分光光度计测定OD260 nm与OD280 nm,根据OD260 nm/OD280 nm值计算蛋白质的浓度。组装好制胶模具,配制分离胶和堆积胶,用25 μl微量加样器向凝胶孔中加样,开始电泳。电泳结束凝胶加入考马斯亮兰染色液,37 ℃摇床上摇动染色30 min,37 ℃摇动脱色4 h。将电泳后的凝胶浸泡入转移缓冲液中,平衡5 min,切除多余部分,进行蛋白转移。人p-cMET和cMET兔单克隆抗体(1 ∶500稀释)和β-actin鼠单克隆抗体(1 ∶500稀释)孵育于培养膜上过夜,随后使用辣根过氧化物酶标记的兔和鼠的IgG抗体。加入5%脱脂奶粉封闭液室温下振荡1-2 h,TBS洗膜3次,每次5 min。将膜放入塑料杂交袋,加入5%BSA/TBS稀释的一抗,室温下摇动1 h,4 ℃过夜;弃一抗,加入辣根过氧化物酶(HRP)标记的抗兔IgG二抗(1 ∶500稀释),室温下摇动2 h;弃二抗,TBS缓冲液洗膜5 min,洗掉膜上的Tween20;按1 ∶1比例将A、B发光液在暗室内混合,取出NC膜,吸去TBS液;将NC膜放入玻璃皿中,加入已配好的化学发光底物,置于Syngene G Box凝胶成像仪的暗箱中拍照。应用美国ImageJ软件分析,计算每个条带的积分光密度(optic density,OD)值,采用各目的蛋白与内参蛋白条带的积分光密度比值(targeted protein/β-actin)来表示目的蛋白的相对表达水平。
1.5 统计学分析
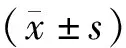
2 结果
2.1 吉西他滨对A549细胞增殖活力的影响
在细胞培养的4 d内,可以观察到不同浓度的吉西他滨对细胞增殖活力的抑制效应:25 nmol/L组OD值较0 nmol/L组无明显变化,其差异无统计学意义(P>0.05);与0 nmol/L和25 nmol/L相比,50 nmol/L组和75 nmol/L组OD值明显下降,其差异具有统计学意义(P<0.05),但50 nmol/L组与75 nmol/L组之间OD值差异无统计学意义(P>0.05,见表1)。
表1 吉西他滨对A549肺癌细胞增殖活力的影响 (OD值)
Table 1 Effects of gemcitabine on the cell proliferation ability of A549 cells (OD value)

2.2 吉西他滨对A549细胞周期的影响
流式细胞仪分析了对照组和吉西他滨组(50 nmol/L)细胞周期,结果显示,与对照组细胞相比,吉西他滨组G1/G0期细胞比例轻度下降(P>0.05),而S期细胞比例明显上升(P<0.05),G2/M期细胞比例也下降,但其差异无统计学意义(P>0.05,见表2,图1)。
表2 吉西他滨对肺癌细胞A549细胞周期的影响 (%)
Table 2 Effects of gemcitabine on the cell cycle of A549 lung cancer cells (%)
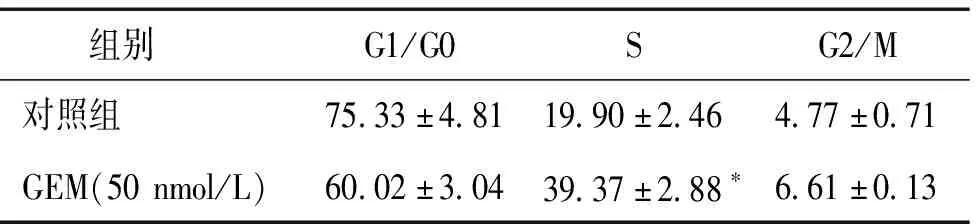
组别G1/G0SG2/M对照组75.33±4.8119.90±2.464.77±0.71GEM(50nmol/L)60.02±3.0439.37±2.88∗6.61±0.13
与对照组相比,*P<0.05

图1 吉西他滨对A549细胞周期的影响
2.3 吉西他滨对A549细胞凋亡的影响
流式细胞术检测结果表明,吉西他滨作用后A549细胞发生了明显的凋亡(见图2)。
与对照组比较,无论是早期凋亡细胞比例还是晚期凋亡细胞比例均明显升高(P<0.05,见表3)。
2.4 吉西他滨和HGF对A549细胞迁移和侵袭的影响
肿瘤迁移实验中,Transwell小室上铺8 μm的聚碳酸酯膜,上室种植肿瘤细胞,下室加入胎牛血清或某些特定的趋化因子,由于生长需要,肿瘤细胞会向营养成分高的下室运动,进入下室的细胞数量(即显微镜下被染色的细胞数量)可反映肿瘤细胞的迁移能力。A549细胞经过吉西他滨(50 nmol/L)处理后,显微镜下着色细胞数量明显减少,代表细胞迁移能力明显下降;当加入HGF(50 μg/L)后,显微镜下着色细胞数量明显增多,表示细胞的迁移能力明显升高;当A549细胞被吉西他滨(50 nmol/L)和HGF(50 μg/L)共同处理时,显微镜下着色细胞数量的变化提示,细胞迁移能力较单独吉西他滨处理组升高,低于单独加入HGF组,与对照组(未加入HGF和吉西他滨)无明显差异(见图3,4)。
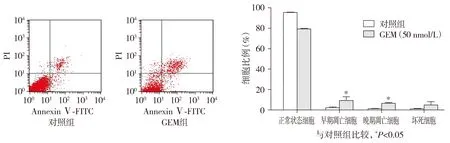
图2 吉西他滨对A549细胞凋亡的影响
表3 吉西他滨对肺癌细胞A549凋亡的影响 (%)
Table 3 Effects of gemcitabine on the apoptosis of A549 cells (%)

组别 早期凋亡晚期凋亡对照组2.21±0.781.32±0.25GEM50nmol/L组9.27±3.65∗6.63±0.65∗
与对照组相比,*P<0.05

图3 吉西他滨和HGF对A549细胞迁移和侵袭的影响 (×20)

与对照组相比,*P<0.05,与GEM组相比,#P<0.05
2.5 吉西他滨对A549细胞cMET蛋白的影响
A549肺癌细胞被吉西他滨处理后,其p-cMET表达水平明显下降,当加入HGF时其表达水平明显升高。与对照组相比,GEM组p-cMET蛋白水平明显下降(0.451 2±0.110 9vs0.107 6±0.008 2,P<0.05),HGF组p-cMET蛋白水平显著升高(0.451 2±0.110 9vs0.783 5±0.120 6,P<0.05)。而与对照组相比,吉西他滨组和HGF组的cMET蛋白表达水平无明显变化(P>0.05,见图5)。

与对照组相比,*P<0.05;与GEM组相比,#P<0.05
上述研究结果提示,吉西他滨可抑制A549肺癌细胞的迁移和侵袭能力,并负向调控HGF/c-MET通路。
3 讨论
肝细胞生长因子(hepatocyte growth factor, HGF)的编码基因位于第7号染色体q21区,包含18个外显子和17个内含子,大小约70 kb。蛋白水解酶作用于HGF前体,产生一个由96 kD的α链和34 kD的β链经二硫键连接组成的异二聚体,即为成熟的HGF蛋白。HGF蛋白含6个结构域,分别为氨基末端结构域、4个Kringle结构域及类丝氨酸蛋白酶结构域(SPH),在体内发挥多种生物学功能,能影响细胞生长,调节血管生成和免疫活性[5]。尤为重要的是,HGF可促进肿瘤细胞的增殖、转移和侵袭,HGF高表达是非小细胞肺癌患者表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)获得性耐药的主要原因之一[6]。
间质-上皮转化因子基因(mesenchymal-epithelial transition factor gene, cMET)属于原癌基因,位于人类第7号染色体的长臂(7q21-31),翻译一种受体酪氨酸激酶(receptor tyrosine kinase, RTK)。cMET蛋白的胞外区是配体识别部位,由Sema结构域、PSI结构域和IPT结构域组成,PSI结构域通过4个IPT结构域和跨膜螺旋相连。cMET蛋白是HGF的受体,这种RTK属于单向I型穿膜异二聚体蛋白,包含由二硫键连接的α-chain(50 kD)和β-chain(145 kD)[7]。β链穿过细胞膜,且包含细胞浆激酶结构域和结合位点。c-MET蛋白的胞内区具有酪氨酸激酶催化结构域,有酪氨酸激酶活性,其蛋白受体在多个器官的上皮细胞均有表达,包括肝脏、胰腺、前列腺、肾脏、肌肉和骨髓。HGF由间质细胞分泌,结合于胞外结构域后激活细胞内激酶,可磷酸化位于碳末端结合位点上的酪氨酸。
磷酸化cMET(phospho-cMET或p-cMET)可与生长因子结合受体2(growth factor receptor bound protein 2,Grb2)和Gab1(GRB2-associated-binding protein 1)结合,然后激活下游一系列信号通路,如PI3K/AKT和ERK/MAPK通路[8,9]。研究表明,p-cMET是一个预测肿瘤侵袭性、转移潜力和不良预后的重要因子[10,11]。近年来的研究不断证实,HGF/cMET通路在肿瘤细胞增殖、细胞运动、细胞侵袭、血管生成、靶向治疗耐药等方面发挥重要作用,靶向该通路是一种有潜力的抗肿瘤策略[12-16]。
吉西他滨是一种二氟核苷类抗代谢物抗癌药,是去氧胞苷的水溶性类似物,是核糖核苷酸还原酶的一种抑制性酶的替代物,这种酶在DNA合成和修复过程中及对脱氧核苷酸的生成是至关重要的。目前,吉西他滨广泛用于多种恶性肿瘤的治疗,如NSCLC、胰腺癌、乳腺癌、卵巢癌、膀胱癌、软组织肉瘤、淋巴瘤等。然而,吉西他滨对NSCLC侵袭和转移的作用机制尚不完全清楚。
此前的研究中发现,吉西他滨对非小细胞肺癌患者外周血中的循环肿瘤细胞(circulating tumor cells, CTCs)有明显的抑制作用[4]。A549肺癌细胞高表达EpCAM,同时CD45表达阴性,符合CTCs的免疫表型特征,所以在体外研究中可用来代表CTCs[4]。细胞增殖的体外实验中发现,吉西他滨对A549细胞增殖活力具有明确的抑制作用。当不同浓度的吉西他滨作用于A549肺癌细胞时,细胞生长曲线显示,25 nmol/L吉西他滨作用后,A549细胞生长无明显抑制;50 nmol/L吉西他滨作用后,细胞生长出现明显抑制;75 nmol/L吉西他滨作用后,细胞生长受到明显抑制,但50 nmol/L组和75 nmol/L组细胞相比,两者的细胞增殖活力无明显差异。由此可见,50 nmol/L和75 nmol/L的吉西他滨对A549细胞增殖活力有近似的抑制作用,因此在以下的实验中吉西他滨的用量均采用50 nmol/L。
吉西他滨属于细胞周期特异性药物,主要作用于S期。多项体外研究发现,吉西他滨作用于肿瘤细胞后,可使S期细胞比例升高。本研究中,流式细胞术检测发现,50 nmol/L的吉西他滨作用于A549细胞后,G1/G0期比例轻度下降,而S期细胞比例明显上升,G2/M期细胞比例轻度下降,即细胞周期在S期发生阻滞,这可以解释吉西他滨引起细胞增殖活力的下降。本研究还发现,50 nmol/L的吉西他滨可引起A549细胞发生凋亡,无论是早期凋亡细胞还是晚期凋亡细胞均明显增加。上述研究结果符合既往研究中吉西他滨的作用。
吉西他滨对A549细胞的增殖活力、细胞周期和凋亡具有明显的影响,对细胞迁移和侵袭是否也具有调节作用?本研究发现,吉西他滨(50 nmol/L)处理后,A549细胞的迁移力和侵袭力受到了明显抑制,当A549细胞仅加入HGF(50 μg/L)时,其迁移力和侵袭力明显增强,当被吉西他滨(50 nmol/L)和HGF(50 μg/L)共同处理时,迁移和侵袭细胞的计数较单纯吉西他滨处理组高,但低于单独加入HGF组的细胞。由此可见,吉西他滨不但抑制了A549细胞的迁移和侵袭能力,而且可逆转HGF诱导的细胞侵袭和迁移能力的上调。
既往的研究发现,HGF/cMET通路可直接影响肿瘤细胞的迁移和侵袭[17-19]。而吉西他滨既然能够抑制A549细胞的迁移和侵袭,可能对HGF/cMET通路也具有调控作用,本研究证实了这种推测。研究发现,吉西他滨(50 nmol/L)作用于NSCLC细胞系A549细胞后,p-cMET蛋白表达水平明显下降,如果仅加入HGF(50 μg/L)而不加吉西他滨时,p-cMET蛋白表达水平显著上升,而同时加入HGF和吉西他滨时,p-cMET蛋白表达水平明显低于单独加入HGF时。由此可见,吉西他滨对NSCLC的HGF/cMET通路有负向调节作用。另一项研究中,NSCLC患者接受吉西他滨治疗后,外周血CTCs数量下降,伴有HGF和p-cMET的水平明显下降[4]。上述研究提示,吉西他滨可通过靶向HGF/cMET通路来调节NSCLC肿瘤细胞的侵袭和微转移。有关吉西他滨调控HGF/c-MET通路的具体机制目前尚不清楚,有待于进一步研究阐明。
综上所述,吉西他滨对肺癌A549细胞的迁移和侵袭具有明显的抑制作用,而这种抑制作用可能是通过负调控HGF/cMET通路来实现的。
