沉默SPP1联合吉西他滨对胰腺癌细胞增殖、细胞周期、凋亡的影响
2021-07-22乌吉斯古楞张彤
乌吉斯古楞 张彤
胰腺癌是一种常见的侵袭性恶性肿瘤,是导致癌症相关死亡的主要原因之一[1]。在过去的几十年中,胰腺癌的临床结局并没有显著改善,平均存活率是5%[2]。吉西他滨是最常用的抗胰腺癌药物之一,然而目前的抗胰腺癌疗法仍不令人满意。研究表明,B7-H3基因的沉默联合吉西他滨能够抑制人胰腺癌细胞株Patu8988t生长[3]。分泌磷蛋白1(secreted phosphoprotein-1,SPP1)具有促进肝癌细胞生长的作用,下调SPP1导致肝癌细胞增殖受到抑制,细胞凋亡产生抗性[4]。SPP1在宫颈癌组织和细胞系中过表达,SPP1的下调可抑制HeLa细胞的增殖,诱导细胞凋亡并增加顺铂的化学敏感性[5]。然而沉默SPP1联合吉西他滨在胰腺癌细胞增殖、细胞周期、凋亡中的作用目前仍未可知。基于此,本研究利用小干扰RNA技术沉默SPP1表达,探讨沉默SPP1联合吉西他滨对胰腺癌细胞增殖、细胞周期、凋亡的影响。
1 材料与方法
1.1 细胞与试剂 胰腺癌PaTu 8988t细胞购自美国典型培养物保藏中心(American type culture collection,ATCC),Roswell Park Memorial Institute(RPMI)-1640培养基购自美国Gibco公司,吉西他滨购自美国礼来公司,si-con、si-SPP1购自上海吉玛制药技术有限公司,Lipofectamin 2000 转染试剂购自美国Invitrogen公司,细胞计数试剂盒8(cell counting Kit-8,CCK-8)购自日本Dojindo公司,抗SPP1、细胞周期蛋白D1(CyclinD1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase 3,c-Caspase-3)、P糖蛋白(P-glucoprotein,Pgp)、MDR1、β肌动蛋白(β-actin)抗体、辣根过氧化物酶偶联的二抗购自英国Abcam公司,碘化丙啶(propidium iodide,PI)购自美国Sigma-Aldrich公司,FITC Annexin V凋亡检测试剂盒购自美国BD公司。
1.2 细胞培养 胰腺癌PaTu 8988t细胞在RPMI-1640培养基中,其中包含10%胎牛血清、1.5 mmol/L左旋谷氨酸、100 U/ml青霉素、0.1 mg/ml链霉素,置于37℃、5% CO2培养箱中生长。
1.3 细胞转染与分组 收集对数生长期的胰腺癌PaTu 8988t细胞,接种在6孔板中,每孔1×105个细胞,融合至70%左右时,利用Lipofectamin 2000转染试剂将si-con、si-SPP1转染PaTu 8988t细胞。将PaTu 8988t细胞分为空白组(未经任何处理)、si-con组(转染si-con)、si-SPP1组(转染si-SPP1)、吉西他滨组(吉西他滨处理)、si-SPP1+吉西他滨组(转染si-SPP1和吉西他滨处理)。其中,转染时间为24 h,吉西他滨浓度为20 μmol/L[6],作用时间为24 h。
1.4 qPCR检测SPP1 mRNA表达 根据TRIzol试剂说明书的指导进行PaTu 8988t细胞中RNA分离。使用cDNA反转录试剂盒合成cDNA。引物由上海生工公司合成,如下:SPP1 5’-TTTGTTGTAAAGCTGCTTTTCCTC-3’(正向)和5’-GAATTGCAGTGATTTGCTTTTGC-3’(反向),内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 5’-TGCACCACCAACTGCTTAGC-3’(正向)和5’-GGCATGGACTGTGGTCATGAG-3’(反向)。qPCR遵循TaqMan基因表达检测方案进行。根据2-ΔΔCt计算SPP1 mRNA表达。
1.5 CCK-8检测细胞增殖 将PaTu 8988t细胞接种到96孔板,每孔3×105个细胞,在37℃、5% CO2培养箱中分别孵育24 h、48 h、72 h。之后根据CCK-8检测试剂盒说明书,每孔加入CCK-8试剂,酶标仪检测孵育4 h后的吸光度(A)值,检测波长为450 nm。
1.6 Western blot检测SPP1、CyclinD1、c-Caspase-3、Pgp和MDR1蛋白表达 使用RIPA缓冲液中提取PaTu 8988t细胞的蛋白,经BCA蛋白检测试剂盒定量后,进行10%的SDS-PAGE,并转至聚偏二氟乙烯膜上。在室温下用5%脱脂牛奶封闭,1 h后将SPP1、CyclinD1、c-Caspase-3、Pgp、MDR1和参照β-actin(1∶1 000 稀释)与膜4℃孵育过夜。次日,将膜与辣根过氧化物酶偶联的二抗室温孵育1 h。通过增强的化学发光试剂盒和来分析SPP1、CyclinD1、c-Caspase-3、Pgp和MDR1蛋白表达。
1.7 流式细胞术检测细胞周期 根据Bundscherer等[7]的方法进行细胞周期检测,收集1×106个细胞,室温下用无水乙醇固定30 min,加入1 mg/ml RNase A,孵育30 min后,加入100 μg/ml PI,通过流式细胞仪分析G0/G1期、S期和G2/M期的细胞数量。
1.8 Annexin V染色分析细胞凋亡 严格按照FITC Annexin V凋亡检测试剂盒的说明书来检测细胞凋亡,将PaTu 8988t细胞重悬于结合缓冲液之中,浓度为1×106个细胞/ml。将5 μl FITC和5 μl PI添加到100 μl细胞悬液中,然后在黑暗中孵育15 min,加入400 μl的结合缓冲液,通过流式细胞仪进行细胞凋亡分析。
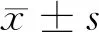
2 结果
2.1 胰腺癌PaTu 8988t细胞沉默SPP1基因效率检测 qPCR和Western blot检测结果表明,与空白组比较,si-SPP1组胰腺癌PaTu 8988t细胞中SPP1 mRNA和SPP1蛋白表达量明显降低,差异有统计学意义(P<0.05)。见表1,图1。

表1 沉默SPP1基因后胰腺癌PaTu 8988t细胞中SPP1 mRNA和SPP1蛋白

图1 Western blot检测沉默SPP1基因后胰腺癌PaTu 8988t细胞中SPP1蛋白表达
2.2 沉默SPP1基因联合吉西他滨对胰腺癌细胞增殖的影响 CCK-8检测显示,与si-con组比较,si-SPP1组和吉西他滨组胰腺癌PaTu 8988t细胞24 h、48 h、72 h的细胞活力显著降低(P<0.05);与si-SPP1组或吉西他滨组比较,si-SPP1+吉西他滨组胰腺癌PaTu 8988t细胞24 h、48 h、72 h的细胞活力显著降低(P<0.05)。见表2。

表2 沉默SPP1基因联合吉西他滨对胰腺癌细胞活力的影响
2.3 沉默SPP1基因联合吉西他滨对胰腺癌细胞周期的影响 对CyclinD1蛋白表达和细胞周期的检测结果表明,与si-con组比较,si-SPP1组和吉西他滨组胰腺癌PaTu 8988t细胞的CyclinD1蛋白表达量明显减少(P<0.05),G0/G1期细胞百分比明显增加(P<0.05),S期细胞百分比显著减少(P<0.05),G2/M期细胞百分比无明显变化(P>0.05);与si-SPP1组或吉西他滨组比较,si-SPP1+吉西他滨组胰腺癌PaTu 8988t细胞的CyclinD1蛋白表达量明显减少(P<0.05),G0/G1期细胞百分比明显增加(P<0.05),S期细胞百分比显著减少(P<0.05),G2/M期细胞百分比无明显变化(P>0.05)。见图2,表3。

图2 Western blot检测沉默SPP1基因联合吉西他滨对胰腺癌细胞CyclinD1蛋白的表达

表3 沉默SPP1基因联合吉西他滨对胰腺癌细胞周期和CyclinD1蛋白表达的影响
2.4 沉默SPP1基因联合吉西他滨对胰腺癌细胞凋亡的影响 对c-Caspase-3蛋白表达和细胞凋亡的检测结果发现,与si-con组相比较,si-SPP1组和吉西他滨组胰腺癌PaTu 8988t细胞的c-Caspase-3蛋白表达量和细胞凋亡率明显增加,差异有统计学意义(P<0.05);与si-SPP1组或吉西他滨组相比较,si-SPP1+吉西他滨组胰腺癌PaTu 8988t细胞的c-Caspase-3蛋白水平和细胞凋亡率明显升高,差异有统计学意义(P<0.05)。见表4,图3。

表4 沉默SPP1基因联合吉西他滨对胰腺癌细胞凋亡和c-Caspase-3蛋白表达的影响

图3 Western blot检测沉默SPP1基因联合吉西他滨对胰腺癌细胞c-Caspase-3蛋白的表达和流式细胞术检测细胞凋亡;A Western blot检测沉默SPP1基因联合吉西他滨对胰腺癌细胞c-Caspase-3蛋白的表达;B 流式细胞术检测细胞凋亡情况
2.5 沉默SPP1基因联合吉西他滨对胰腺癌细胞Pgp和MDR1蛋白表达的影响 Western blot检测结果表明,与si-con组比较,si-SPP1组和吉西他滨组胰腺癌PaTu 8988t细胞中Pgp和MDR1蛋白表达量明显减少(P<0.05);与si-SPP1组或吉西他滨组比较,si-SPP1+吉西他滨组胰腺癌PaTu 8988t细胞的Pgp和MDR1蛋白水平明显降低(P<0.05)。见表5,图4。

表5 沉默SPP1基因联合吉西他滨对胰腺癌细胞Pgp和MDR1蛋白表达的影响

图4 Western blot检测沉默SPP1基因联合吉西他滨对胰腺癌细胞Pgp和MDR1蛋白表达的影响
3 讨论
目前,胰腺癌的发病机制尚不清楚,预后仍然不佳。胰腺的解剖位置与许多重要器官、主动脉和静脉密切相关。因此,大部分胰腺癌患者(80%~85%)存在邻近器官或远处转移,需要手术切除[8]。目前,核苷类似物吉西他滨被推荐为治疗晚期胰腺癌的一线药物[9]。吉西他滨可作为单一药物或与其他化疗药物联合使用来治疗胰腺癌,但由于耐药性的出现,其成功率很低[10]。因此,迫切需要发展针对胰腺癌的化学疗法。本研究评估沉默SPP1联合吉西他滨对胰腺癌细胞增殖、细胞周期、凋亡的影响,发现二者在胰腺癌细胞中具有抗增殖,阻滞周期和诱导凋亡活性,值得注意的是,沉默SPP1与吉西他滨联用的效果更显著。表明沉默SPP1与吉西他滨联合使用可能是针对这种胰腺癌的有效联合治疗方案。
SPP1也被称为骨桥蛋白,是一种细胞外基质蛋白,参与生物矿化和钙化的控制[11-13]。SPP1由6个内含子和7个外显子组成,编码在4号染色体上(4q13)[14],可从各种类型的细胞(包括巨噬细胞,内皮细胞和破骨细胞)中分泌出来[15]。SPP1涉及多个生理和病理过程,在肿瘤发生和转移过程中与细胞生长、粘附和侵袭显著相关。SPP1在多种癌症的进展和转移中起重要作用。在一项关于卵巢癌的研究中,发现SPP1在卵巢癌组织中高表达并促进卵巢癌进展[16]。Pio等报道了SPP1在乳腺癌细胞中被上调,并通过激活WNK-1和pras40相关通路促进了细胞的迁移和干细胞样行为[17],SPP1在结直肠癌、胶质母细胞瘤组织中也有过表达,且与预后不良有关[18,19]。上述研究表明,SPP1可能是人类癌症潜在的生物标志物或新的治疗靶点。本研究发现,沉默SPP1明显降低胰腺癌PaTu 8988t细胞的细胞活力、CyclinD1表达和S期细胞百分比,显著提高c-Caspase-3蛋白表达量、细胞凋亡率、G0/G1期细胞百分比,而对G2/M期细胞百分比无明显影响,表明沉默SPP1具有抗胰腺癌细胞增殖、促进细胞周期阻滞和诱导细胞凋亡的作用,与单独使用吉西他滨的作用效果相同,而二者联用的效果显著优于沉默SPP1或吉西他滨单独使用。
吉西他滨对胰腺癌的治疗作用已被广泛证明,然而吉西他滨发挥作用的分子基础研究尚不充分[20]。Pgp和MDR1是多药耐药基因,在肿瘤的多药耐药中起着重要作用[21]。MDR1广泛表达,可能是人类处理药物最重要的ABC转运蛋白之一,已被确定为多药耐药性的主要原因。Pgp是由1 280个氨基酸组成的170-kDa ABC转运蛋白,是由人类MDR1基因编码的能量依赖性药物流出泵[22]。根据报道,阿尔及利亚蜂胶通过抑制Pgp活性,诱导胰腺癌细胞凋亡,增强细胞周期阻滞,来增强阿霉素介导的抗人胰腺癌PANC-1细胞的抗癌作用[23]。MDR1的过表达有助于增强了胆囊癌细胞对吉西他滨的化学耐药性,而微小RNA(microRNA,miR)-218-5p通过消除PRKCE诱导的MDR1/Pgp上调来改善吉西他滨的疗效[24]。本实验中,沉默SPP1和吉西他滨单独或联合使用均显著降低PaTu 8988t细胞的Pgp和MDR1蛋白表达量,提示抑制Pgp和MDR1蛋白表达可能是二者在胰腺癌中发挥抗肿瘤活性的重要途径。
综上所述,沉默SPP1或吉西他滨可以明显抑制胰腺癌细胞的增殖,诱导细胞凋亡,并促进细胞周期阻滞,二者联用的效果更优,其作用机制与抑制Pgp和MDR1蛋白表达有关。本研究也表明,沉默SPP1基因与吉西他滨联合使用似乎是治疗胰腺癌患者的一种有吸引力的选择。
