miR-5047通过靶向下调TIPE3表达抑制前列腺癌细胞迁移和增殖
2020-05-09张志敏马俊刚
王 斌,肖 何,张志敏,罗 佳,金 丰,王 阁,马俊刚
(陆军军医大学大坪医院肿瘤中心,重庆 400042;*通讯作者,E-mail:mjg31403699@sohu.com)
前列腺癌是男性生殖系统最常见的恶性肿瘤,同时也是美国男性群体中发病率第一、死亡率第二的恶性肿瘤[1]。前列腺癌虽然不是我国男性群体发病率第一的恶性肿瘤,但其发病率和死亡率逐年增加[2]。前列腺癌治疗方式主要包括手术治疗和雄激素阻断治疗,但由于前列腺癌起病较隐匿,发现时多是晚期,因而预后并不理想[3]。筛选前列腺癌的特异性生物标志物和分子靶向治疗位点,对前列腺癌的诊断和诊治具有重要临床意义。微小RNA(microRNA,miRNA)是一类由19-25个核苷酸组成的内源单链RNA分子,是一种高度保守的RNA[4]。miRNA虽然不能编码蛋白,但可通过特异性结合靶基因信使RNA(mRNA)3′非翻译区(UTR),抑制靶基因mRNA的翻译或者直接导致其降解,从而下调靶基因的表达[5]。近年来的研究表明,miRNA在细胞的各种生命活动中发挥着重要调控作用,同时参与疾病的发生、发展[6]。在前列腺癌、膀胱癌、胰腺癌等多种肿瘤中均存在miRNA的异常表达[4]。miRNA通过调控靶基因的表达,抑制或促进肿瘤细胞的恶性生物学行为[7]。最新的研究表明,miR-5047在宫颈癌组织和细胞系中表达明显降低,可抑制宫颈癌细胞的迁移、化疗敏感性[8]。miR-5047在其他肿瘤如前列腺癌中的表达和生物学功能并不清楚。本研究通过检测miR-5047在前列腺癌细胞株中的表达,在表达量最少的前列腺癌细胞中采用慢病毒过表达miR-5047,观察miR-5047对前列腺癌细胞迁移和增殖能力的影响,通过生物学信息学技术和双荧光素酶报告基因实验验证miR-5047的作用机制。
1 材料与方法
1.1 细胞株与主要试剂
KSFM培养基、RPMI1640培养基和胎牛血清购于美国Gibco公司;前列腺癌细胞株(C4-2B、LNCaP、DU-145、PC-3)和正常前列腺滤泡细胞(RWPE-1)购于上海信然生物技术有限公司;四甲基偶氮唑蓝(MTT)试剂盒购于美国Sigma公司;Trizol试剂盒购自美国Invitrogen公司;慢病毒Lenti-miR-NC、Lenti-miR-5047、miR-5047模拟物、miR-NC模拟物、3′UTR双荧光素酶质粒(野生型和突变型)购于上海吉玛生物科技有限公司;逆转录试剂盒和实时定量聚合酶链反应(RT-qPCR)试剂盒购于日本TaKaRa公司;Lipofectamine 3000转染试剂购于美国Thermo Fisher Scientific公司;双荧光素酶报告基因检测试剂盒购于美国Promega公司;一抗MDM2、p-AKT、Tpl2、GAPDH、TIPE3购于美国Abcam公司;二抗(羊抗兔)购于北京中杉金桥生物技术有限公司;超敏ECL发光试剂盒购于美国Thermo公司。
1.2 细胞培养和感染
C4-2B、LNCaP、DU-145、PC-3细胞培养在含1 g/L青霉素、1 g/L链霉素、10%胎牛血清的RPMI1640培养基,RWPE-1细胞培养在含1 g/L青霉素、1 g/L链霉素、10%胎牛血清的KSFM培养基,放在37 ℃、5% CO2培养箱中培养。感染期1 d前,在6孔板中接种对数生长期C4-2B细胞,细胞汇合度达到60%时即可慢病毒感染,按照病毒感染复数(MOI)=20,使用慢病毒Lenti-miR-NC、Lenti-miR-5047感染C4-2B细胞,分别命名为实验组和对照组。感染后24 h,更换培养基。
1.3 RT-qPCR检测miR-5047和TIPE3 mRNA的表达量
胰酶消化、离心、收集细胞后,Trizol法提取前列腺癌细胞株(C4-2B、LNCaP、DU-145、PC-3)和正常前列腺滤泡细胞(RWPE-1)总RNA,取500 ng总RNA逆转录为cDNA。根据RT-qPCR试剂盒说明书,分别检测miR-5047和TIPE3 mRNA的相对表达量。RT-qPCR反应参数:95 ℃预变性5 min,95 ℃变性10 s,62 ℃退火30 s,72 ℃延伸30 s,共35个循环。以U6作内参分析miR-5047的相对表达,以GAPDH作内参分析TIPE3 mRNA的相对表达。引物序列见表1。使用2-ΔΔCt方法分析miR-5047和TIPE3 mRNA的相对表达。
表1 RT-qPCR引物序列
Table 1 RT-qPCR primer sequences
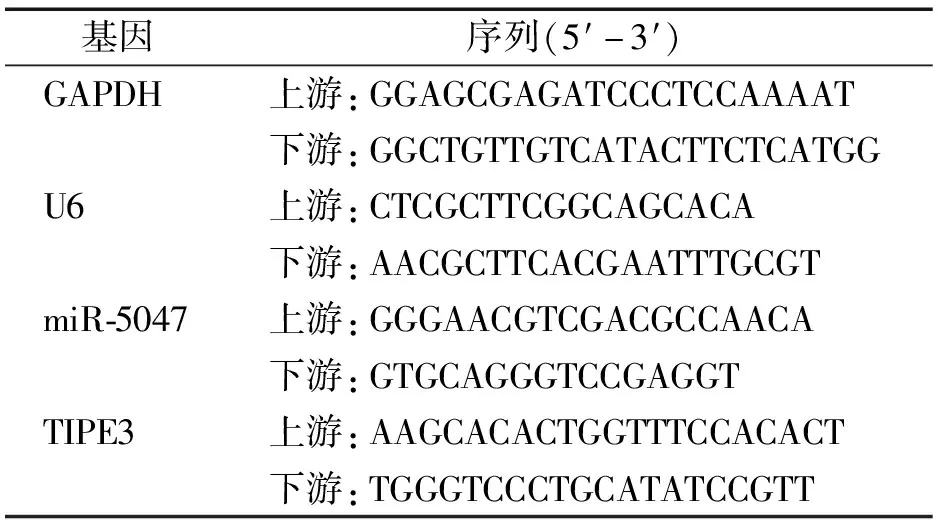
基因序列(5′-3′) GAPDH上游:GGAGCGAGATCCCTCCAAAAT下游:GGCTGTTGTCATACTTCTCATGG U6上游:CTCGCTTCGGCAGCACA下游:AACGCTTCACGAATTTGCGT miR-5047上游:GGGAACGTCGACGCCAACA下游:GTGCAGGGTCCGAGGT TIPE3上游:AAGCACACTGGTTTCCACACT下游:TGGGTCCCTGCATATCCGTT
1.4 细胞划痕实验检测感染C4-2B细胞的迁移能力
在新的6孔板背后划直线,分别收集感染后的两组细胞,采用无血清的RPMI1640培养基重悬,调整细胞密度为1×106个/孔。用10 μl移液枪枪头在培养板底部进行划痕,划痕路径与培养板背后的直线垂直。划线结束后,使用PBS溶液洗2次,分别于0 h和24 h在倒置显微镜下拍照,测量划痕宽度,迁移率=(0 h宽度-24 h宽度)/24 h宽度×100%。
1.5 MTT法检测感染C4-2B细胞的增殖能力
采用MTT法检测两组细胞于转染后1,2,3,4,5 d的增殖能力。分别调整感染后的两组细胞密度,取200 μl/孔接种于96孔板,保证每孔细胞数量为2 000个,在培养箱中培养。每孔加入20 μl MTT试剂(浓度为5 g/L),孵育4 h后吸去上清,每孔加入130 μl二甲基亚砜,振荡20 min后,用酶标仪测定450 nm处的吸光度(A495)值。
1.6 miR-5047与TIPE3 mRNA靶向关系预测
基于microRNA.org数据库对miR-5047进行靶基因预测,筛选并确认TIPE3基因3′UTR存在与miR-5047配对结合的位点。
1.7 双荧光素酶报告基因检测
制备对数生长期C4-2B细胞悬液,接种于新的6孔板。当细胞汇合度达到50%,将3′UTR双荧光素酶质粒(野生型、突变型)与miRNA模拟物(miR-NC、miR-5047)两两组合共转染,设立4个共转染组:野生型+miR-NC组、突变型+miR-NC组、野生型+miR-5047组、突变型+miR-5047组,分别转染至C4-2B细胞,具体操作根据Lipofectamine 3000转染试剂说明书操作。细胞转染48 h后按双荧光素酶报告基因检测试剂盒说明书进行荧光素酶活性检测,荧光素梅活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.8 Western blot检测靶基因的表达
分别收集感染后的两组细胞,加入含1%苯甲基磺酰氟的RIPA裂解液提取细胞总蛋白。蛋白浓度检测试剂盒检测每组蛋白浓度,在十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后,转移至聚偏氟乙烯膜,在5%脱脂牛奶中封闭1.5 h。分别孵育一抗TIPE3(稀释比为1 ∶3 000)、MDM2(稀释比为1 ∶2 000)、p-AKT(稀释比为1 ∶1 000)、Tpl2(稀释比为1 ∶1 000)和GAPDH一抗(稀释比均为1 ∶2 000),在4 ℃下孵育过夜。TBST溶液洗膜后,孵育二抗(稀释比为1 ∶10 000)2.5 h。TBST溶液洗膜后,滴加超敏ECL发光试剂,在凝胶成像系统中曝光、显影。
1.9 统计学分析
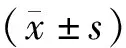
2 结果
2.1 前列腺癌细胞株中miR-5047的表达
RT-qPCR结果显示,前列腺癌细胞株(C4-2B、LNCaP、DU-145、PC-3)和正常前列腺滤泡细胞(RWPE-1)中miR-5047的相对表达分别为0.16±0.03,0.55±0.06,0.85±0.04,0.31±0.05和1.00±0.02,前列腺癌细胞株中miR-5047的相对表达明显低于正常前列腺滤泡细胞(P<0.05,见图1)。PC-3细胞和C4-2B细胞中miR-5047的表达最低(P<0.01)。与PC-3细胞相比,C4-2B细胞中miR-5047的表达更低(P<0.01),因而选择C4-2B细胞进行后续实验。
与RWPE-1细胞比较,*P<0.05,**P<0.01
2.2 感染后两组细胞中miR-5047的表达
RT-qPCR结果显示,对照组和实验组C4-2B细胞中miR-5047的相对表达分别为1.00±0.03和8.14±0.52,实验组miR-5047的相对表达是对照组的19.61%,差异有统计学意义(t=13.60,P<0.01)。
2.3 高表达miR-5047对C4-2B细胞迁移能力的影响
对照组和实验组细胞迁移率分别为(68.61±5.94)%和(29.36±6.54)%。与对照组比较,实验组穿膜C4-2B细胞迁移率明显降低,差异有统计学意义(t=4.36,P<0.01,见图2),高表达miR-5047可抑制前列腺癌C4-2B细胞的迁移能力。

图2 高表达miR-5047对C4-2B细胞迁移能力的影响
2.4 高表达miR-5047对C4-2B细胞增殖能力的影响
MTT法结果显示,实验组C4-2B细胞在感染后第2-5天的A值均低于对照组,差异均有统计学意义(P<0.05,见图3),表明高表达miR-5047可抑制前列腺癌C4-2B细胞的增殖能力。

与相应时点对照组相比,*P<0.05,**P<0.01
2.5 miR-5047与TIPE3 mRNA靶向关系预测
基于microRNA.org数据库对miR-5047进行靶基因预测,TIPE3基因3′UTR存在与miR-5047配对结合的位点,构建3′UTR双荧光素酶质粒(TIPE3-WT、TIPE3-MUT),见图4。
2.6 双荧光素酶报告基因检测
双荧光素酶报告基因检测显示,与突变型+miR-5047组比较,野生型+miR-5047组荧光素酶活性降低(P<0.01);与突变型+miR-NC组,野生型+miR-NC组荧光素酶的活性无影响(P>0.05,见图5),提示miR-5047可靶向结合TIPE3 mRNA。

图4 TIPE3基因3′UTR与miR-5047配对结合位点及TIPE3-MUT突变序列
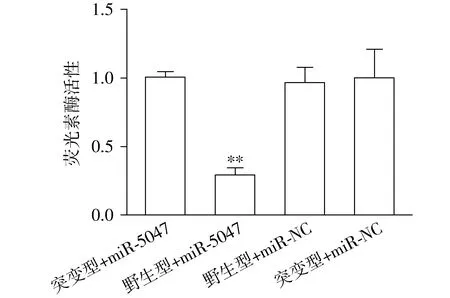
与突变型+miR-5047组相比,**P<0.01
2.7 高表达对miR-5047对TIPE3 mRNA表达的影响
RT-qPCR结果显示,高表达miR-5047后实验组C4-2B细胞中TIPE3 mRNA的相对表达明显低于对照组(0.21±0.04vs1.00±0.06),差异有统计学意义(t=16.96,P<0.01),表明高表达miR-5047可有效下调TIPE3 mRNA的相对表达。
2.8 TIPE3和AKT信号通路蛋白的表达水平
Western blot结果表明,实验组C4-2B细胞中,TIPE3蛋白表达降低,AKT信号通路蛋白MDM2、p-AKT、Tpl2表达明显降低(见图6),提示AKT信号通路转导被干扰。

图6 高表达miR-5047对TIPE3蛋白和AKT信号通路蛋白表达的影响
3 讨论
深入探讨前列腺癌发生、发展的分子机制对前列腺癌的早期诊断和靶向治疗具有重要意义[9]。研究表明,miRNA可在转录后水平调控靶基因的表达,影响细胞的增殖、分化、凋亡、衰老、迁移等各项生命活动[10]。越来越多的miRNA被发现在前列腺癌组织中表达异常,其表达水平与患者临床分期、分级、预后有关[11]。Fan等[12]研究表明,miR-301a-3p在人前列腺癌组织和细胞株中表达明显上调,过表达miR-301a-3p可明显促进前列腺癌细胞的增殖和侵袭能力。Wang等[13]研究表明,miR-488在前列腺癌组织中的表达低于正常前列腺组织,miR-488的过表达可抑制前列腺癌细胞的增殖和糖酵解。目前,国内外对miR-5047的报道研究很少,有报道显示,miR-5047在宫颈癌组织和细胞系中呈低表达,在宫颈癌细胞中发挥抑癌基因作用[8]。miR-5047对其他肿瘤如前列腺癌细胞生物学行为的影响和作用机制尚不明确。
本研究RT-qPCR检测显示,与正常前列腺滤泡细胞相比,miR-5047在前列腺癌细胞株中的表达明显降低,提示miR-5047可能在前列腺癌中发挥抑癌基因作用。本研究进一步通过慢病毒感染前列腺癌C4-2B细胞,促进miR-5047的表达。高表达miR-5047后,前列腺癌C4-2B细胞的迁移能力和增殖能力被明显抑制,进一步表明miR-5047在前列腺癌的发生、发展过程中发挥抑癌基因作用。本研究基于microRNA.org数据库对miR-5047进行靶基因预测,肿瘤坏死因子α诱导蛋白8样因子3(tumor necrosis factor-α induced protein 8 like 3,TIPE3)基因3'UTR存在与miR-5047配对结合的位点。双荧光素酶报告基因实验进一步证明miR-5047可靶向结合TIPE3基因3'UTR。TIPE3蛋白是一种磷脂酰肌醇转运蛋白,属于TIPE家族分子[14]。TIPE3蛋白包含7个高度保守的α螺旋结构,主要由肿瘤坏死因子-α诱导产生[15]。TIPE3在非小细胞肺癌、乳腺癌、胃癌、鼻咽癌等多种肿瘤组织和细胞系中高表达,TIPE3可促进肿瘤细胞的增殖和转移,与肿瘤患者的不良预后和恶性进展有关[16,17]。RT-qPCR和Western blot显示,高表达miR-5047后,TIPE3基因在mRNA和蛋白水平的表达降低。有研究显示,TIPE3蛋白主要通过激活AKT信号通路,发挥促进肿瘤恶性进展的作用[18]。本研究通过Western blot发现,TIPE3蛋白表达降低后,p-AKT、MDM2、Tpl2等AKT信号通路蛋白的表达降低,提示AKT信号通路转导被抑制。miR-5047在前列腺癌组织中的表达尚不明确,本研究下一步将通过收集临床前列腺癌组织,分析miR-5047表达量与前列腺癌临床数据的相关性。
综上所述,本研究表明miR-5047在前列腺癌细胞株中明显低表达,miR-5047可负向调控前列腺癌细胞的迁移和增殖能力,其分子机制是miR-5047通过靶向抑制TIPE3基因的表达,干扰AKT信号通路信号通路的转导。miR-5047可能成为前列腺癌的诊断和治疗的候选分子,为前列腺癌发生、发展的机制研究奠定了一定的实验基础。
