结直肠癌患者血浆外泌体中miRNA-23b的表达及其临床意义
2020-05-08闵贝贝朱莉曾娟
闵贝贝 朱莉 曾娟
结直肠癌(colorectal cancer,CRC)作为常见消化道恶性肿瘤之一,其发病率和病死率均位居我国所有恶性肿瘤的第5 位,疾病负担相当严重[1]。近年来,随着外科手术、放化疗、分子靶向治疗及免疫治疗的不断进步,从一定程度改善了患者的治疗效果,但CRC 的整体预后仍不能令人满意[2]。研究[2-4]表明,对患者进行预后分层,制定个体化的治疗策略,可有效改善患者的临床结局。最近,外泌体作为肿瘤分子标志物的潜力逐渐受到重视。作为一种直径约为30 ~150 nm 的微小膜泡,其内包裹有miRNAs,lncRNA 和蛋白质等多种生物活性因子,广泛参与肿瘤恶性进程[5-7]。研究证实,外泌体“独特”的被膜结构,可保护内含物不受膜外微环境中各种因子的影响而处于较稳定的状态[8]。鉴于上述优点,血浆外泌体中miRNAs 的检测已成为一种新兴、可靠的生物标志物用于协助肿瘤的早期诊断和预后评估[9-10]。miRNA-23b(miR-23b)作为一个微小非编码RNA,已被证实在CRC 的进展及转移中扮演着重要角色[11-15]。然而,关于其在血浆外泌体中的表达及其临床预后价值尚无报道。基于此,本研究拟检测miR-23b 在CRC 患者血浆外泌体中的表达水平,并分析其与患者临床病理学特征和预后的关系。
1 对象与方法
1.1 研究对象选取2014年1月至2014年12月于武汉市中心医院接受手术治疗的CRC 患者为研究对象,其中,纳入标准:(1)所有病例均经组织病理学确诊为结直肠癌;(2)术前未接受过任何抗肿瘤治疗;(3)具有完整的临床病理资料。排除标准:(1)伴随有其他恶性肿瘤;(2)未行根治性手术;(3)感染或妊娠。入院后采集3 mL外周静脉血样本于抗凝管中,并收集同期25例健康体检者的3 mL血样本作为对照。总共65例CRC 患者纳入本研究,患者的所有临床病理信息从电子病历系统中进行采集。两组人群的一般资料对比见表1,结果显示,各组基线资料比较差异均无统计学意义(均P>0.05),具有可比性。在纳入的肿瘤患者中,男36例,女29例,年龄为36 ~74 岁,平均(61.8 ±7.8)岁;术后肿瘤分期按照AJCC/UICC 第7 版TNM分期系统进行,其中Ⅰ期5例,Ⅱ期27例,Ⅲ期33例,纳入患者的具体临床病理特征见表2。本研究获得武汉市中心医院医学伦理委员会审核批准,所有患者和家属均签署知情同意书。

表1 两组患者的基线资料比较Tab.1 Comparison of baseline data between two groups例
1.2 方法
1.2.1 血浆外泌体的提取和鉴定采用ExoQuick Exosome Precipitation Solution(System Biosciences,CA,USA)试剂盒提取血浆中的外泌体。简要步骤如下:取500 μL 血清样本,加入126 μL 上述试剂,上下颠倒混匀,4 ℃孵育30 min 后于室温下1 500g离心30 min,小心去除上清液,加入200 μL PBS 缓冲液重悬,即获得血浆外泌体悬液。为了鉴定从血浆中提取的外泌体,首先采用透射电子显微镜(TEM)对外泌体的形态进行鉴定;然后利用Western Blot 检测外泌体相关标志物(CD63,TSG101)的表达情况(以calnexin 为内参,其作为表达于内质网上的一种整合蛋白,在外泌体中不表达);此外,使用NanoSight LM10(Malvern Instruments Inc.,UK)对外泌体的直径和密度进行分析,具体操作步骤参照说明书进行。
1.2.2 血浆外泌体中RNA 的提取使用miRNeasy serum/plasma micro kit(Qiagen,CA,USA)进行血浆外泌体中RNA 的提取,所有步骤均在生物安全柜中进行,并在冰上进行操作,以预防RNA 降解导致提取的RNA 总量降低。参照既往文献报道方法[16-17],通过在每个血清样本中添加25 fmol 的celmiRNA-39(Applied Biosystems,CA,USA)试剂进行均一化,以降低RNA 提取过程中样品变异问题对最终检测结果的影响。上述具体操作参照说明书进行。
1.2.3 RT-qPCR 检测血浆外泌体中miR-23b 的表达水平采用TaqMan miRNA assays(Applied Biosystems,USA)试剂盒检测血浆外泌体中miR-23b的表达水平,简要步骤如下:取1 μg RNA按照cDNA逆转录试剂盒(Applied Biosystems,USA)说明书进行逆转录反应合成互补脱氧核糖核酸(cDNA),加入SYBR Green PCR Master Mix(Applied BiStudioystems,USA),进行PCR 扩增。RT-PCR 反应条件为:95 ℃,10 min 预变性;95 ℃,15 s 变性;60 ℃,1 min 退火延伸,45 个循环进行扩增,每个样品重复3 次。以U6 为内参,以2-ΔCt计算miR-23b 的相对表达水平。所有引物均购买自Invitrogen(Thermo Fisher Scientific,USA)公司,序列如下:miR-23b(正向:5′-GAGCATCACATTGCCAGGG-3′;反向:5′-GTGCAGGGTCCGAGGT-3′);U6(正 向:5′-CTCGCTTCGGCAGCACATAT-3′;反向:5′-TTGCGTGTCATCCTTGCG-3′)。
1.2.4 随访采取门诊复查或电话对患者进行定期随访,随访时间截止至2019年12月。其中,4例患者出现失访,中位随访时间为65(27,72)个月。本研究观察指标为5年生存期(overall survival,OS),定义为从明确诊断为结直肠癌开始至死亡或随访截止时间的时间间隔。
1.3 统计学方法采用SPSS 22.0 软件进行统计分析。采用χ2检验分析CRC 患者血浆外泌体中miR-23b 水平与临床病理学特征的相关性;采用Kaplan-Meier 绘制不同血浆外泌体miR-23b 表达水平患者的生存曲线,组间差异采用Log-rank 检验进行比较;采用单因素和多因素Cox 比例风险回归模型探究影响CRC 患者OS 的风险因素。以P<0.05 为差异具有统计学意义。
2 结果
2.1 血浆外泌体的鉴定为了鉴定从血浆中分离的外泌体,笔者首先利用TEM 对外泌体的形态进行初步鉴定,结果见图1A,健康人及CRC 患者血浆中提取外泌体均呈现典型的电镜形态—茶托型或一侧凹陷的半球形,大部分直径在100 nm 左右,CRC 患者血浆中的外泌体数量较健康人多;Western Blot 结果表明,健康人和CRC 患者血浆中外泌体均表达CD63 和TSG101,而不表达Calnexin,且CD63 和TSG101 在CRC 患者血浆外泌体的表达水平较健康患者明显升高,见图1B;本研究进一步利用NanoSight 对外泌体的直径和密度进行了测定,结果表明健康人和CRC 患者血浆中的外泌体的直径范围在50 ~200 nm 左右,主要集中在100 nm 周围,且CRC 患者血浆中的外泌体的密度高于健康人,见图1C。
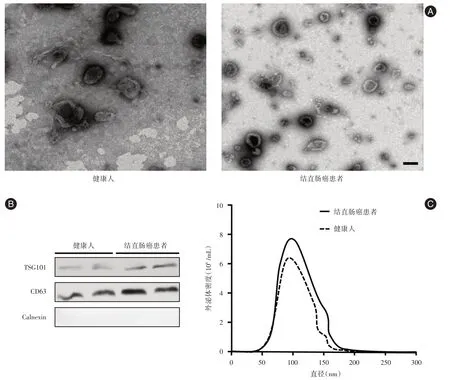
图1 结直肠癌和健康人血浆外泌体的鉴定Fig.1 Plasma exosomes identification from colorectal cancer and healthy controls
2.2 结直肠癌患者和健康人血浆外泌体中miR-23b的表达水平采用RT-qPCR对CRC患者和健康人血浆外泌体中miR-23b 的表达水平进行检测,结果显示,CRC 患者血浆外泌体中miR-23b 的表达水平较健康人显著下调,差异具有统计学意义[(1.13±0.12)vs.(2.27±0.26),t=-28.490,P<0.001]。
2.3 血浆外泌体miR-23b 表达水平与结直肠癌患者临床病理特征的关系根据血浆外泌体中miR-23b 的表达水平,以中位值1.03 为界,将65例CRC患者分为高表达组(n=32)和低表达组(n=33),分析其表达水平与患者临床病理特征的关系。结果表明,血浆外泌体miR-23b 低表达与肿瘤分化程度、浸润深度、淋巴结转移、TNM 分期、脉管浸润及神经侵犯显著相关(均P<0.05),而与患者性别、年龄、肿瘤位置、肿瘤大小及术前CEA 水平无显著相关性(均P>0.05),见表2。
2.4 血浆外泌体miR-23b 表达水平与结直肠癌患者预后的关系Kaplan-Meier 生存分析及Log-rank检验结果表明,血浆外泌体miR-23b 低表达组患者的病死率较高表达组明显升高,差异具有统计学意义(χ2= 8.585,P= 0.003),见图2。单因素分析结果显示,肿瘤浸润深度、淋巴结转移、脉管浸润、神经侵犯、TNM 分期和外泌体miR-23b 表达是影响CRC 患者OS 的危险因素(均P<0.05),见表3。将上述因素纳入Cox 比例风险回归模型进行多因素分析,结果表明,TNM 分期(HR=4.205,95%CI:1.621 ~10.910,P=0.003)和血浆外泌体miR-23b表达(HR=2.243,95%CI:1.093 ~5.024,P=0.029)是影响CRC 患者OS 的独立危险因素(均P<0.05),见表3。
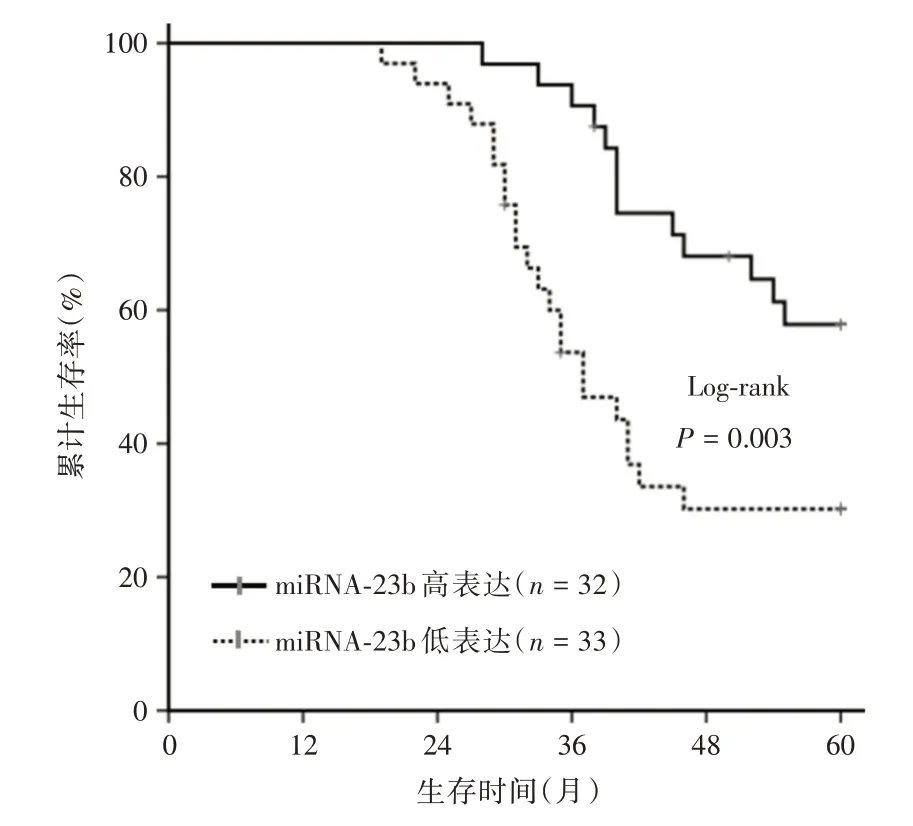
图2 结直肠癌患者血浆外泌体中miR-23b 表达水平与总生存期的关系Fig.2 Relationship between miR-23b expression in plasma exosomes and overall survival of colorectal cancer patients
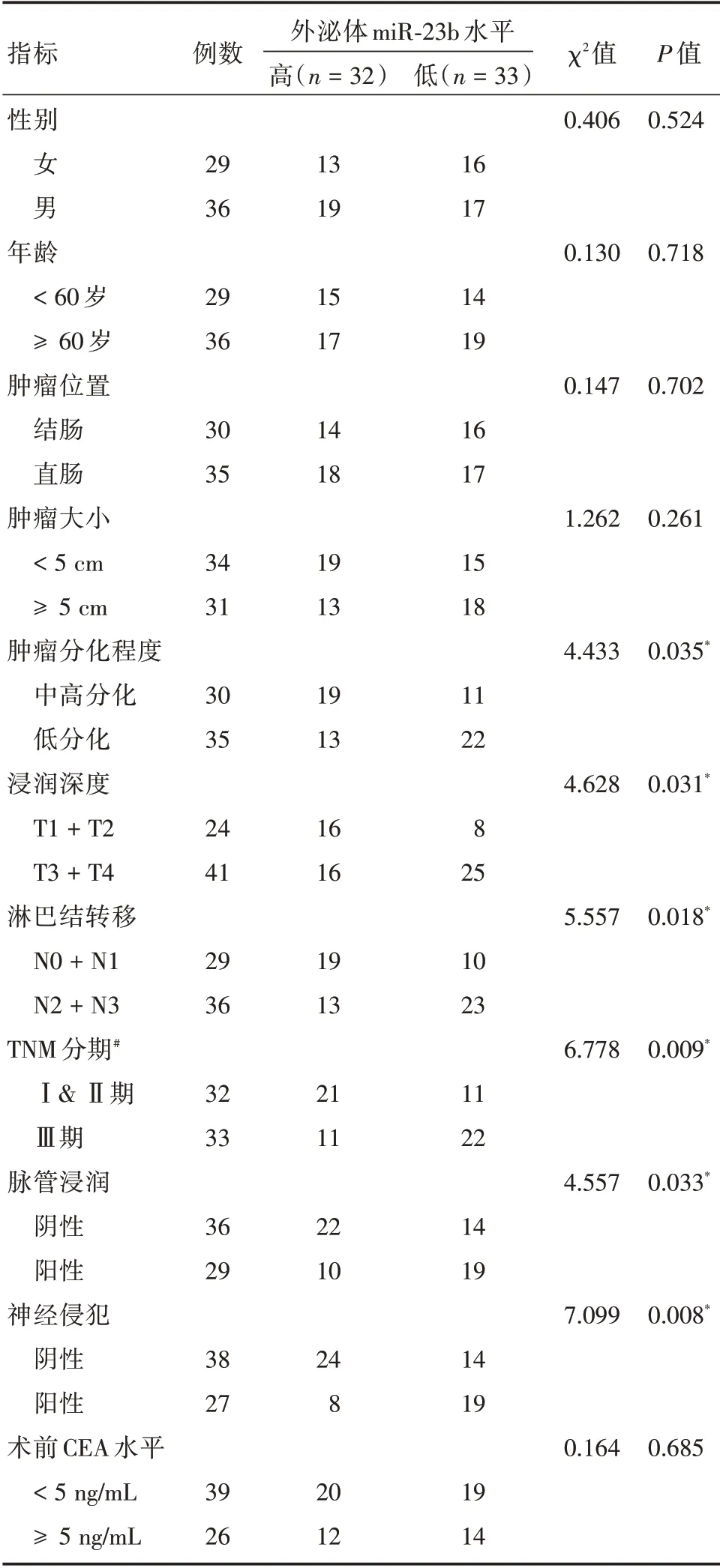
表2 结直肠癌患者血清外泌体中miR-23b 表达水平与临床病理特征的关系Tab.2 Association of serum exosomal miR-23b level with clinicopathologic factors in CRC patients例
3 讨论
作为一种新兴的“液体活检”技术,外泌体检测具有样本易采集、非侵入性和实时动态检测等诸多优势[18]。鉴于上述优势,再结合外泌体miRNA 可在患者血清中保持稳定并具备反映肿瘤细胞独特生物学特性的表达谱,使得外泌体miRNA成为了一种简单、可靠的生物标志物,用于协助多种恶性肿瘤的早期诊断和预后评估[19-21]。本研究通过评估CRC 患者血浆外泌体中miR-23b 的表达水平及其与临床病理特征和患者总生存期的相关性,首次证实血浆外泌体miR-23b 低表达与多种不良临床病理因素相关,并预示着不良预后;在纳入其他混杂因素后,血浆外泌体miR-23b 低表达仍是影响CRC 患者总生存期的重要因素。上述研究结果表明,血浆外泌体miR-23b 可作为预测CRC 患者预后的可靠标志物。

表3 影响结直肠癌患者总生存期相关风险因素的单因素和多因素分析Tab.3 Univariate and multivariate analyses of risk factors related to overall survival of CRC patients
目前,肿瘤患者外周血循环中miRNA 被认为是一种简单、有效的新兴标志物[22-24]。KOU 等[13]的研究表明,与健康人相比,CRC 患者血浆样本中的miR-23b 水平明显降低,且其低表达不仅与肿瘤临床分期,肿瘤深度,肿瘤复发和远处转移密切相关,还可用作CRC 诊断和预后评估的标志物。然而,新兴证据证实裸露在血液循环中的miRNAs 可被内源产生的RNase 所降解,而外泌体中的miRNAs 由于有外泌体外膜“包裹”保护可免受RNase作用[25]。因此,相较于血液中的总miRNA,检测血浆外泌体中的miRNA 能更好的反映患者外周血中的miRNA 水平。本研究通过检测miR-23b 在血浆外泌体中的表达水平代替血清中总miR-23b,以评估循环miR-23b 在CRC 中的临床预后价值,可提高循环miR-23b 检测在患者预后评估中的准确性。关于外泌体miR-23b 在恶性肿瘤中的临床意义,既往已有相关研究报道:KUMATA 等[26]分析了血浆外泌体miR-23b 在各个分期胃癌中的预后价值,结果发现,胃癌患者血浆中的外泌体miR-23b水平明显低于健康对照组,且随着肿瘤分期的增加,表达水平逐渐降低;生存分析发现,在Ⅰ~Ⅳ期胃癌中,血浆外泌体miR-23b 低表达均预示着较短的无疾病进展期和总生存期。上述研究结果提示,血浆外泌体miR-23b 可能是一个潜在的恶性肿瘤相关生物标志物。
关于miR-23b 参与CRC 发生进展的分子机制,目前研究仍较少。ZHANG 等[11]通过对结肠癌组织及细胞进行全基因组功能筛选后发现,miR-23b在人结肠癌样本中显著下调,其可通过靶向调控包括FZD7 和MAP3k1 在内的多个肿瘤转移相关基因的表达,抑制肿瘤细胞的生长、侵袭以及新生血管形成,从而抑制肿瘤转移;另一方面,GASIULÈ等[15]研究发现miR-23b 在奥沙利铂耐药的CRC 细胞高表达,其可通过促进肿瘤细胞发生上皮间质转化,从而增加对化疗药物的抵抗性,促进肿瘤转移。
尽管本研究首次探究了miR-23b 在CRC 患者血浆外泌体中的表达水平,并对其临床预后价值进行了深入探究,但仍存在一些局限:(1)样本量相对较小;(2)未对外泌体miR-23b 参与CRC 发生发展的分子机制进行探究。在未来,一方面,有必要开展大规模的临床研究去进一步证实血浆外泌体miR-23b 水平在CRC 及其他瘤种中的临床意义;另一方面,需要更多基础研究去探索miR-23b特别是外泌体miR-23b 参与CRC 发生、进展及转移的潜在分子机制。
综上所述,本研究证实miR-23b 在CRC 患者血浆外泌体中表达显著下调,且其低表达与多个不良临床病理学因素及较短的总生存期密切相关,可作为一个CRC 的预后标志物和潜在的治疗靶点。
