mFOLFOX6 方案化疗+西妥昔联合脾多肽治疗直肠癌肝转移患者的临床观察
2020-05-08刘茂希张毅勋冯毅白文启江波刘海义
刘茂希 张毅勋 冯毅 白文启 江波 刘海义
山西省肿瘤医院结直肠肿瘤外科(太原030013)
直肠癌是消化系统常见的恶性肿瘤之一。近年来,无论是在世界范围还是在我国其发病率均呈上升趋势。然而,我国约40%的患者在初次就诊时已是晚期,这些患者中绝大多数却是肝转移。面对如此严峻的形式,对于如何改善直肠癌肝转移患者的预后是目前临床研究工作的热点之一。对于直肠癌肝转移患者,mFOLFOX6 化疗+西妥昔靶向治疗是治疗Kras、N-RAS 及Braf 是野生型患者的主要治疗手段[1]。但是据临床报道显示,该方案却表现出明显的毒副作用,尤其免疫系统毒性尤为突出[2]。因此有必要优化该方案,以期在提高临床疗效的同时降低对免疫系统的损害。脾多肽作为一种免疫增强剂已在临床中大量使用,其可以修复紊乱的免疫系统,促进T 淋巴细胞的成熟,增强患者的抵抗力。文献报道化疗联合脾多肽注射液通过改善患者的免疫功能来改善患者预后[3]。毛山山等[4]研究显示脾多肽注射液联合mFOLFOX6 方案治疗晚期结肠癌可以提高近期T 淋巴细胞亚群免疫功能,但脾多肽与mFOLFOX6化疗合西妥昔靶向治疗直肠癌肝转移患者联用的方案目前并未见相关报道。故本研究采用脾多肽与mFOLFOX6 化疗联合西妥昔方案治疗2014年1月至2017年12月疗直肠癌肝转移患者,取得较好效果。现报道如下。
1 资料与方法
1.1 临床资料选取2014年1月至2017年12月山西省肿瘤医院结直肠外科收治的60例直肠癌肝转移且Kras、N-RAS 及Braf 基因均是野生型的患者,均经多学科综合治疗(multi-disciplinary team,MDT)讨论需行mFOLFOX6 方案化疗+西妥昔转化治疗,其中男29例,女31例,年龄(64.67 ± 12.53)岁。采用随机对照的方法将该60例患者分为观察组与对照组,每组30例。纳入标准:(1)影像学、穿刺病理活检或组织病理学诊断确诊为同时性结直肠癌肝转移,且经二代测序验证患者Kras、N-RAS 及Braf 基因均是野生型;(2)确诊时无肝外转移;(3)预期生存期不低于8 周;(4)KPS 评分均超过70 分。排除标准:(1)心脏、肝、肾等重要脏器功能出现严重不全者;(2)接受过其他免疫治疗或者放化疗者;(3)处于妊娠、哺乳期;(4)难以配合的患者;(5)血常规出现异常者。本研究经山西省肿瘤医院伦理委员会批准,所有入选患者均知情并签订同意书。
1.2 治疗方法对照组采取mFOLFOX6全身化疗+西妥昔靶向化疗。第1 天:以85 mg/m2剂量的奥沙利铂进行静滴,持续时间2 h;以500 mg/m2剂量的西妥昔进行静滴,持续时间2 h。第1-2 天,以剂量为200 mg/m2的左亚叶酸钙进行静滴,持续时间2 h;以400 mg/m2的5-氟尿嘧啶静推,并以600 mg/m2的5-氟尿嘧啶持续微量泵入,持续48 h 结束本疗程化疗,间隔2 周后再次进行化疗,连续化疗4 个周期。观察组在对照组的基础上联合由吉林丰生制药有限公司生产的脾多肽注射液(规格2 mL/支)进行全身化疗,0.9%的氯化钠注射液250 mL+脾多肽注射液6 mL 进行静滴,1 次/d,连续10 d,14 d 为一个周期,连用4 个周期[4]。化疗前1 d 与第4 个周期化疗后2 周分别化验血常规,肝肾功能及免疫功能,注意患者的用药反应,出现不良反应时采取相应的治疗措施。
1.3 观察指标(1)患者一般资料包括年龄、性别、肝转移灶数目、PS 评分及病理类型;(2)临床疗效:化疗4 个周期结束后,依据RECIST 指南对患者疗效进行评价,分为完全缓解、部分缓解、稳定及进展,有效率=(完全缓解+部分缓解)例数/总例数×100%;(3)免疫功能:患者治疗前1 d 与治疗4 个周期后2 周抽取外周静脉血,流式细胞仪检测淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)和NK 细胞百分比;(4)监测不良反应情况,包括骨髓抑制反应、肝肾损伤、腹泻及神经毒性;(5)按照KPS 评分标准,对患者化疗第4 个周期后2 周进行KPS 评分,其升高>10 分为升高,减少>10 分为减少,增加或者减少少于10 分为稳定,生存质量改善率=(升高+稳定例数)/总人数×100%。
1.4 统计学方法采用SPSS 20.0 统计软件。计量资料以表示,治疗前后比较采用配对t检验,计数资料采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较两组年龄、性别及PS 评分及肝转移灶数,结果显示,差异均无统计学意义(P>0.05),见表1。
表1 结直肠癌肝转移患者一般资料Tab.1 General information on patients with liver metastases from colorectal cancer±s
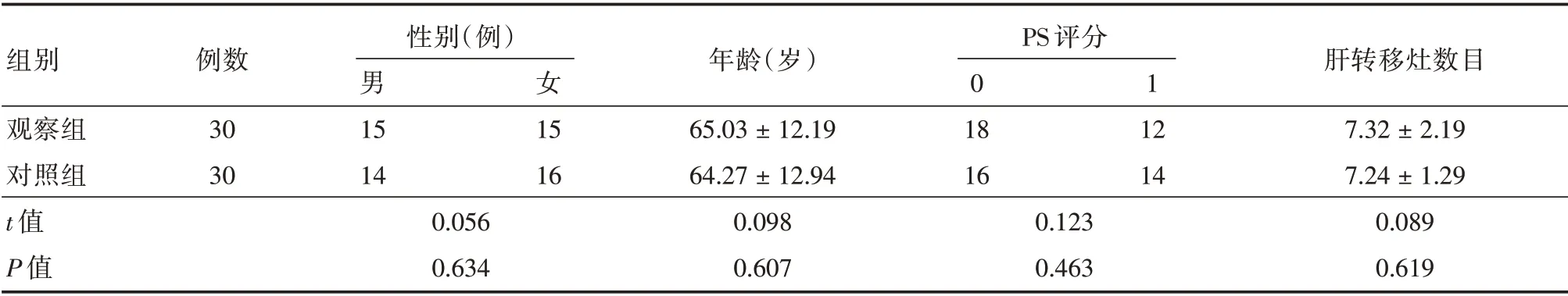
表1 结直肠癌肝转移患者一般资料Tab.1 General information on patients with liver metastases from colorectal cancer±s
组别观察组对照组t 值P 值例数30 30性别(例)男15 14 0.056 0.634女1 15 16 12 14年龄(岁)65.03±12.19 64.27±12.94 0.098 0.607 PS 评分0 18 16 0.123 0.463肝转移灶数目7.32±2.19 7.24±1.29 0.089 0.619
2.2 两组有效率比较观察组完全缓解1例,部分缓解10例,稳定16例,进展3例,有效率为36.7%;对照组依次分别为:0、8、16、6例,有效率为26.7%。两组有效率比较差异无统计学意义(t=1.176,P=0.278)。
2.3 两组治疗前后免疫功能比较化疗前两组患者CD3+、CD4+、CD8+T 细胞、NK 细胞数值以及CD4+/CD8+T 细胞比值比较,差异均无统计学意义(P>0.05);化疗后对照组,CD3+、CD4+T 数值以及CD4+/CD8+T 细胞比值较化疗前均降低(P<0.05),而CD8+T 细胞数值则有升高(P<0.05),观察组与之相反;化疗后观察组患者CD3+、CD4+T 细胞数值以及CD4+/CD8+T 细胞比值较对照组升高(P<0.05),CD8+T 细胞数值则降低(P<0.05)。见表2。
表2 两组治疗前后免疫功能比较Tab.2 Comparison of immune function between the two groups before and after treatment ±s
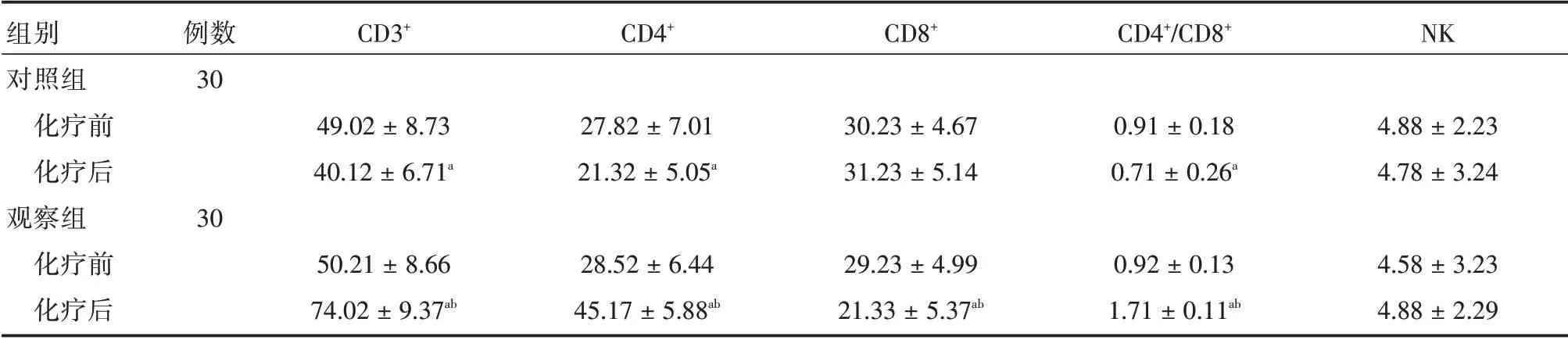
表2 两组治疗前后免疫功能比较Tab.2 Comparison of immune function between the two groups before and after treatment ±s
注:与化疗前相比,aP <0.05;与观察组化疗相比,bP <0.05
组别对照组化疗前化疗后观察组化疗前化疗后例数30 CD3+CD4+CD8+CD4+/CD8+NK 49.02±8.73 40.12±6.71a 27.82±7.01 21.32±5.05a 30 50.21±8.66 74.02±9.37ab 28.52±6.44 45.17±5.88ab 30.23±4.67 31.23±5.14 0.91±0.18 0.71±0.26a 4.88±2.23 4.78±3.24 29.23±4.99 21.33±5.37ab 0.92±0.13 1.71±0.11ab 4.58±3.23 4.88±2.29
2.4 两组不良反应的比较观察组与对照组骨髓抑制反应比较差异有统计学意义(P<0.05),而其他化疗不良反应两组间差异无统计学意义(P>0.05)。对不良反应进行处理后,未对患者的治疗产生影响。见表3。
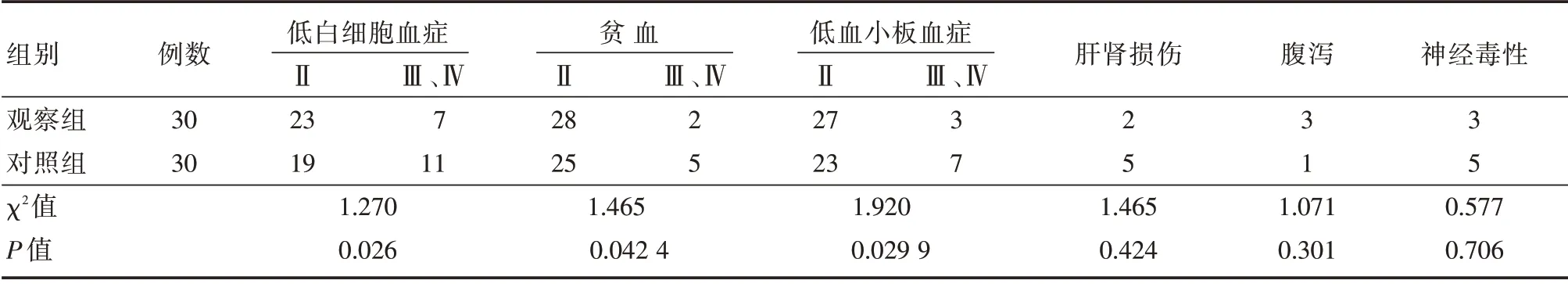
表3 两组不良反应的比较Tab.3 Comparison of adverse reactions between the two groups例
2.5 两组治疗后KPS 和生存质量评分比较观察组治疗后KPS 评分为(87.1 ± 5.1)分高于对照组为(75.1 ± 5.8)分,差异具有统计学意义(t= 4.815 1,P= 0.044 8)。两组生存质量改善率比较,观察组患者生存质量改善率(80%)优于对照组(60%),差异具有统计学意义(t=3.35,P=0.003)。见表4。

表4 两组治疗后生存质量比较Tab.4 Comparison of quality of life after treatment between the two groups例
3 讨论
大肠癌作为我国常见的消化系统恶性肿瘤之一,目前我国35 岁以上人群结直肠癌发病率高达(24~35)/10 万,且每年以4.2%的速度迅速增长,形式极其严峻[5-6]。我国大约40%的大肠癌患者初诊是即晚期,而肝转移占晚期患者的觉大多数。大肠癌肝转移的治疗目前主要采用综合治疗[7-8]。大多数直肠癌肝转移患者在以基因检测为基础的靶向治疗过程中获益。然而,化疗药物+靶向治疗会引起患者免疫功能紊乱,从而降低患者对化疗的耐受和依从性,以至于影响患者的预后[9-10]。对于如何预见化疗毒副反应,并提前予以干预,改善患者对化疗耐受并提高患者的生存质量是目前大肠癌肝转移化疗+靶向治疗过程的中的热点问题。
研究发现肿瘤治疗失败的重要因素之一即是癌细胞逃逸机体的免疫应答和抑制外周血免疫细胞的功能。化疗药物具有非特异性,不仅能杀死癌细胞,对包括免疫细胞在内的正常细胞都有杀伤作用,从而导致化疗患者免疫功能进一步降低[11-12]。
据研究显示,脾多肽是由健康小牛脾脏提取物制成的含有核糖、总糖、游离氨基酸及多肽的分子量<6 000 的无菌水溶液。由于其具有刺激骨髓造血,增加白细胞数目及提升血小板数目已经用于治疗白血病和再生障碍性贫血[13-14]。脾多肽注射液具有增强免疫应答和纠正紊乱免疫系统的功能[15],在乳腺癌、肺癌、食管癌及大肠癌中都有报道其能降低化疗患者骨髓抑制毒副作用[16-19]。
故本研究将脾多肽引入mFOLFOX6 化疗+西妥昔靶向治疗方案,以期了解是否具有改善免疫毒性的作用,本研究发现,治疗4 个周期后观察组的CD3+、CD4+、CD4+/CD8+明显高于对照组,而CD8+低于对照组,但是NK 细胞百分比变化不明显。CD3+T 细胞代表人体总T 细胞水平。CD8+T 细胞能直接识别并杀伤肿瘤细胞。CD4+T 细胞在人体免疫系统中起十分重要的作用,反映了机体免疫功能状况,与CD8+T 细胞协作抵御外侵。CD4+/CD8+T 细胞比值是临床诊断人体免疫功能发生紊乱的敏感指标,只有当两者在适当的比例,机体细胞免疫功能才能发挥正常的作用[20-22],该结果证实脾多肽注射液在直肠癌肝转移行化疗+靶向治疗的过程中也具有增强免疫应答和纠正紊乱免疫系统的功能。对于两组间NK 细胞百分比变化不明显,这一结果和脾多肽注射液在乳腺癌患者化疗过程中对外周血NK 细胞百分比的影响相一致[23],其原因可能和肿瘤微环境相关。
本研究发现,观察组KPS 评分高于对照组,证明脾多肽注射液对于改善患者行为认知、提高化疗耐受及调节全身状态也有积极作用。事实上肿瘤患者的预后与患者的生存质量密切相关。本研究结果也进一步证实脾多肽注射液的这一重要作用。
从以上结果看,脾多肽具有提高肿瘤化疗导致的免疫功能低下的作用,主要原因可能为脾多肽注射液通过促进T 细胞成熟增强抵抗力和阻断细胞糖酵解来阻断肿瘤细胞的能量来源,从而使肿瘤细胞生长发生停滞,增强化疗效果。鉴于脾多肽注射液对免疫功能及生活治疗的改善作用,其应该可以改善恶性肿瘤患者的预后。本研究发现观察组的有效率与对照组之间无显著差异,其可能与本研究标本数目过少和治疗周期较短有关。在下一步研究将扩大样本量和增加治疗周期来进一步探讨脾多肽对直肠癌肝转移患者临床疗效的影响。
综上所述,在直肠癌肝转移患者治疗过程中,采用化疗+靶向同时配合使用脾多肽注射液,可以纠正紊乱的免疫系统,改善患者的全身状态,提高患者的生存质量。脾多肽注射液对该类患者具有良好的辅助作用,值得在临床上予以广泛推广。
