保留左结肠动脉的腹腔镜直肠癌根治术在加速康复外科中的临床价值
2020-05-08孙康党胜春瞿建国范昕谢嵘陈吉祥
孙康 党胜春 瞿建国 范昕 谢嵘 陈吉祥
随着饮食习惯和生活环境的变化,结直肠癌(colorectal cancer,CRC)在我国的发病率及死亡率逐年上升,均位居恶性肿瘤第5 位,其中直肠癌发病率占CRC 的60%[1]。目前,直肠癌的治疗仍遵循以手术切除为主,放化疗为辅的综合治疗原则。自1990年美国医生Jacobs 首次报道腹腔镜下乙状结肠癌切除术以来,腹腔镜直肠癌手术得到迅猛发展[2],由于其创伤小,术后恢复快等特点已成为直肠癌,特别是中低位直肠癌的首选术式。加速康复外科(enhanced recovery after surgery,ERAS)是近年基于循证医学证据,围绕围手术期处理措施优化的现代外科理念[3-4]。我科从2014年1月起在ERAS 理念指导下进行了保留左结肠动脉(left colonic artery,LCA)的腹腔镜直肠癌根治术,取得了比较满意的疗效。本研究以2014年1月至2017年12月收治的152例进入ERAS 临床路径的直肠癌患者为研究对象,探讨腹腔镜直肠癌根治术中保留左结肠动脉在ERAS 治疗模式中的临床价值。
1 资料与方法
1.1 一般资料选取2014年1月至2017年12月收治的152例进入ERAS 临床路径的直肠癌患者临床资料。其中男82例,女70例,男女比例1.17∶1。平均年龄(63.38 ± 0.20)岁,BMI(23.18 ±5.90)kg/m2。主要症状:大便习惯改变78例,解血便33例,腹痛腹胀31例,体检发现癌胚抗原(CEA)异常增高10例。术前均行纤维结肠镜检查,病理确诊为直肠癌。肿瘤部位:腹膜反折以上者67例,腹膜反折以下者85例。根据是否保留左结肠动脉,分为保留组(n=74),不保留组(n=78)。纳入标准:(1)肠镜及病理检查确诊为直肠癌;(2)首次接受手术治疗。排除标准:(1)严重心肺功能障碍者;(2)糖尿病患者;(3)术前、术中发现远处脏器转移或腹腔广泛种植转移者;(4)合并肠梗阻的急诊手术;(5)腹腔镜下不能完成手术,中转开腹;(6)合并其他恶性疾病;(7)接受新辅助放化疗患者。两组患者一般资料比较差异无统计学意义(P>0.05,表1)。
1.2 术前准备所有研究对象进入我科直肠癌ERAS 临床路径。入院后常规行全腹部增强CT 和盆腔MR 检查。术前3 d 开始功能性肠道准备,多维营养强化复合粉400 g/d 冲服。术前晚18:00 至睡前口服麦芽糊精果糖800~1 000 mL,术前2 h 再口服400 mL。术前常规不置胃管。麻醉前行超声引导定位下腰方肌阻滞(罗哌卡因150 mg)。
1.3 手术方式气管插管全身麻醉,取改良截石位,头低足高15°,左侧稍抬高,常规建立气腹,于脐孔上1 cm建立12 mm观察孔,右下腹麦氏点建立12 mm主操作孔,右侧腹锁骨中心平脐建立5 mm 操作孔,左侧腹对称性建立2 个5 mm 操作孔。首先腹腔镜探查排除腹腔脏器远处转移,然后于右侧髂内动脉内侧打开乙状结肠系膜浆膜向头侧游离至肠系膜下动脉(inferior mesenteric artery,IMA)根部。保留LCA 组:找到IMA 根部,廓清其根部淋巴结,再沿IMA 找到LCA,单独清扫LCA 周围淋巴结,在IMA 发出LCA 远端切断结扎IMA(图1A)。不保留LCA 组:直接在IMA 根部切断并清扫其周围淋巴结(图1B)。两组近端肠管切除范围距离肿瘤≥10 cm,其余步骤均遵循全直肠系膜切除(total mesorectal excision,TME)的肿瘤根治原则进行,即在直肠肿瘤下缘≥5 cm 处,锐性剥离并切除由骶前筋膜脏层包裹的直肠两侧及背侧的血管、脂肪及淋巴组织等[5]。根据肿瘤距肛缘的距离决定能否保肛,手术方式分为直肠前切除术(anterior resection,AR)、直肠腹会阴联合切除(abdominal perineal resection,APR),其中AR 根据吻合口情况决定术中是否行末端回肠预防性造口。
1.4 术后ERAS 管理(1)镇痛:腰方肌阻滞+镇痛泵(不含阿片类药物)+帕瑞昔布钠静脉注射联合多模式镇痛;(2)进食:术后6 h 开始口服清流质40 mL/h,肛门排气/造口袋鼓气后进食半流质;(3)活动:术后第1 天开始下床走路100 ~150 m,逐日增加,出院前达到800 ~1 000 m/d;(4)术后24 ~48 h 常规拔除尿管。
1.5 观察指标(1)术中情况:手术时间、术中出血量、吻合口至齿状线的距离、是否行末端回肠保护性造口;(2)术后恢复情况:首次排气时间、住院时间、排尿障碍,排便失禁、吻合口并发症;(3)病理情况:病理类型及分期、淋巴结清扫数目;(4)复查随访:每3 个月复查血清CEA,每6 个月行腹部CT 检查,每年行纤维结肠镜检查,持续2年。根据Wexner 失禁评分表评估患者术后是否有排便失禁。吻合口漏的诊断标准:腹腔引流管内流出粪水样液体,腹部CT 检查证实存在盆腔积液,同时合并发热、腹胀、腹痛等腹膜炎体征。
1.6 统计学方法采用SPSS 22.0 统计软件进行分析,计量资料以()表示,比较采用t检验,计数资料比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较两组在年龄、性别、BMI、肿瘤大小、肿瘤距肛缘距离和手术方式等一般资料比较,差异均无统计学意义(P>0.05,表1)。
2.2 两组术中及术后相关指标比较保留组与不保留组在手术时间、预防性造口、首次排气时间、排尿障碍比较,差异有统计学意义(P<0.05);两组术中出血、吻合口距齿状线距离、永久性造口、住院时间及排便失禁比较,差异无统计学意义(P>0.05,表2)。

图1 肠系膜下动脉两种结扎方式Fig.1 Two ligation methods of inferior mesenteric artery

表1 两者一般资料比较Tab.1 Comparison of the two general data例(%)
2.3 两组术后病理结果比较两组在肿瘤组织学类型、分化程度、TNM 分期等方面比较,差异均无统计学意义(P>0.05);在第三站淋巴结清扫数和淋巴结清扫总数方面,差异有统计学意义(P<0.05,表3)。
表2 两组术中及术后相关指标比较Tab.2 Comparison of intraoperative and postoperative related indexes in both groups±s
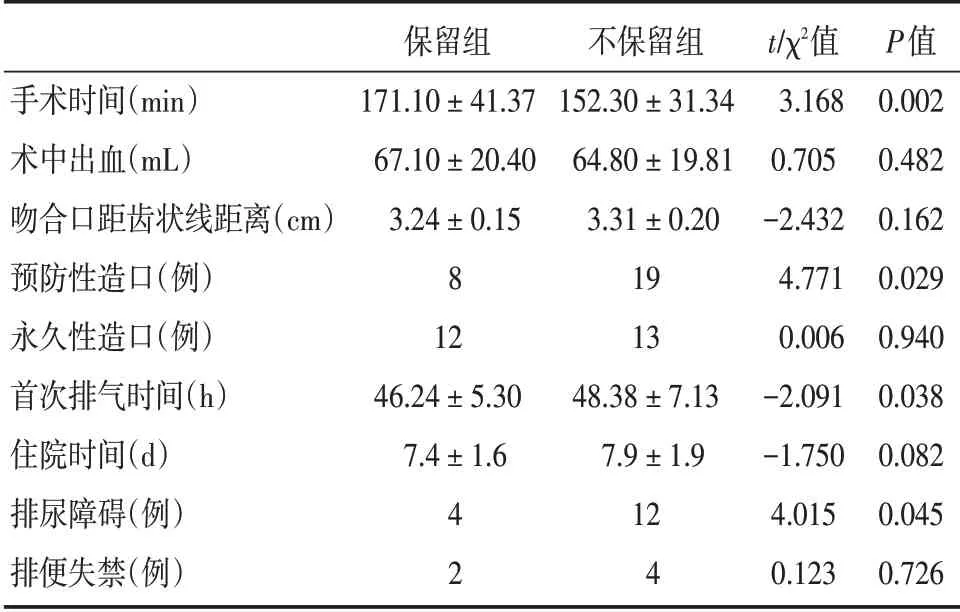
表2 两组术中及术后相关指标比较Tab.2 Comparison of intraoperative and postoperative related indexes in both groups±s
手术时间(min)术中出血(mL)吻合口距齿状线距离(cm)预防性造口(例)永久性造口(例)首次排气时间(h)住院时间(d)排尿障碍(例)排便失禁(例)保留组171.10±41.37 67.10±20.40 3.24±0.15 8 12 46.24±5.30 7.4±1.6 4 2不保留组152.30±31.34 64.80±19.81 3.31±0.20 19 13 48.38±7.13 7.9±1.9 12 4 t/χ2值3.168 0.705-2.432 4.771 0.006-2.091-1.750 4.015 0.123 P值0.002 0.482 0.162 0.029 0.940 0.038 0.082 0.045 0.726
表3 两组术后病理结果比较Tab.3 Comparison of postoperative pathological results between the two groups±s

表3 两组术后病理结果比较Tab.3 Comparison of postoperative pathological results between the two groups±s
保留组不保留组组织类型(例)腺癌粘液腺癌分化程度(例)高分化中分化低分化第三站淋巴结清扫数淋巴结清扫总数TNM 分期(例)Ⅰ期Ⅱ期Ⅲ期t/χ2值0.137 P 值0.715 58 16 63 15 0.349 0.840 18 35 21 3.4±1.3 16.1±4.3 21 38 19 3.0±1.1 14.8±3.6 2.052 2.025 0.230 0.042 0.045 0.891 9 37 28 11 40 27
2.4 两组术后吻合口并发症发生情况比较保留组吻合口漏发生率与不保留组相比,差异有统计学意义(P<0.05),吻合口出血差异无统计学意义(P>0.05,表4)。

表4 两组术后吻合口并发症比较Tab.4 Comparison of postoperative anastomotic complications between the two groups例(%)
2.5 两组术后随访情况患者术后随访2年,保留组有4例发生肝转移(5.41%),4例发生吻合口复发(6.45%),2例盆腔转移(2.7%);不保留组3例发生肝转移(3.85%),3例吻合口复发(4.62%),1例盆腔转移(1.28%),两组差异无统计学意义(P>0.05)。
3 讨论
ERAS 是通过治疗理念和治疗模式的转变,减弱应激反应,维持患者的生理功能,减少器官功能障碍和并发症,以达到患者快速康复的目的[6-7]。随着微创外科的快速发展,ERAS 理念日益受到外科医生的重视。在结直肠癌外科领域,传统开腹手术住院时间一般为12 ~15 d,术后并发症发生率约为5% ~20%[8]。结直肠癌ERAS 通过围手术期治疗策略的改进,包括不常规行机械性肠道准备,缩短禁食、禁水时间,多模式联合镇痛、优化手术方式、术后早期进食、主动下床活动等一系列措施,缩短住院时间,减少手术并发症,最终达到快速恢复目的。手术的微创和安全是顺利实施ERAS的关键。
目前大量回顾性研究表明腹腔镜微创手术治疗直肠癌是安全有效的,可减轻患者术后疼痛和应激,有利于早期进食及下床活动,缩短住院时间[9-10]。腹腔镜直肠癌手术中足够的手术切缘和TME 原则已达成共识,但是否需保留左结肠动脉及清扫第三站淋巴结仍存在争议[11-12]。有学者认为不保留左结肠动脉可以在根部高位离断IMA,更有利于淋巴结清扫,符合肿瘤根治原则[13]。也有学者指出高位结扎IMA 会导致左半结肠边缘动脉血流明显减少,增加吻合口漏的发生[14]。文献报道直肠癌术后吻合口漏发生率为5% ~26%[15]。术后吻合口漏近期可导致住院时间延长、生存质量下降,严重者易诱发脓毒血症甚至死亡;远期可造成吻合口狭窄、排便障碍等并发症。同时因术后辅助放化疗的延迟,增加了肿瘤局部复发和转移几率,降低了5年生存率。吻合口血运差和张力大是导致吻合口漏的两个主要因素[16]。低位直肠癌行TME 时,肿瘤远端直肠系膜切除不少于5 cm,肠管切除距肿瘤远端2 cm 以上,无系膜组织包裹的裸露直肠残端使得吻合口远端血供较差,而吻合口近端血供与LCA 的保留直接相关。LCA是IMA 发出的第一个分支,主要供应横结肠左半部分、结肠脾曲和降结肠。根部结扎IMA 后,左半结肠的血供主要来源于结肠边缘动脉弓,如果边缘动脉弓缺失就会导致吻合口缺血坏死[17]。SINGH 等[18]指出对于绝大多数患者没有必要为了减少吻合口张力而在IMA 根部结扎切断,只要结肠脾曲充分游离,系膜侧尽量松解,保留左结肠动脉并不增加吻合口张力,而且有利于减少吻合口漏的发生。本研究中,保留组术后吻合口漏发生率3.23%,不保留组13.85%,两组差异有统计学意义(P<0.05),这应该与保留左结肠动脉增加了吻合口的血流灌注有关。虽然保留组吻合口血供更好,但吻合口出血并无增加,两组差异无统计学意义(P>0.05)。保留组术后首次排气时间(46.24 ±5.30)h,不保留组(48.38 ± 7.13)h,两者比较差异有统计学意义(P<0.05)。这可能由于保留组直肠血供丰富,促进了肠蠕动的恢复,减少了肠痉挛的发生。保留组预防性造口较少,可能与保留组吻合口血供好,肠管游离充分,术中吻合满意度更高有关。
淋巴结转移是直肠癌最主要的转移途径之一,IMA 根部淋巴结即No.253 淋巴结作为直肠癌第三站(D3)淋巴结,其是否转移是直肠癌精准分期的重要依据。UEHARA 等[19]报道了直肠癌IMA根部淋巴结阳性率约4.9%~11.1%,强调了在IMA根部结扎更有利于D3 的清扫,可以提高生存率。根据日本第九版《大肠癌处理规约》,D2 淋巴结清扫仅适用于肿瘤浸润深度不超过肌层且无淋巴结转移的患者,而D3 淋巴结清扫作为标准术式,广泛应用于T2 期以上的直肠癌[20]。有学者认为IMA根部结扎才能彻底地清扫No.253 淋巴结,而低位结扎会导致清扫不彻底,增加局部复发风险[21]。在本研究中,得益于腹腔镜的高清放大作用,保留组可以裸化IMA 根部至LCA,将该段完全骨骼化,达到甚至超过不保留组的淋巴结清扫效果(图1)。保留组D3 淋巴结清扫数和淋巴结清扫总数均多于不保留组,差异有统计学意义(P<0.05)。两组术后病理分型及TNM 分期比较,差异无统计学意义(P>0.05)。因此,本研究显示保留左结肠动脉的淋巴结清扫不仅能达到肿瘤根治的基本要求,而且更具有优势。
保留组手术时间长于不保留组,两组比较差异有统计学意义,其原因主要在于:(1)分离出LCA 需要将IMA 到LCA 这段血管骨骼化,增加了淋巴结清扫难度;(2)该术式存在学习曲线,手术技术方面尚需进一步提高。最近有学者提出不保留左结肠动脉更可能损伤IMA 周围的神经丛根,导致泌尿、性功能障碍等自主神经系统紊乱[22]。本研究中,保留组排尿障碍例数少于不保留组,差异有统计学意义(P<0.05)。保留组和不保留组都有少数患者术后有排便失禁,可能与吻合口位置过低、肛门控便功能差有关,两组差异无统计学意义(P>0.05)。
综上所述,本研究显示腹腔镜直肠癌根治术中保留左结肠动脉能有效降低预防性造口率,减少吻合口漏的发生,缩短首次通气时间,促进患者快速康复,在ERAS 临床实践中具有重要意义。但由于本研究属于单中心、回顾性分析,且样本量还不够,术后随访时间较短,具有一定的局限性。因此,下一阶段将扩大样本量,延长随访时间,观察其远期疗效,以期进一步明确其临床应用价值。
