L-甲硫氨酸通过调节脊髓DNA甲基化水平减轻甲醛溶液所致急性炎性痛机制研究
2020-04-27栾顺莲李玉娜金丹高勇王德强邵翠杰
栾顺莲,李玉娜,金丹,高勇,王德强,邵翠杰*
急性炎性痛是目前临床工作中最为常见的病理性疼痛之一,是严重影响人类身体健康和生活质量的临床难题,而其如果不能被充分控制,就有可能转化成为慢性炎性痛。因此探讨其发病机制和治疗措施有重要的临床意义。
甲硫氨酸为人体必需氨基酸之一,人体内不能合成,必须依靠外源补充。天然得到的甲硫氨酸为L-甲硫氨酸(L-MET)。甲硫氨酸在人体内与ATP结合生成S-腺苷氨酸(SAM),其是体内甲基的最重要的直接供体,修饰DNA、RNA及组蛋白,进而影响DNA复制、转录和翻译,在表观遗传调节方面发挥重要作用[1]。DNA甲基化作为DNA序列的修饰方式,是一种重要的表观遗传调节机制,能够在不改变DNA分子一级结构的情况下调节基因组的功能,在生命活动中起着重要的作用。有研究发现,DNA甲基化参与调控学习记忆能力[2],而疼痛敏感化调节的细胞学基础与细胞记忆密切相关[3],DNA甲基化很有可能参与急性疼痛的调控过程[4-7]。而甲硫氨酸作为人体必需氨基酸之一,能够参与并影响体内DNA甲基化,对治疗或预防急性炎性痛是否有作用则未见报道。本研究采用甲醛溶液诱导急性炎性痛模型大鼠,观察注射L-MET是否会减轻大鼠足底急性炎性痛并探讨其机制,以期为寻找新的疼痛生物标志物和开发理想的镇痛新药提供理论依据。
1 资料与方法
1.1 实验时间 本研究时间为2017年7月—2018年12月。
1.2 实验动物 健康成年雄性Sprague-Dawley(SD)大鼠24只,体质量200~250 g,清洁级,由济南实验动物中心提供〔合格证号SYXK(鲁)2018 0022〕。12 h昼夜交替环境饲养,饮水、食物自由摄取,所有动物适应环境72 h后开始实验。本实验经滨州医学院实验动物伦理委员会批准,所有操作遵守国际疼痛研究会相关指南及《实验动物机构认可标准法规实用手册》[8],所有动物实验符合医学伦理学标准。
1.3 实验仪器与试剂 Bio-Rad CFX96荧光定量PCR仪(美国 Bio-Rad公司),大鼠疼痛自主活动记录仪(安徽正华生物仪器设备有限公司),甲硫氨酸(北京索莱宝科技有限公司),甲醛溶液(国药集团化学试剂有限公司),全基因组DNA甲基化定量试剂盒(北京艾德科技有限公司),反转录试剂盒〔宝生物工程(大连)有限公司〕,引物合成由生工生物工程(上海)股份有限公司完成,动物组织基因组提取试剂盒(美国Axygen公司)。
1.4 实验动物分组以及给药方法 将大鼠按照随机数字表法分为A组(0.9%氯化钠溶液+0.9%氯化钠溶液组)、B组(L-MET+0.9%氯化钠溶液组)、C组(0.9%氯化钠溶液+2 g/L甲醛溶液组)、D组(L-MET+2 g/L甲醛溶液组),每组6只。B组、D组采用1 ml注射器抽取L-MET(应用超纯水将L-MET配置成饱和溶液),腹腔注射,2次/d,总量不超过0.18 mg/kg,连续注射3 d;A组、C组注射等量0.9%氯化钠溶液。
1.5 行为学检测 将大鼠置于透明塑料观察箱(30 cm×30 cm×30 cm),箱体洁净消毒干燥,距离箱体1 m处装摄像机,可准确完整拍摄动物疼痛行为反应。注射甲醛溶液前30 min将大鼠置于箱内熟悉环境。C组、D组左后足足跖部皮下注射2 g/L甲醛溶液20 μl,制作甲醛溶液所致急性炎性痛模型,大鼠足部肿胀并会出现相应的抬足舔足行为视为模型制作成功;A组、B组注射等量0.9%氯化钠溶液。注射完毕后立即将大鼠置入观察箱内,全程记录给药后60 min大鼠行为学,并记录疼痛次数(以舔/抬足次数为准),每隔3 min为1个观察时段,共分20个观察时段。
1.6 大鼠脊髓组织的提取 行为学检测结束后,将大鼠处死,用剪刀剪断大鼠脊柱,取脊髓L4~L6之间脊髓组织,保存备用。
1.7 大鼠脊髓全基因组DNA的提取 采用AXYGEN公司动物组织基因组提取试剂盒(离心柱法)提取大鼠脊髓组织DNA,步骤简述如下:取约100 mg脊髓组织,剪碎置于1.5 ml离心管中并标记相应序号。每个离心管中加入裂解液150 μl、蛋白酶K 20 μg,混匀。将离心管置于56 ℃恒温水浴箱中,放置4 h,每隔10 min震荡1次离心管,促使样品充分混合裂解。加入200 μl平衡缓冲液,震荡混匀;加入200 μl无水乙醇,震荡混匀。将所有溶液转移至带有离心柱的离心管中,8 000 r/min离心1 min(离心半径50 cm),弃上清液。向带有离心柱的离心管中加入500 μl的冲洗缓冲液1,8 000 r/min离心2 min(离心半径50 cm),弃上清液。向带有离心柱的离心管中加入500 μl的冲洗缓冲液2,14 000 r/min离心2 min(离心半径50 cm),弃上清液。再将带有离心柱的离心管放回收集管中,12 000 r/min离心2 min(离心半径50 cm),室温下静置10 min,将残余冲洗缓冲液2彻底晾干去除。将吸附柱转入新的离心管中,向吸附膜的中间滴加200 μl 56 ℃ Buffer GE。旋紧管盖,室温下静置8 min,8 000 r/min离心2 min(离心半径50 cm),收集溶液至离心管中,以增加DNA产量。将提取的全基因组DNA置于-20 ℃低温冰箱保存备用。
1.8 大鼠脊髓全基因组DNA甲基化水平测定 采用北京艾德科技有限公司全基因组DNA甲基化试剂盒(比色法),按照说明书进行操作。简单描述如下:应用试剂盒提供的阳性对照做出标准曲线。提取全基因组DNA,将试剂盒中提供的阳性和阴性对照样本加入试剂盒中经过预先处理的96孔板中,室温放置90 min,使样本DNA与试剂盒中物质充分结合,充分洗涤后加入捕获液体,室温避光放置60 min,抽吸并洗涤5次,然后加入检测液体,室温避光孵育30 min,抽吸并洗涤5次,最后加入显影液,室温避光孵育5 min,监测样本孔以及对照孔中显色变化,当标准孔中对照的颜色变成蓝色,并由蓝色开始向黄色转变时,每孔中加入阻止液,并在450 nm处用荧光分光光度计在2~15 min读取光密度值(OD值)。每个样品有3个复孔,实验重复最少3次。按照下列公式计算DNA甲基化水平。DNA甲基化水平=〔(样本OD值-阴性对照OD值)/X〕/〔(阳性对照OD值-阴性对照OD值)×10〕×100%,其中X表示不同种属DNA的GC构成比,大鼠是42。
1.9 大鼠脊髓DNA甲基化转移酶(DNMT)1、DNMT2、DNMT3a、DNMT3b RNA水平检测 每100 mg脊髓组织样品中加入TRIZOL 1 ml,采用电动匀浆器匀浆。用TAKARA公司试剂盒提取总RNA,反转录成cDNA,调节每组样品到浓度一致,-20 ℃保存备用。DNMT1上游引物为5'-CTCGTGGTCTCCTTCCTCAG-3',下游引物为5'-AGGGGAAGAGAGATGGCATT-3';DNMT2上游引物为5'- GCAGTCCGTAGCAGAGTC-3',下游引物为5'-GGCGGAACAAGAATTACA-3';DNMT3a上游引物为5'-ACGCCAAAGAAGTGTCTGCT-3',下游引物为5'-CTTTGCCCTGCTTTATGGAG-3';DNMT3b上游引物为5'-CATAAGTCGAAGGTGCGTCGT-3',下游引物为5'-ACTTTTGTTCTCGCGTCTCCT-3'。进行实时荧光定量PCR,总反应体系为10 μl,包括目的基因或β-actin 引物 1.0 μl、cDNA 0.5 μl、5×SYBR GREEN 2.0 μl、焦碳酸二乙酯(DEPC)水6.5 μl。反应条件为:95 ℃ 1 min,94 ℃ 30 s,59 ℃ 40 s,72 ℃ 40 s,进行PCR扩增,共35个循环,具体温度、时间按照引物设计说明书和扩增情况进行调整。记录各个基因和β-actin的CT值,二者比值越大说明该样品含目的基因拷贝数越大。实验独立重复3次。
1.10 统计学方法 采用GraphPad Prism 5.0统计软件分析数据。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠行为学比较 A组、B组大鼠无明显不适异常反应;C组、D组大鼠出现躁动不安、注射足抬起不着地、舔咬或抖动注射足等反应,其疼痛行为反应呈典型的双相变化,从注射后即刻开始,持续3~5 min的急性疼痛时相(第一时相),5~10 min的静息期,随后出现可持续0~45 min的继发性疼痛时相(第二时相)(见图1)。各组大鼠不同时间点疼痛次数比较,差异有统计学意义(P<0.05);C组、D组大鼠各时间点疼痛次数均多于A组、B组,差异有统计学意义(P<0.05);D组大鼠6~39 min疼痛次数少于C组,差异有统计学意义(P<0.05,见表1)。
2.2 各组大鼠脊髓全基因组DNA甲基化水平比较各组大鼠脊髓全基因组DNA甲基化水平比较,差异有统计学意义(P<0.05);B组、D组大鼠脊髓全基因组DNA甲基化水平高于A组,差异有统计学意义(P<0.05);C组、D组大鼠脊髓全基因组DNA甲基化水平低于B组,差异有统计学意义(P<0.05);D组大鼠脊髓全基因组DNA甲基化水平高于C组,差异有统计学意义(P<0.05,见表2)。
2.3 各组大鼠脊髓 DNMT1、DNMT2、DNMT3a、DNMT3b RNA水平比较 各组大鼠脊髓DNMT1、DNMT2 RNA水平比较,差异无统计学意义(P>0.05);各组大鼠脊髓DNMT3a、DNMT3b RNA水平比较,差异有统计学意义(P<0.05)。C组、D组大鼠脊髓DNMT3a、DNMT3b RNA水平高于A组、B组,差异有统计学意义(P<0.05);D组大鼠脊髓DNMT3a RNA水平低于C组,DNMT3b RNA水平高于C组,差异有统计学意义(P<0.05,见表3)。
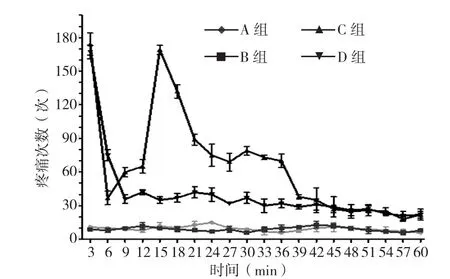
图1 各组大鼠疼痛抬足频率Figure 1 The pain-induced lift frequency of each group
3 讨论
急性炎性痛是临床常见症状,如果不及时控制会转化成为慢性炎症,增加患者痛苦并加重医疗负担,因此及时治疗并预防急性炎性痛有重要的临床意义。
L-MET与生物体内各种含硫化合物的代谢密切相关,缺乏时会引起食欲减退、生长减缓或体质量减轻、肾脏肿大和肝脏铁堆积等现象,最后导致出现肝坏死或纤维化。外源性补充L-MET可以通过参与调节体内某些DNA的甲基化,从而维持人体健康。L-MET作为甲基供体参与体内DNA甲基化,CpG结合蛋白(MeCP2)结合DNA上甲基化的CpG位点后,可抑制特定基因的转录,调控慢性炎性痛模型造成的伤害性疼痛[5]。那么急性疼痛状态下,作为疼痛初级传入中枢的脊髓甲基化程度是怎么变化的?外源性补充L-MET对疼痛是否有影响,对DNA甲基化是否有影响?其通过什么方式/机制改善疼痛的?因此,本研究通过体外补充人体必需氨基酸L-MET,观察L-MET是否对甲醛溶液所致的大鼠急性炎性痛有减轻作用,其减轻疼痛作用的机制的是否跟DNA甲基化有关。
表1 各组大鼠不同时间点疼痛次数比较(±s,n=6)Table 1 Comparison of pain frequency of each group at different time points
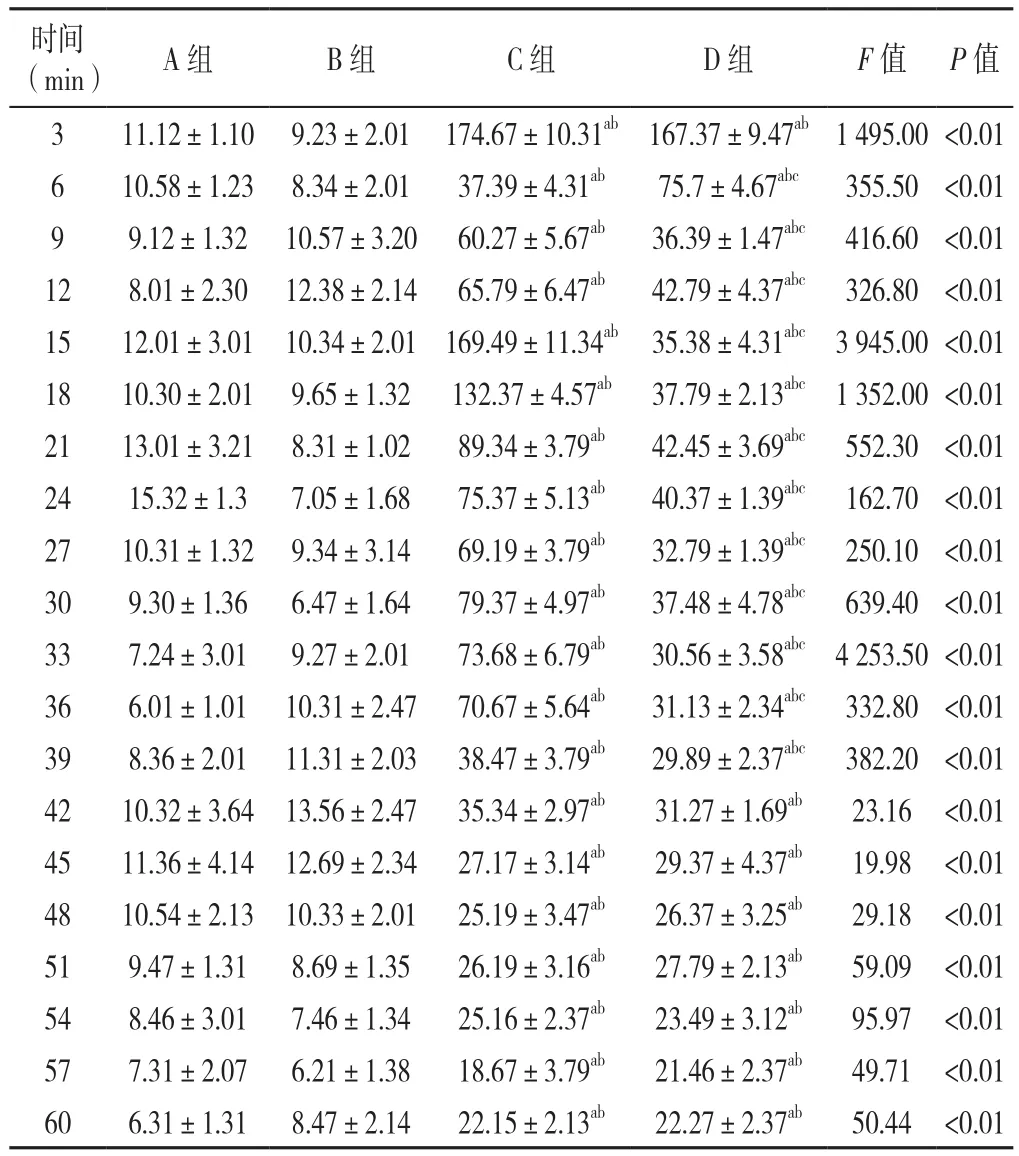
表1 各组大鼠不同时间点疼痛次数比较(±s,n=6)Table 1 Comparison of pain frequency of each group at different time points
注:A组=0.9%氯化钠溶液+0.9%氯化钠溶液组,B组=L-甲硫氨酸+0.9%氯化钠溶液组,C组=0.9%氯化钠溶液+2 g/L甲醛溶液组,D组=L-甲硫氨酸+2 g/L甲醛溶液组;与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05
时间(min) A组 B组 C组 D组 F值 P值3 11.12±1.10 9.23±2.01 174.67±10.31ab 167.37±9.47ab1 495.00 <0.01 6 10.58±1.23 8.34±2.01 37.39±4.31ab 75.7±4.67abc 355.50 <0.01 9 9.12±1.32 10.57±3.20 60.27±5.67ab 36.39±1.47abc 416.60 <0.01 12 8.01±2.30 12.38±2.14 65.79±6.47ab 42.79±4.37abc 326.80 <0.01 15 12.01±3.01 10.34±2.01 169.49±11.34ab 35.38±4.31abc 3 945.00 <0.01 18 10.30±2.01 9.65±1.32 132.37±4.57ab 37.79±2.13abc 1 352.00 <0.01 21 13.01±3.21 8.31±1.02 89.34±3.79ab 42.45±3.69abc 552.30 <0.01 24 15.32±1.3 7.05±1.68 75.37±5.13ab 40.37±1.39abc 162.70 <0.01 27 10.31±1.32 9.34±3.14 69.19±3.79ab 32.79±1.39abc 250.10 <0.01 30 9.30±1.36 6.47±1.64 79.37±4.97ab 37.48±4.78abc 639.40 <0.01 33 7.24±3.01 9.27±2.01 73.68±6.79ab 30.56±3.58abc 4 253.50 <0.01 36 6.01±1.01 10.31±2.47 70.67±5.64ab 31.13±2.34abc 332.80 <0.01 39 8.36±2.01 11.31±2.03 38.47±3.79ab 29.89±2.37abc 382.20 <0.01 42 10.32±3.64 13.56±2.47 35.34±2.97ab 31.27±1.69ab 23.16 <0.01 45 11.36±4.14 12.69±2.34 27.17±3.14ab 29.37±4.37ab 19.98 <0.01 48 10.54±2.13 10.33±2.01 25.19±3.47ab 26.37±3.25ab 29.18 <0.01 51 9.47±1.31 8.69±1.35 26.19±3.16ab 27.79±2.13ab 59.09 <0.01 54 8.46±3.01 7.46±1.34 25.16±2.37ab 23.49±3.12ab 95.97 <0.01 57 7.31±2.07 6.21±1.38 18.67±3.79ab 21.46±2.37ab 49.71 <0.01 60 6.31±1.31 8.47±2.14 22.15±2.13ab 22.27±2.37ab 50.44 <0.01
表2 各组大鼠脊髓全基因组DNA甲基化水平比较(±s,n=6)Table 2 Comparison of the whole genome DNA methylation level in spinal cord in 4 groups of rats
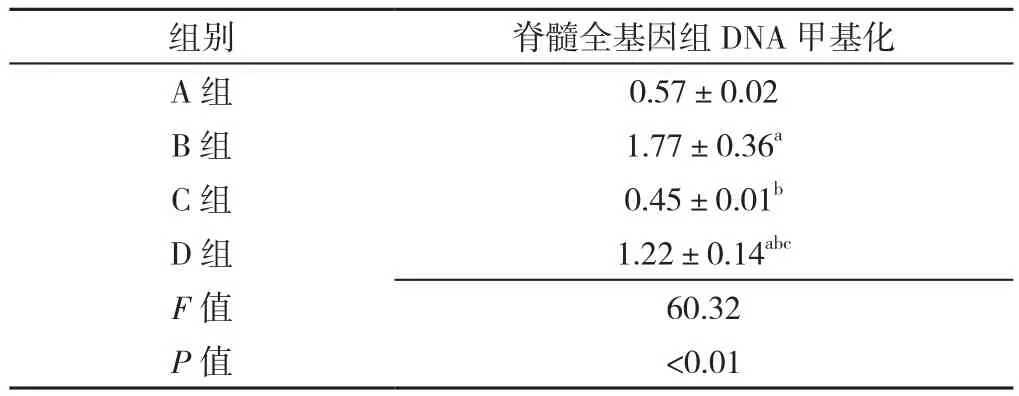
表2 各组大鼠脊髓全基因组DNA甲基化水平比较(±s,n=6)Table 2 Comparison of the whole genome DNA methylation level in spinal cord in 4 groups of rats
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05
组别 脊髓全基因组DNA甲基化A组 0.57±0.02 B组 1.77±0.36a C组 0.45±0.01b D组 1.22±0.14abc F值 60.32 P值 <0.01
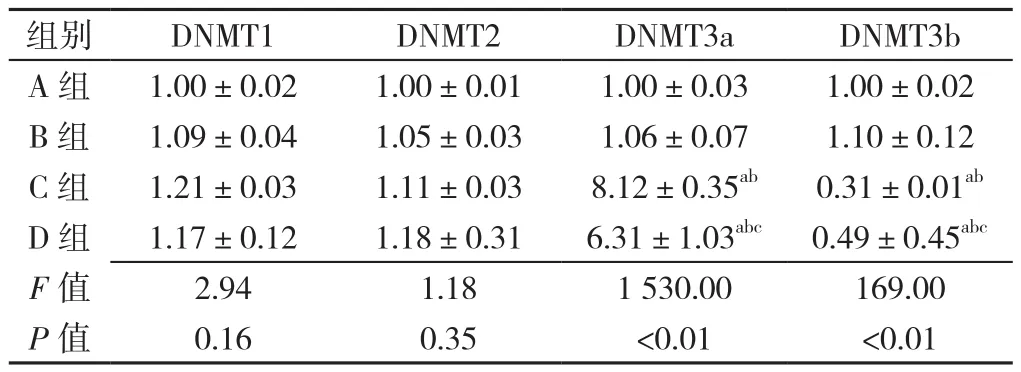
表3 各组大鼠脊髓DNMT1、DNMT2、DNMT3a、DNMT3b RNA水平比较(x ±s,n=6)Table 3 Expression of DNMT1,DNMT2,DNMT3a,and DNMT3b RNA in 4 groups of rats
DNA甲基化要在DNMT的作用下才能够完成[9]。DNA甲基化模式形成、稳定与维持受DNMT的精确调控,DNMT可分为DNMT1、DNMT2、DNMT3a、DNMT3b等不同亚型。其中DNMT3a、DNMT3b负责甲基化的建立,DNMT1负责维持DNA甲基化,DNMT1单独下调会导致基因去甲基化并重新激活转录[10]。DNMT1、DNMT3a与DNA甲基化CpG结合蛋白2(MeCP2)协同调节DNA正常甲基化的维持与基因表达,控制轴突生长和突触形成,对突触可塑性与中枢神经系统情绪行为的调节起关键作用[11]。以上证据以及本研究组前期研究结果提示,DNMT和甲基化结合蛋白(MBDs)好比控制神经功能失调的“分子开关”,外源性调控DNMT和MBDs的差异性表达可以改变DNA甲基化模式,实现可逆甲基化表观遗传修饰而影响神经行为学,这可能与疼痛的发生发展与维持有关[5-7]。
本研究结果显示,A组、B组大鼠无明显不适异常反应;C组、D组大鼠出现躁动不安、注射足抬起不着地、舔咬或抖动注射足等反应,其疼痛行为反应呈典型的双相变化,从注射后即刻开始,持续3~5 min的急性疼痛时相(第一时相),5~10 min的静息期,随后出现可持续0~45 min的继发性疼痛时相(第二时相)。C组、D组大鼠各时间点疼痛次数均多于A组、B组;D组大鼠6~39 min疼痛次数少于C组。说明L-MET能够减轻急性炎性痛大鼠的主观疼痛感觉。B组、D组大鼠脊髓全基因组DNA甲基化水平高于A组,C组、D组大鼠脊髓全基因组DNA甲基化水平低于B组,D组大鼠脊髓全基因组DNA甲基化水平高于C组,说明L-MET促使一些基因发生了甲基化,而DNA甲基化参与了甲醛溶液诱导急性炎性痛的发生发展过程,从而导致大鼠疼痛程度减轻,舔/抬足次数减少。但是具体信号通路是什么,参与的基因蛋白各是什么?还有待于进一步研究。
DNA甲基化受到DNMT精确调控,那么疼痛状态下或者外源性给予L-MET后DNMT是否有变化?本研究结果显示,各组大鼠脊髓DNMT1、DNMT2 RNA水平无差异;C组、D组大鼠脊髓DNMT3a、DNMT3b RNA水平高于A组、B组;D组大鼠脊髓DNMT3a RNA水平低于C组,DNMT3b RNA水平高于C组;说明不同DNMT在疼痛中发挥作用不同。但本研究并未深入研究L-MET具体的调节基因,哪一些基因甲基化水平增高,哪一些基因甲基化水平降低,激活或者抑制哪一些基因表达可参与疼痛调节,这些均有待于进一步的研究证实。
综上所述,甲醛溶液诱导的急性炎性痛大鼠脊髓DNA甲基化水平降低,DNMT同时发生不同程度改变;腹腔注射L-MET能够改变基因甲基化水平并减轻甲醛溶液诱导的急性炎性痛大鼠行为学表现。这为临床急性炎性痛的治疗提供了理论基础和实验研究基础。
志谢:本实验在滨州医学院附属医院临床实验中心完成,感谢实验室王晓红博士、刘晓晨硕士在实验上给予的帮助,感谢徐州医学院曹君利教授、杨俊霞硕士给予的理论指导。
作者贡献:栾顺莲进行研究设计与实施、资料收集整理,撰写论文并对文章负责;李玉娜、金丹、高勇、王德强进行研究实施与评估、资料收集;邵翠杰进行质量控制及审校。
本文无利益冲突。
