首发抑郁症患者肠道菌群与认知情绪调节关系研究
2020-04-27武月霞包雪艳厉红艳杜勇孙婷王睿晨常少华方建群
武月霞,包雪艳,厉红艳,杜勇,孙婷,王睿晨,常少华,方建群*
本研究价值:
本课题首次对宁夏地区抑郁症患者进行粪便菌群基因检测,分析了肠道菌群、认知情绪调节策略两方面与抑郁症的关系,综合探讨抑郁症的发生发展情况。结果显示,抑郁症患者肠道菌群的一大特征是丁酸盐产生菌较对照组明显减少,由此可进一步探究丁酸盐产生菌对抑郁症的治疗价值。
抑郁症是一种以心境低落、兴趣和愉快感丧失、易疲劳为主要症状的心境障碍,因持久反复发作,严重影响了个人的学习、工作及日常生活能力[1]。随着经济飞速发展,人们生活压力越来越大,抑郁症的发病率也在逐年增高[1],与此同时,也给社会带来了巨大负担。2016年全球疾病负担研究系统分析结果显示,在全球范围内,抑郁症是因疾病所致伤残引起的健康寿命损失的五大主要原因之一[2]。抑郁症的病因尚无定论,大量研究提示其与遗传因素[3]、神经生化因素[4]和心理社会因素[5-6]有关。此外,近年来研究表明抑郁症的发生发展可能与肠道菌群紊乱密切相关,但目前该研究大多集中于动物实验[7-8],而人体肠道菌群的相关研究[9]相对较少,结合心理特征的研究则更少。因此,为进一步从肠道菌群方面探究抑郁症的病因,本研究将肠道菌群与认知情绪调节结合起来,揭示二者与抑郁症的关系,为抑郁症发病机制的研究提供理论依据。
1 对象与方法
1.1 调查对象 选取2017年1—12月就诊于宁夏医科大学总医院心理卫生中心门诊的首发抑郁症患者30例(抑郁症组),同期选取宁夏“十三五”科技重大项目流调体检健康志愿者31例(对照组)。纳入标准:(1)抑郁症组:经简明国际神经精神障碍访谈(MINI)[10]初步筛选初次发病、未经抗抑郁药系统治疗,且符合国际疾病分类(ICD)-10中抑郁症的诊断标准[11],汉密尔顿抑郁量表(HAMD-24)评分>20分;对照组:健康体检者,经MINI排除精神疾病;(2)年龄18~50岁;(3)无脑器质性疾病、冠心病、高血压、糖尿病、肝脏疾病、代谢性疾病、肥胖(BMI≥28 kg/m2)等病史者;(4)血常规及心、肝、肾功能正常者;(5)小学及小学以上文化程度,能够配合完成研究者;(6)自愿参加本研究者。排除标准:(1)既往有1次及以上躁狂或轻躁狂发作、继发性抑郁或复发性抑郁障碍者;(2)3个月内使用过抗抑郁药、抗生素、肠道解痉剂及其他影响肠道菌群药物者;(3)妊娠期和哺乳期妇女;(4)特殊饮食者。
1.2 调查工具
1.2.1 一般情况调查问卷 调查内容包括年龄、性别、BMI、是否吸烟、文化程度。
1.2.2 HAMD-24[12]该量表为评定抑郁状态严重程度的他评量表,由两名经过培训的高年资精神科医师以访谈和观察的方式进行评定,共24个条目,条目采用Likert 5级或3级评分法,所有条目得分相加即为总分。总分<8分代表正常;8~20分可能有抑郁;>20~35分存在轻或中度抑郁;>35分为重度抑郁。
1.2.3 认知情绪调节量表(CERQ)[13]CERQ是用于情绪调节策略的自评量表,本量表包含36道题目,共有自我责难、接受等9个分量表,每个分量表包含4个条目,每个条目采用Likert 5级评分法。分量表得分越高者,表明使用该策略的频率越高。
1.3 研究方法 本研究采取病例对照研究的方法,根据纳入、排除标准招募调查对象,首先由2名高年资的精神科医师(经过量表评定一致性培训)对调查对象进行HAMD-24评定,得分大于20分者,首先收集调查对象的一般资料,同时指导其完成CERQ,当场回收问卷(后期由双人录入电脑中)。适宜时间采集调查对象的新鲜粪便置于粪便盒内,后迅速将其放入液氮罐内,转运至生物样本库储存于-80 ℃冰箱中。
本研究首先采用物化法进行粪便元基因组DNA抽提[14],然后将16S rRNA基因V3V4可变区进行PCR扩增,最后采用Illumina MiseqPE300文库及标准的测序流程进行测序。
1.4 统计学方法 釆用SPSS 17.0统计软件进行数据分析。计量资料以(±s)表示,两组间比较采用成组t检验;计数资料以相对数表示,组间比较采用χ2检验。采用生物信息学方法分析微生物菌群群落多样性和丰度变化;经正态分布检验,CERQ分量表得分符合非正态分布,以M(P25,P75)表示,两组间比较采用非参数检验。采用Spearman秩相关分析检验肠道菌群、认知情绪调节与抑郁症的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 抑郁症组与对照组一般情况比较 抑郁症组与对照组一般情况比较,差异无统计学意义(P>0.05,见表1)。
2.2 抑郁症组与对照组肠道菌群微生物多样性分析本研究对61份人类粪便样本中细菌的16S rRNA基因V3V4可变区进行MiseqPE2x300bp高通量测序,共获得2 636 064条优化序列,其中抑郁症组1 234 685条序列,对照组1 401 379条序列。
本研究以97%的相似性将所有样本的有效序列聚类为Operational Taxonomic Units(OTUs),并采用RDP classifier贝叶斯算法[15]对97%相似水平的OTUs代表序列进行分类学分析,并分别在门、纲、目、科、属、种水平统计各样本的群落组成。
2.2.1 测序深度分析 为了探究测序的深度情况,首先对序列进行随机抽样,以随机抽取的序列数与其代表OTUs的数目构建稀释曲线,稀释曲线趋向平坦(见图1),更多的数据只会产生少量新的OTUs,说明测序数据量合理。
2.2.2 肠道菌群多样性指数分析 抑郁症组与对照组肠道菌群多样性指数比较,差异无统计学意义(P>0.05,见表2)。
2.2.3 肠道菌群丰度差异分析 与对照组相比,在门水平,抑郁症组厚壁菌门、放线菌门、柔壁菌门丰度降低,拟杆菌门丰度增高,差异有统计学意义(P<0.05);与对照组相比,在属水平,抑郁症组Ruminococcus、Subdoligranulum、Enterobacter、Coprococcus、Bifidobacterium、Lactobacillus菌属减少,而Klebsiella、Flavonifractor、Bacteroides菌属增多,差异有统计学意义(P<0.05,见表3)。
近日,2018年联合国中国美食节暨宁夏贺兰山东麓葡萄酒走进联合国活动,在联合国总部代表餐厅举办,来自宁夏21家酒庄的葡萄酒摆上餐桌供各国嘉宾品鉴。宾客们均被宁夏葡萄酒优秀的表现所征服。本次活动联合国代表餐厅已决定把贺兰神等20款宁夏葡萄酒作为今后联合国的采购用酒。

表1 抑郁症组与对照组一般情况比较Table 1 Demographic and clinical characteristics of the depression group and the control group
2.2.4 LEfSe分析 采用LEfSe分析绘制LDA分析柱图(见图2)。根据LDA 分析柱图可以看出,抑郁症组肠道菌群中主要以拟杆菌、产碱菌科(Alcaligenaceae),伯克菌目(Burkholderiales),Β-变形菌纲、Erysipelotrichaceae、幽门螺杆菌等致病菌为主;对照组以厚壁菌门、双歧杆菌、Subdoligranulum、乳酸杆菌等有益菌为优势菌。
2.3 抑郁症组与对照组CERQ分量表得分比较 抑郁症组自我责难、沉思、灾难化、责难他人分量表得分高于对照组,积极重新评价、理性分析分量表得分低于对照组,差异有统计学意义(P<0.05,见表4)。
2.4 情绪调节策略、抑郁严重程度与肠道菌群的相关性分析 情绪调节策略中自我责难分量表得分与Enterobacter菌属呈正相关,与Odoribacter、Alistipes菌属呈负相关(P<0.05);沉思分量表得分与Subdoligranulum、Alistipes、Faecalibacterium、Odoribacter菌属呈负相关(P<0.05);重新关注计划、积极重新评价分量表得分均与Weissella菌属呈正相关(P<0.05);灾难化分量表得分与Dialister菌属呈负相关(P<0.05)。抑郁严重程度与拟杆菌门及Flavonifractor菌属呈正相关(P<0.05), 与 Ruminococcus、Subdoligranulum、Coprococcus、Dialister、Odoribacter、Faecalibacterium、Butyricimonas菌属呈负相关(P<0.05,见图3)。
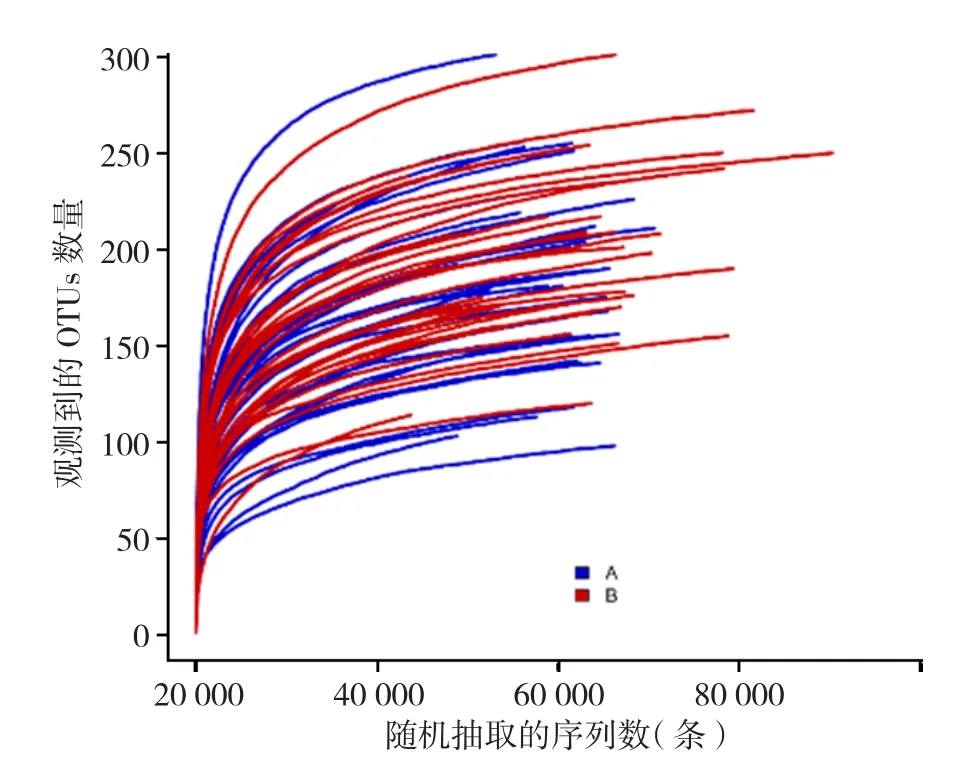
图1 稀释曲线Figure 1 Rarefaction curves
表2 抑郁症组与对照组肠道菌群多样性指数比较(±s)Table 2 Comparison of diversity of the intestinal microbiota between patients with depression and controls
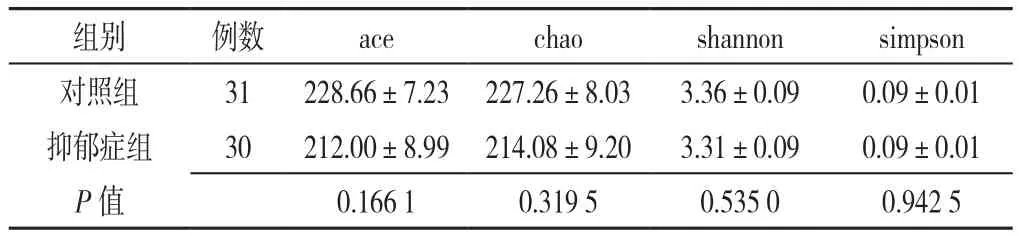
表2 抑郁症组与对照组肠道菌群多样性指数比较(±s)Table 2 Comparison of diversity of the intestinal microbiota between patients with depression and controls
组别 例数 ace chao shannon simpson对照组 31 228.66±7.23 227.26±8.03 3.36±0.09 0.09±0.01抑郁症组 30 212.00±8.99 214.08±9.20 3.31±0.09 0.09±0.01 P值 0.166 1 0.319 5 0.535 0 0.942 5
表3 抑郁症组与对照组门、属水平肠道菌群丰度差异比较(±s)Table 3 Comparison of relative abundance at the bacterial phylum and genus levels between patients with depression and controls
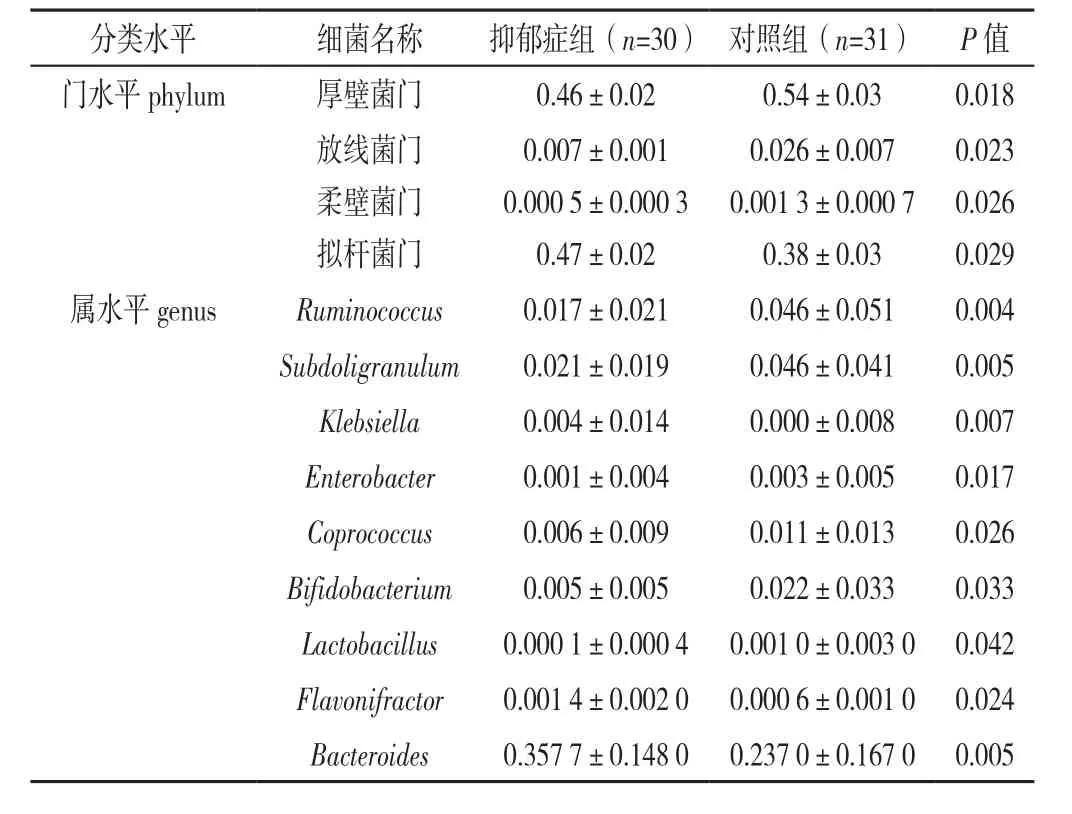
表3 抑郁症组与对照组门、属水平肠道菌群丰度差异比较(±s)Table 3 Comparison of relative abundance at the bacterial phylum and genus levels between patients with depression and controls
分类水平 细菌名称 抑郁症组(n=3 0) 对照组(n=3 1) P值门水平p h y l u m 厚壁菌门 0.4 6±0.0 2 0.5 4±0.0 3 0.0 1 8放线菌门 0.0 0 7±0.0 0 1 0.0 2 6±0.0 0 7 0.0 2 3柔壁菌门 0.0 0 0 5±0.0 0 0 3 0.0 0 1 3±0.0 0 0 7 0.0 2 6拟杆菌门 0.4 7±0.0 2 0.3 8±0.0 3 0.0 2 9属水平g e n u s R u m i n o c o c c u s 0.0 1 7±0.0 2 1 0.0 4 6±0.0 5 1 0.0 0 4 S u b d o l i g r a n u l u m 0.0 2 1±0.0 1 9 0.0 4 6±0.0 4 1 0.0 0 5 K l e b s i e l l a 0.0 0 4±0.0 1 4 0.0 0 0±0.0 0 8 0.0 0 7 E n t e r o b a c t e r 0.0 0 1±0.0 0 4 0.0 0 3±0.0 0 5 0.0 1 7 C o p r o c o c c u s 0.0 0 6±0.0 0 9 0.0 1 1±0.0 1 3 0.0 2 6 B i f i d o b a c t e r i u m 0.0 0 5±0.0 0 5 0.0 2 2±0.0 3 3 0.0 3 3 L a c t o b a c i l l u s 0.0 0 0 1±0.0 0 0 4 0.0 0 1 0±0.0 0 3 0 0.0 4 2 F l a v o n i f r a c t o r 0.0 0 1 4±0.0 0 2 0 0.0 0 0 6±0.0 0 1 0 0.0 2 4 B a c t e r o i d e s 0.3 5 7 7±0.1 4 8 0 0.2 3 7 0±0.1 6 7 0 0.0 0 5
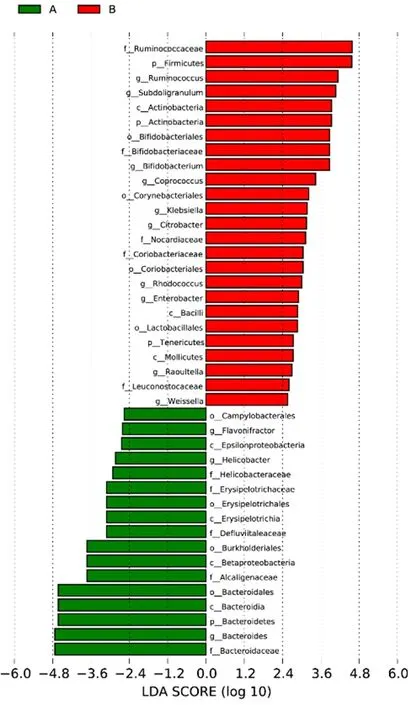
图2 LDA分析柱图Figure 2 Histogram of LDA analysis
3 讨论
抑郁症是一种机制复杂但又很常见的心境障碍,严重影响着人类的身心健康。本研究通过高通量测序方法分析抑郁症患者肠道菌群特点,综合认知情绪调节策略探索抑郁症的发生发展机制。
本研究结果发现抑郁症组与对照组在肠道菌群多样性方面无明显差异,与NASERIBAFROUEI等[16]研究结果一致,但蒋海寅[9]研究表明抑郁症组肠道菌群多样性较正常组高,可能与其研究纳入的抑郁症患者中有部分患者服用了非典型抗精神病药,而本研究纳入的抑郁症患者均为首次就诊,既往无抗抑郁药及抗精神病药服用情况有关。本研究结果表明抑郁症组和对照组在不同分类水平上的肠道菌群丰度有明显差异,在门水平上,抑郁症组较对照组厚壁菌门、放线菌门、柔壁菌门丰度显著减少,拟杆菌门丰度显著增多,与蒋海寅[9]研究结果基本一致;在属水平上,抑郁症组较对照组Bifidobacterium、Lactobacillus菌属明显减少,与崔心尧等[17]、AIZAWA等[18]研究有相同之处;LIANG 等[19]曾研究证明瑞士乳杆菌NS8在经历慢性束缚应激抑制的大鼠中具有抗抑郁作用。本研究未发现Alistips与抑郁症有关,与NASERIBAFROUEI等[16]研究发现肠道致炎性菌Alistips与抑郁症密切相关的结果不一致,因此Alistips菌属的作用有待进一步研究。LEfSe分析显示,抑郁症组患者肠道菌群中以幽门螺杆菌为主。既往陈渭等[20]研究表明幽门螺杆菌感染与抑郁症具有相关性,幽门螺杆菌根除治疗可促进抑郁症病情好转。本研究结果显示拟杆菌门丰度与抑郁严重程度呈正相关。拟杆菌属于条件致病菌,一般寄居于人体的肠道、上呼吸道等多个部位,当机体免疫功能下降或菌群失调时,可导致内源性感染[21]。Flavonifractor也是条件致病菌,是一种可能在其宿主中诱导氧化应激和炎性反应的细菌属[22],在本研究抑郁症患者中该菌属丰度较对照组明显升高。除此之外,本研究还发现抑郁症组肠道菌群有一个明显的特征,即丁酸盐产生菌丰度明显降低。在人体内丁酸具有抗炎及修复肠道黏膜的功能,其大部分来源于丁酸盐产生菌,目前研究发现Ruminococcaceae和 Lachnospiraceae两个科内该类菌较为丰富[23],主要包 括 Faecalibacterium、Ruminococcus、Butyricimonas、Coprococcus、Subdoligranulum、Clostridium 和 Blautia等菌属。本研究显示,Ruminococcus、Subdoligranulum、Coprococcus菌属明显减少,同时关联分析表明Coprococcus、Faecalibacterium菌属等多种丁酸盐产生菌与抑郁严重程度呈负相关,与抑郁症的发生有密切关系。由此可以发现抑郁症患者较健康人肠道条件致病菌增多,益生菌及丁酸盐产生菌减少。将来益生菌或丁酸盐产生菌等生态制剂有可能成为抑郁症治疗的新方法。

表4 抑郁症组与对照组CERQ分量表得分比较〔M(P25,P75),分〕Table 4 Comparison of CERQ subscale scores between patients with depression and controls
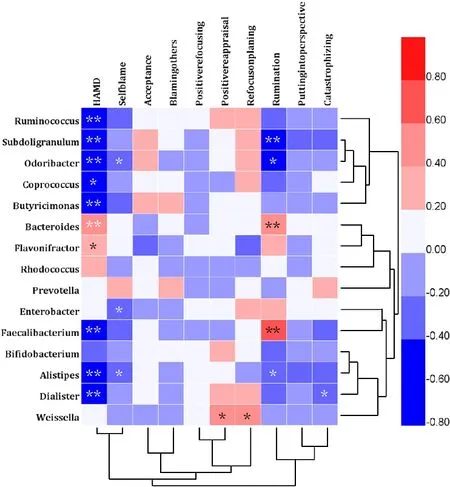
图3 情绪调节策略、抑郁严重程度与肠道菌群相关性分析Figure 3 Correlation analysis between emotion regulation strategy,depression severity and intestinal flora
情绪调节可以被理解为有意识和无意识的过程,通过这种过程,一个人的情绪体验和表达均会受到影响[6]。本研究结果显示抑郁症患者常采用自我责难、沉思、灾难化等消极的情绪调节策略,而对照组多采用积极的情绪调节策略,这与GARNEFSKI 等[13]研究结果一致。
与其他研究不同之处在于本研究将心理特征与肠道菌群相联系,发现遇到应激事件越倾向于采取消极策略的患者其Subdoligranulum、Faecalibacterium等丁酸盐产生菌相对丰度越低。本研究与某大型微生物研究[24]相比,虽然使用的心理测量工具不同,但结果有异曲同工之妙。此外,本研究还得出情绪调节策略中重新关注计划、积极重新评价等积极应对策略与Weissella菌属呈正相关。ANANDHARAJ等[25]研究发现Weissella菌属具有与乳酸杆菌类似的益生菌潜力,可抑制病原体,并且耐受性高。将心理特征与肠道菌群相关联是本研究的一大创新之处,结果发现了与抑郁症相关的特定菌群,与心理特征相联系的微生物。综上所述,本研究认为,当一个人遇到应激即生活负性事件时可能多采用自我责难、沉思等消极方式调节情绪,与周围环境不能相适应,从而可能会引起肠道菌群结构的改变,致炎性菌群增多,抗炎性菌群减少,随之机体出现炎性反应,炎性反应过度增强时,引起下丘脑-垂体-肾上腺(HPA)轴功能亢进以及5-羟色胺系统的改变,最终出现抑郁症样改变。
本研究仍存在许多不足之处,肠道菌群研究部分采用横断面研究,仅能代表抑郁症患者抑郁期与对照组在菌群相对丰度方面存在差异,并没有进行抑郁症患者缓解期与抑郁症期肠道菌群的前后对照,从而无法验证抑郁症患者缓解期肠道菌群是否恢复平衡。本研究为了排除影响因素,选用首次就诊于门诊、既往未服用任何抗抑郁药物的符合ICD-10抑郁症诊断标准的患者,从而使得研究样本量不够多,肠道菌群测序深度表明样本具有代表性,但是心理特征评估部分样本量较小,可能使结果产生偏差。
综上,本研究结果证明抑郁症患者与对照者的肠道菌群、情绪调节策略方面有较大差异,情绪调节策略自我责难、沉思、灾难化,肠道菌群条件致病菌的增多及丁酸盐产生菌、益生菌的减少与抑郁症密切相关,为抑郁症发病机制的研究提供了依据,同时也为益生菌、微生态制剂或者肠道菌群移植等治疗方法应用于临床奠定了基础。
作者贡献:武月霞负责文章的构思与设计,文章的可行性分析,文献/资料收集、整理,撰写论文;包雪艳、厉红艳、杜勇、孙婷、王睿晨、常少华共同参与收集、储存样本,文献/资料收集、整理;方建群负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
