轻微型肝性脑病磁共振扩散加权成像和扩散张量成像的定量研究
2020-04-27刘梅红黄婷婷
刘梅红 刘 辉 张 岚 黄婷婷
1)驻马店市中心医院消化内科,河南 驻马店 463000 2)驻马店市中心医院神经内科,河南 驻马店 463000 3)河南中医药大学第一附属医院影像科,河南 郑州 450000
肝性脑病(hepatic encephalopathy,HE)是指急慢性肝功能不全、衰竭或门体静脉分流引起的脑功能受损综合征[1-3]。肝性脑病根据临床症状的轻重程度分为两类,即轻微型肝性脑病(minimal hepatic encephalopathy,MHE)和显性肝性脑病[4]。MHE临床症状较轻,如短期和长期记忆降低、注意力难以集中、精细运动能力下降和情绪不稳定等[5]。甚至有研究发现MHE患者驾驶能力下降,操控方向盘不稳,易发生机动车事故[6]。MHE尚属可逆阶段,如不进行干预治疗,50%以上患者在2 a左右会进展为显性肝性脑病,导致HE病死率的增加[7-8]。因此,早期诊断和治疗MHE,可以延缓病情进展,提高患者生活质量,减轻家庭和社会的负担[9]。但临床上仅能通过特定的神经心理测试检测出MHE,目前并无诊断MHE的金标准。
磁共振扩散加权成像(diffusion weighted imaging,DWI)和扩散张量成像(diffusion tensor imaging,DTI)能够反映脑白质纤维微观结构的改变并进行定量评估[10]。DTI是在DWI基础上施加多个扩散方向的磁共振功能成像技术。DWI和DTI的定量指标可以用来评估帕金森病、阿尔茨海默病、脑卒中、多发性硬化、脑外伤等多种疾病的脑组织变化[11-12]。本研究通过对MHE患者DWI和DTI的定量分析,探讨二者对MHE早期诊断的价值,并寻求MRI功能成像的影像学依据。
1 资料与方法
1.1一般资料选择2017-03—2019-10驻马店市中心医院消化科经实验室检查、影像学检查及部分肝脏穿刺活检等临床确诊的肝炎肝硬化患者30例,乙肝肝硬化21例,丙肝肝硬化9例。其中男24例,女6例,年龄35~65岁,平均47岁。肝功能Child-Pugh分级A级9例,B级11例,C级10例。所有肝硬化患者均无明显中枢神经系统异常的临床表现。同时选取性别、年龄匹配的健康志愿者15例为正常对照组,男10例,女5例,年龄28~62岁,平均41岁。所有受试者均无神经精神疾病、酗酒史、糖尿病、高血压和药物滥用史、幽闭恐惧症,均能配合完成磁共振检查。本研究获取本院伦理委员会批准,所有受试者签署知情同意书。
1.2神经心理学测试国际上诊断MHE的金标准为肝性脑病神经心理测试评分量表,包括5个测试项目[13]:数字连接测试-A(NCT-A)、数字连接测试-B(NCT-B)、数字符号测试(DST)、轨迹描绘测试(LTT)、系列打点测试(SDT)。本次研究采用NCT-A和DST两项神经心理检测,两项神经心理测试均为阳性者为MHE组,一项测试为阴性或二项测试均为阴性者为单纯肝硬化组。30例肝硬化患者纳入MHE组16例,余14例纳入无MHE的单纯肝硬化组。
1.3 MRI检查采用西门子Skyra 3.0T超导型磁共振扫描仪,32通道头颈线圈。所有受试者先行常规MRI扫描,包括轴位T1WI,轴位和矢状位T2WI,轴位FLAIR序列。然后行DWI和DTI扫描,均采用EPI序列,扫描参数TR 5 000 ms,TE 80 ms,FOV 240 mm×240 mm,矩阵128×128,DWI层厚5 mm,层间距1 mm,DTI层厚3 mm,层间距0 mm,b值为0和1 000 s/mm2,DTI扩散梯度方向为32个。DWI扫描完自动生成表观弥散系数(apparent diffusion coefficient,ADC)图。
1.4图像后处理原始数据经DTI后处理软件处理生成各向异性分数图(fractional anisotropy,FA)(图1)。分别在ADC图和FA图上勾画感兴趣区(region of interest,ROI)得到ADC值和FA值。选取的ROI包括额叶、枕叶白质、胼胝体膝部、胼胝体压部、内囊前肢、内囊后肢、尾状核头部、背侧丘脑。由两名高年资MRI医师对解剖结构进行辨认后分别勾画ROI,ROI面积60~100 m2,根据不同的解剖部位ROI面积大小略有不同。两位医师测量3个连续层面ROI的ADC值和FA值,计算出的平均值为每位医师测量的结果,最终每个解剖部位的ADC值和FA值为两名医师测量结果的平均值。
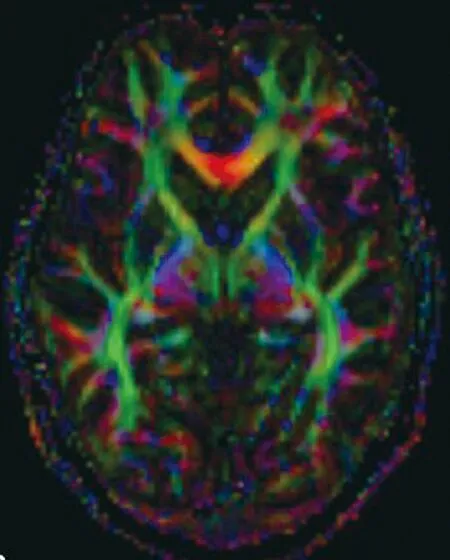
图1 MHE患者DTI的FA值图,绿色、红色、蓝色代表不同走行方向的白质纤维束Figure 1 FA map of DTI in MHE patients.The color of green,red and blue represent white matter fibers in different directions
1.5统计学分析采用SPSS 20.0进行统计学分析。对正常对照组、单纯肝硬化组和MHE组各个解剖部位的ADC值和FA值先行正态性检验和方差齐性检验。符合正态分布3组间ADC值和FA值比较采用单因素方差分析(ANOVA),两两比较采用LSD检验;不符合正态分布则采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1常规MRI表现30例肝硬化患者中,18例于T1WI图像上可见到双侧内囊、苍白球对称性高信号(图2A),T2WI、DWI及FLAIR序列无明显异常改变(图2B、C)。

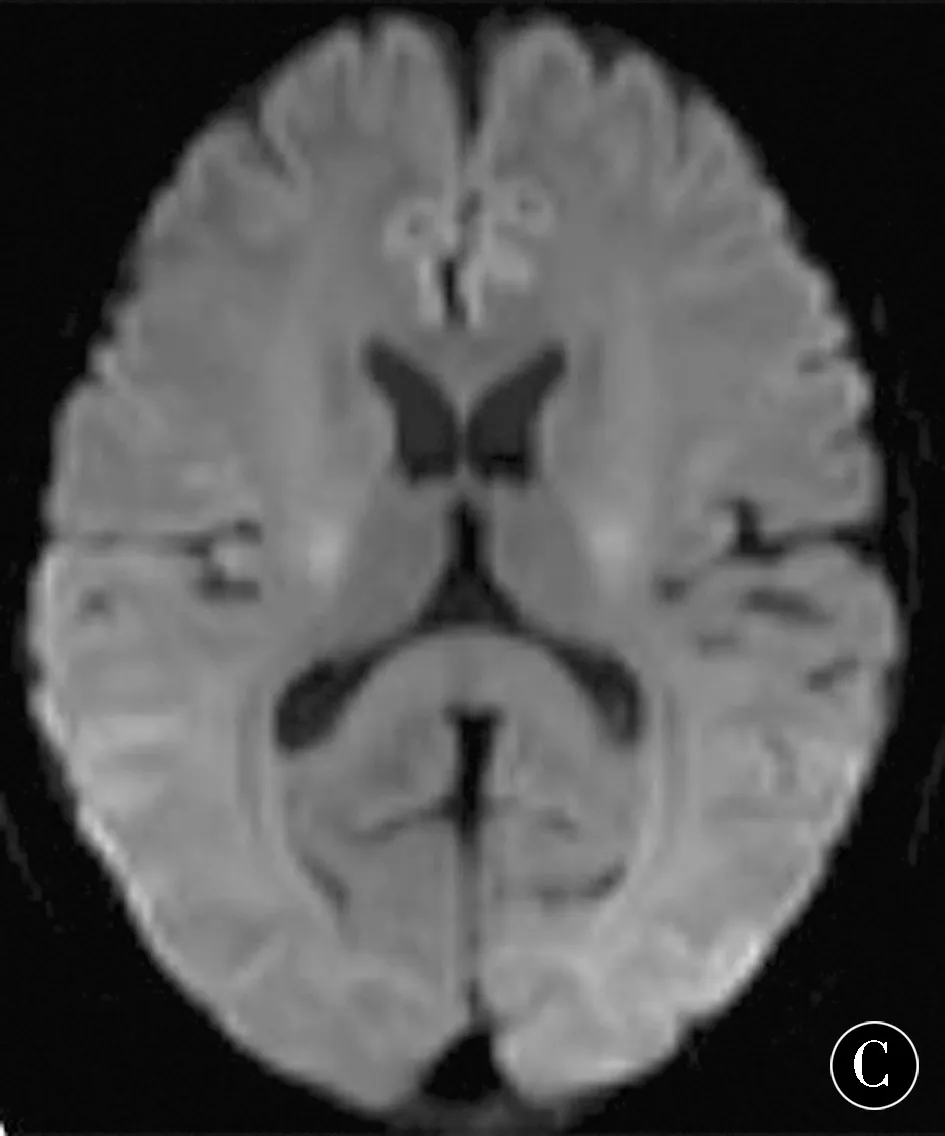
图2 男,56岁,MHE患者,T1WI (A)示双侧苍白球对称性高信号;T2WI(B)和 DWI(C)脑实质内未见异常
Figure 2 A 56-year old male patient with MHE.T1WI (A) shows symmetric high signal intensity of bilateral globus pallidum;No abnormalities were found in T2WI(B) and DWI(C)
2.2正常对照组、单纯肝硬化组和MHE组ADC值比较对正常对照组、肝硬化组、MHE组各个解剖部位的ADC值进行单因素方差分析,结果显示,除背侧丘脑以外,额叶、枕叶白质、胼胝体膝部、胼胝体压部、内囊前肢、内囊后肢、尾状核头部由正常组、肝硬化组至MHE组ADC值逐渐增加,且MHE组的ADC值较肝硬化组和正常组增加,差异有统计学意义(P<0.05)。见表1。
2.3正常对照组、单纯肝硬化组和MHE组FA值比较对正常组、肝硬化组、MHE组各个解剖部位的FA值进行单因素方差分析,结果显示,胼胝体膝部和压部的 FA 值由正常组、肝硬化组至MHE组逐渐降低具有统计学差异(P<0.05),且胼胝体膝部的FA值在3组之间依次降低(P<0.05)(图3);余各解剖部位的FA值均无明显差异(P>0.05)。见表2。

表1 正常组、单纯肝硬化组、MHE组ADC值比较Table 1 Comparison of ADC values between normal group, simple liver cirrhosis group and MHE
注:与正常组比较,*P<0.05;与单纯肝硬化组比较,#P<0.05

表2 正常组、单纯肝硬化组、MHE组FA值比较Table 2 Comparison of FA values between normal group, simple liver cirrhosis group and MHE
注:与正常组比较,*P<0.05;与单纯肝硬化组比较,#P<0.05
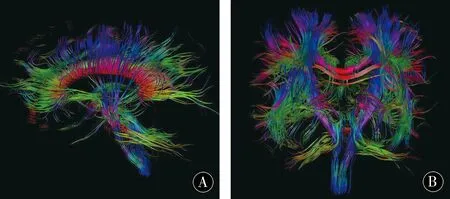
图3 沿胼胝体走行方向白质纤维束的FA图,分别为矢状位(A)和冠状位(B)成像Figure 3 FA map of white matter fibers along the corpus callosum,sagittal (A) and coronal (B) images
3 讨论
MHE为肝性脑病的早期阶段,虽然没有明显的临床表现,但会影响患者的日常生活能力,降低患者的生活质量,如果不进行干预将在短期内发展为显性肝性脑病[14]。尽管通过神经心理学测试对MHE筛查较为简单实用,但无法真正反映脑功能的变化。肝硬化继发肝性脑病在常规MRI只表现为苍白球、内囊等基底节区的T1WI对称性高信号,这种T1WI异常高信号可能是锰沉积造成的[15],但只有部分肝性脑病能出现此征象。因此,常规MRI检查不能发现肝硬化早期的脑功能异常。
DTI能够显示脑白质纤维束走向和排列,其主要的定量参数值为FA值。ADC值反映的是水分子自由扩散的程度,而FA值能够间接体现白质完整性和髓鞘成熟化过程[16-17]。FA值升高,说明纤维束走形一致且排列紧密,水分子扩散受限,ADC值减小。FA值降低,纤维束结构不完整,或排列稀疏,水分子扩散屏障减少,ADC值增大。FA值和ADC值相结合能够对脑组织各个方向的扩散各向异性进行定量测量,反映纤维束走形和排列的程度以及纤维束结构的完整性[18]。
本研究发现,额叶白质、枕叶白质、胼胝体膝部、胼胝体压部、内囊前肢、内囊后肢、尾状核头部的ADC值在正常组、肝硬化组、MHE 组间差异有统计学意义,呈递增趋势,且MHE组的ADC值较正常组和肝硬化组增加差异均有统计学意义,与国外部分研究结果相吻合[19-20]。MHE患者脑内多个部位的ADC值增加可能因血脑屏障通透性增加,脑组织广泛的血管源性水肿,但这种血管源性水肿程度较轻,可能引起大分子物质向细胞外聚集导致细胞外液增多[21-22]。但同样的部位测量FA值后,发现仅有胼胝体膝部和压部的FA值在正常组、肝硬化组和MHE组间逐渐降低且差异有统计学意义,说明胼胝体的白质纤维结构的完整性可能受损或排列走行稀疏,或伴炎性脱髓鞘改变。研究[23-24]发现,MHE患者在内囊、丘脑、放射冠、枕叶等多个部位的白质纤维束FA值降低,比本研究仅发现胼胝体FA值减低的范围要广泛,并且认为FA值的广泛降低与白质纤维结构完整性受损和渗出性脱髓鞘有关。但彭君等[25]对7个解剖部位的FA值进行测量后没有发现FA值差异有统计学意义,认为MHE病人的脑白质微细结构完整性未受到破坏。GROVER等[26]对MHE患者DTI的研究也未观察到FA值有显著性差异,认为MHE患者脑白质微结构完整,无脱髓鞘或神经元丢失等现象。因此,MHE患者脑组织内是否存在白质纤维微结构的破坏和白质纤维束走行的紊乱尚无定论。
本研究尚存在一定的局限性,如样本量较小,后期需扩大样本量;各个解剖部位的ADC值和FA值均为手工勾画ROI,ROI勾画的大小范围会影响数据的准确性。
本研究显示,MHE患者脑组织内多部位ADC值升高以及胼胝体FA值降低,提示脑组织可能存在广泛的轻度脑水肿及胼胝体白质纤维结构完整性受损。DWI与DTI联合应用能够预测肝硬化患者MHE的进展程度,具有潜在的临床价值。
