多元糖醇混合物的蓄放热性能
2020-04-27王飞波孟祥瑞李敏霞马一太
王飞波,孟祥瑞,李敏霞,马一太
多元糖醇混合物的蓄放热性能
王飞波1, 2,孟祥瑞1, 2,李敏霞1, 2,马一太1, 2
(1. 天津大学机械工程学院,天津 300350;2. 天津大学中低温热能高效利用教育部重点实验室,天津 300350)
糖醇由于具有高热能存储密度、价格低廉、无毒、无腐蚀性等优点在热能存储领域中有较好的应用前景.为拓宽糖醇材料相变温度范围,同时获得较高的相变潜热,提高重结晶性,使其更加适用于中低温相变储能,对一元糖醇赤藓糖醇、木糖醇、山梨糖醇、甘露醇和多元共晶糖醇及混合糖醇的蓄放热性能进行实验研究. 实验结果表明:赤藓糖醇和甘露醇在中低温相变储能中的实际工程应用性较强;多元共晶糖醇体系熔点较一元糖醇降低,部分多元共晶糖醇体系的熔化潜热较一元糖醇升高,赤藓糖醇-甘露醇二元共晶体系较一元甘露醇熔点降低30.9%,熔化潜热提高12%,但是所有多元共晶体系重结晶性均变差,在降温过程中均未出现凝固结晶现象;甘露醇对于赤藓糖醇-甘露醇二元共晶体系具有一定的成核剂作用,可以提高其重结晶性. 研制了一种新型混合糖醇相变储能材料,即甘露醇与赤藓糖醇的摩尔比为1.1的混合物,其熔化温度范围112.47~156.88℃,熔化潜热271.71J/g,凝固温度范围77.05~47.48℃,凝固潜热158.6J/g,且DSC凝固曲线双峰部分重叠,经过50次升降温过程,其熔化潜热仅损失2.8%,凝固潜热仅损失3.6%,重结晶性较好;在25~100℃的温度区间内,随着温度的升高,混合物材料的准稳态比热容在0.990~1.010J/(g·℃)之间总体上呈现出先减后增的趋势,作为相变储能材料在实际工程中的应用性较强.
糖醇;相变材料;熔化;凝固;储能
相变储能材料是对于高效利用太阳能[1]和回收工业余热[2]等具有重要意义的材料.潜热储能比显热储能具有更大的储能密度,其在蓄热与放热时的温差也更小.在相变储能材料的发展过程中,许多国家、地区的学者研究了许多不同的材料,主要包括结晶水合盐、无机盐、石蜡、脂肪酸、多元醇、金属及合金、陶瓷基复合储能材料和功能热流体等.其中,糖醇是一种多元醇,含有两个以上的羟基.糖醇由于具有高热能存储密度、价格低廉、无毒、无腐蚀性等优点在热能存储领域中有较好的应用前景[3].
近年来,越来越多的研究人员开始研究糖醇. Seppälä等[4]研究了不同添加剂对木糖醇结晶速率的影响.Solé等[5]研究了甘露醇、半乳糖醇和肌醇的热稳定性和化学稳定性.Sari等[6]制备甘露醇与半乳糖醇的低共熔混合物,发现通氮气可以很好地保护材料不被氧化,加入适量的成核剂可以提高材料的化学和热稳定性,过多反而导致材料的结晶焓值减小. Makuta等[7]合成了氰基丙烯酸酯包裹的木糖醇微胶囊,发现这种材料可以长时间地储能,稳定性比较好. Diarce等[8]研究木糖醇、山梨糖醇和赤藓糖醇二元混合物的热物理性质,结果显示它们的过冷度较大. Shin等[9]通过往赤藓糖醇里面加入膨胀石墨来提高材料的导热性能.Yu等[10]对比了甘露醇和甘露醇与赤藓糖醇低共熔混合物的热物理性质,发现甘露醇的混合物有更好的性能.Del Barrio等[11]使用差示扫描量热分析(DSC),测量了5种糖醇(木糖醇、核糖醇、L-阿拉伯糖醇、赤藓糖醇、甘露醇)的比热容和3种共晶混合物(赤藓糖醇/木糖醇、L-阿拉伯糖醇/赤藓糖醇、L-阿拉伯糖醇/木糖醇)的比热容,温区是1~20℃.在文献[12-14]中,常见糖醇的熔点为90~200℃,且具有较高的固液相变潜热.糖醇因此被考虑用作中低温区的相变储热材料[15-17].目前对于二元糖醇混合物的研究较多,但是对于三元及以上的糖醇混合物的研究较少,且糖醇材料在低于90℃的温度区域使用效果并不理想,这使其应用受到限制,严重影响了实际使用性能.为拓宽糖醇材料相变温度范围,同时获得较高的相变潜热,增强其重结晶性,使其更加适合应用于中低温相变储能,对糖醇材料及多元糖醇混合物的蓄放热性能进行实验研究,制备熔点较低、相变潜热较高、重结晶性较好、综合成本较低的糖醇相变储能材料,提供更多的实验数据,为后续糖醇材料的进一步提升与研究奠定基础.
1 实验原理与方法
1.1 实验原理
共晶体系是指两种或多种不同化学物质,经过混合后,能够在低于各自熔点的温度条件下进行加热熔合.为使糖醇作为储能材料熔点尽可能降低,拓宽其相变温度范围,同时获得较高的相变潜热,使其更加适合应用于中低温相变储能.本实验使用了两种及多种不同类型的糖醇进行混合,以便形成具有共晶体系的混合物.
基于吉布斯过剩自由能的热力学模型[18],对所研究体系的固液平衡线进行建模.当共晶体系为二元时,式(1)~(4)用于计算所研究体系的固液平衡,式(1)、(2)和(3)联立时适用于共晶点.当系统温度达到共晶温度E,即=E时,可根据式(1)~(3)推导出式(4).首先根据式(4)计算出共晶温度E,然后根据式(1)和(2)得出A、B两种糖醇共晶时的摩尔比,再计算出相应的质量比.该模型的数学表达式为
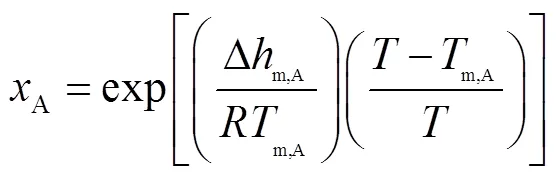
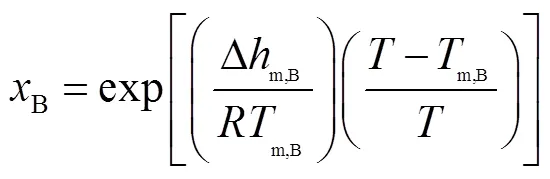
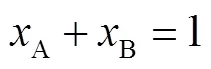

式中:x为共晶组分的摩尔分数;为气体常数,取8.314J/(mol·K);m,i为共晶组分的熔点,可通过DSC测量直接得出;为系统温度;∆m,i为共晶组分的摩尔熔化焓,可通过DSC测量得出的熔化潜热转化得出,二者关系为
共晶成分熔化焓∆e的理论值计算式为
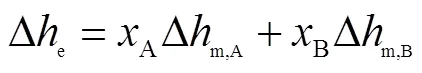
比热容作为热力学中至关重要的物理量,是材料储热能力的标度,不仅可以用来衡量物质所包含的显热,还可以推导出包括标准摩尔熵、标准摩尔生成焓和标准摩尔生成吉布斯自由能等基础热力学参数.但是采用传统DSC测量比热容准确度并不高,误差一般在5%~10%.本文采用随机温度调制差示扫描量热技术(TOPEM)[19]进行比热容的测量.该技术是基于随机温度调制,并作为温度调制DSC的广义理论的成果而发展起来的.无需进一步校准,在宽频范围内的单次实验就可以测定出准稳态比热容.
1.2 实验方法
采用差示扫描量热仪(Mettler-Toledo,DSC3+)对一元糖醇和混合糖醇的相变起始温度及相变焓等相变相关参数进行测量.该仪器在实验前已经用校准标样铟(In)进行了标定校准.实验在高纯氮气(浓度99.999%)气氛下进行,其中吹扫气体体积流量为40mL/min,保护气体体积流量为100mL/min,加热/冷却速率为5K/min,最大升温范围为25~200℃,最大降温范围为200~20℃,糖醇试样的质量约为10mg.
实验流程如图1所示.采用“研磨混合法”进行混合糖醇样品的制备,流程如下:将实验用糖醇在电热鼓风干燥箱中60℃恒温干燥12h,充分去除其水分.使用分析天平(Mettler-Toledo,XSE105DU,精度0.01mg)称取合适质量的糖醇倒入研钵中,滴入少量具有挥发性质的乙醚,研磨约60min,待混合均匀后收集粉末状产物.为使实验结果更为精确可靠,对每个实验组均进行3次平行实验,取平均值为最终结果,此外,对同一试样进行连续3次的升/降温重复实验,以观察有无重结晶现象发生.TOPEM方法的实验操作过程与DSC类似,只不过为使其升降温过程接近准稳态,将加热/冷却速率降为1K/min,最大升/降温范围设定为室温至相变前温度,脉冲高度设置为1K,脉冲宽度设置为15~30s.

图1 实验流程
晶体生长速率被抑制会导致其过冷度增大.常用的减小过冷度的措施有加成核剂法、冷手指法、超声波成核法、弹性势能法、搅拌法、微胶囊封装法等.其中,加成核剂法依据非均匀成核机理[20],操作简单且最为经济,最适合应用在实际工程中.甘露醇是一种白色针状或斜方柱状晶体或结晶性细粉末. 通过实验探究将甘露醇作为成核剂加入糖醇材料中以提高其重结晶性,从而提高糖醇作为相变储能材料在实际工程中应用的可行性.
2 实验结果与分析
2.1 一元糖醇
通过对大量文献调研,综合考虑糖醇材料的热物性质、化学性质、综合成本等因素,筛选出4种糖醇材料作为研究对象,分别为赤藓糖醇、木糖醇、山梨糖醇和甘露醇.4种糖醇的基本信息如表1所示.
对4种一元糖醇进行DSC实验测试,得出其m和测量值、实验误差及有无重结晶现象发生如表2所示,其中m和测量值取3组平行实验中的第1次升/降温过程数据,重结晶性能根据对同一试样进行连续3次的升降温重复实验的DSC曲线观察得出.对同一种一元糖醇进行连续3次的升降温重复实验,发现赤藓糖醇和甘露醇有重结晶现象发生、较高但m偏高,而木糖醇和山梨糖醇无重结晶现象发生、较低但m偏低.说明在本文选用的4种一元糖醇中,赤藓糖醇和甘露醇在中低温相变储能中的实际工程应用性较强.
表1 糖醇基本信息
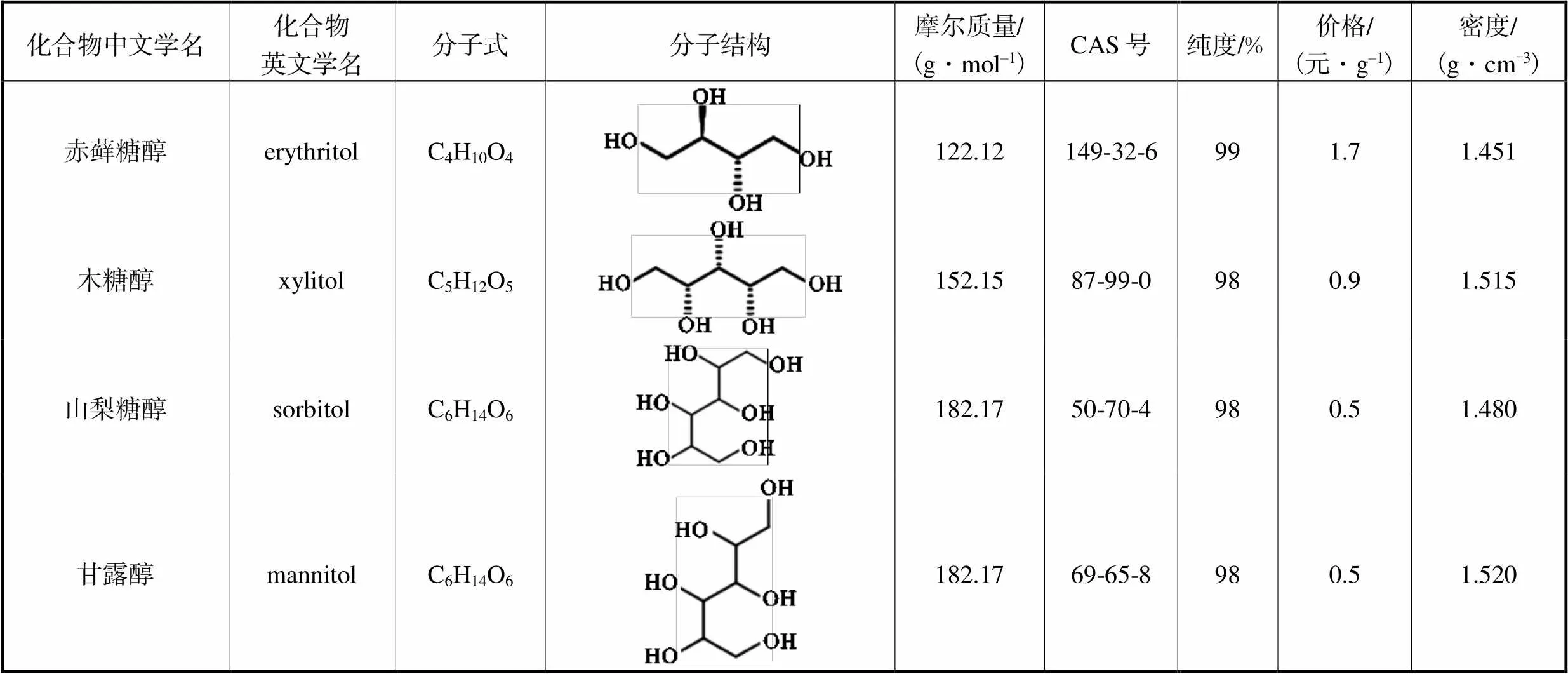
Tab.1 Basic information of sugar alcohols
表2 一元糖醇DSC实验结果
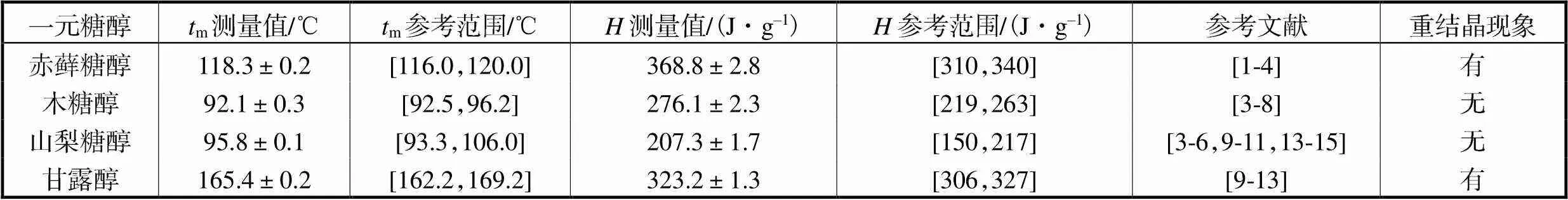
Tab.2 DSC experimental results of unitary sugar alcohol
2.2 多元共晶糖醇
根据吉布斯过剩自由能的热力学模型[18],制备出11种多元共晶糖醇体系.对11种多元共晶糖醇体系进行DSC实验测试,其E、成分及摩尔比、m、、实验误差及有无重结晶现象发生如表3所示,其中E为根据式(4)计算得出的理论值,成分及摩尔比则根据式(1)~(4)计算得出.
表3 多元共晶糖醇体系DSC实验结果
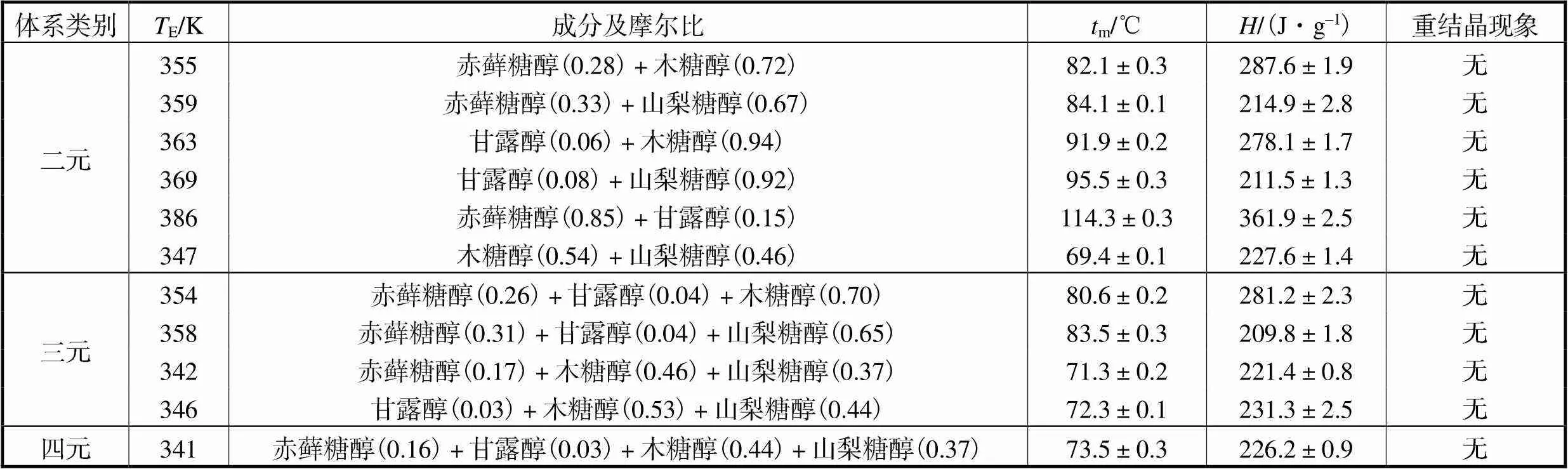
Tab.3 DSC experimental results of poly-eutectic sugar alcohol system
从表3中可以看出,含赤藓糖醇的多元共晶体系在m与方面均较一元糖醇降低,分析其原因是因为在4种一元糖醇中,赤藓糖醇的是最高的,故根据式(1)或式(2)形成共晶体系后在m降低的同时,根据式(6),其也会降低.同理,在含甘露醇的多元共晶体系中,除赤藓糖醇-甘露醇二元共晶体系外,其m和均较一元糖醇降低.含甘露醇的+1元共晶体系与元共晶体系在m与方面均差别不大,皆在5%以内.分析其原因是因为在实验中用到的4种一元糖醇中,甘露醇的m最高,相对分子质量最大,所以形成共晶体系后其摩尔组成含量较低,除在赤藓糖醇-甘露醇二元共晶体系中摩尔分数占15%外,在其他多元体系中仅占不到8%.在含木糖醇的多元共晶体系中,赤藓糖醇-木糖醇二元共晶体系与赤藓糖醇-甘露醇-木糖醇三元共晶体系较一元木糖醇m分别降低10.9%和12.9%,分别提高4.2%和1.9%.在含山梨糖醇的多元共晶体系中,除甘露醇-山梨糖醇二元共晶体系与一元山梨糖醇差别不大之外,其余多元共晶体系较一元山梨糖醇m降低12.2%~27.6%,提高1.2%~11.6%.但在以上所有多元共晶体系中,赤藓糖醇-甘露醇二元共晶体系较一元甘露醇m降低30.9%,提高12%,作为中低温相变储能材料低熔点高焓值的性质提升效果最佳.
由此可知,通过研磨混合的方式制取的多元共晶糖醇体系,其m较一元糖醇降低,部分多元共晶糖醇体系的较一元糖醇升高,但是其重结晶性均变差,在降温过程中均未出现凝固结晶现象.部分多元共晶糖醇体系在加热过程中从熔融态重新结晶,并非在冷却过程中结晶,即出现冷结晶现象[21].部分多元共晶糖醇体系甚至出现玻璃化转变现象,导致其在进行一次测试后完全失去结晶能力,无法重复使用.冷结晶现象和玻璃化转变现象的发生与材料性质、冷却速度、杂质种类和含量以及各种外加因素等相关,其机理十分复杂,但主要原因是因为熔融态共晶糖醇的黏度较大,抑制了晶体生长的速率[22].值得注意的是,一元赤藓糖醇和一元甘露醇的重结晶性能极好,多次蓄放热后仍以晶体态存在,但是两者组成的赤藓糖醇-甘露醇二元共晶体系的重结晶性却极差,经过一次升温过程熔化后便无法在降温过程出现凝固结晶现象,其DSC测试曲线如图2所示.分析其原因可能是因为赤藓糖醇和甘露醇在研磨混合形成赤藓糖醇-甘露醇二元共晶体系后,物理性质发生改变,黏度增大.冷结晶现象和玻璃化转变现象在以木糖醇和D-山梨糖醇为代表的一元糖醇熔化-凝固过程中也经常出现,严重影响了糖醇作为相变储能材料在实际工程中的应用.
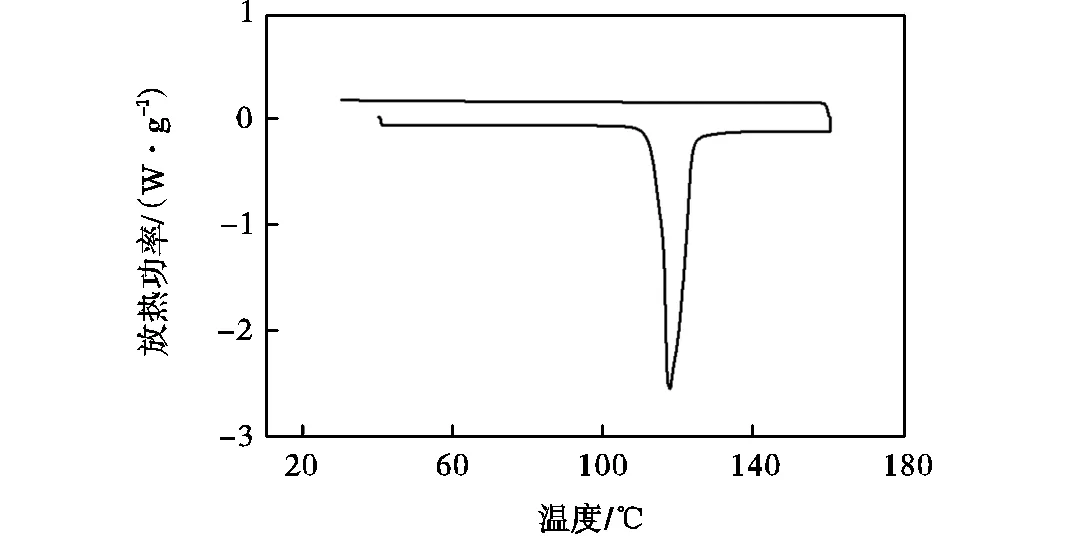
图2 赤藓糖醇-甘露醇二元共晶体系DSC测试图
2.3 混合糖醇
因多元共晶糖醇体系在升温过程熔化后无法在降温过程出现凝固结晶现象,故对含有多元共晶糖醇体系和一元糖醇的混合糖醇进行研究.
采用“研磨混合法”制备6组二元糖醇等摩尔比混合物,分别为赤藓糖醇/木糖醇、赤藓糖醇/山梨糖醇、甘露醇/木糖醇、甘露醇/山梨糖醇、赤藓糖醇/甘露醇、木糖醇/山梨糖醇.对其进行DSC测试,发现除赤藓糖醇和甘露醇的等摩尔比混合物在升温后的降温过程中出现凝固结晶现象外,其他二元糖醇等摩尔比混合物均未出现凝固结晶现象.赤藓糖醇/甘露醇等摩尔比混合物DSC测试图如图3所示.将图2和图3进行对比,可以看出,在赤藓糖醇-甘露醇二元共晶体系中,赤藓糖醇与甘露醇的摩尔比为0.85∶0.15即17∶3,在升温后的降温过程中未出现凝固结晶现象,而赤藓糖醇/甘露醇等摩尔比混合物在升温后的降温过程中却出现凝固结晶现象.这是因为赤藓糖醇/甘露醇等摩尔比混合物的成分为赤藓糖醇-甘露醇二元共晶体系和少量甘露醇,所以赤藓糖醇/甘露醇等摩尔比混合物的DSC测试曲线降温部分为双峰,即赤藓糖醇-甘露醇二元共晶体系和甘露醇在升温后的降温过程中出现凝固结晶现象.说明甘露醇对于赤藓糖醇-甘露醇二元共晶体系的重结晶性具有一定的提高作用,即具有一定的成核剂作用,可以减小赤藓糖醇-甘露醇二元共晶体系的凝固过冷度.
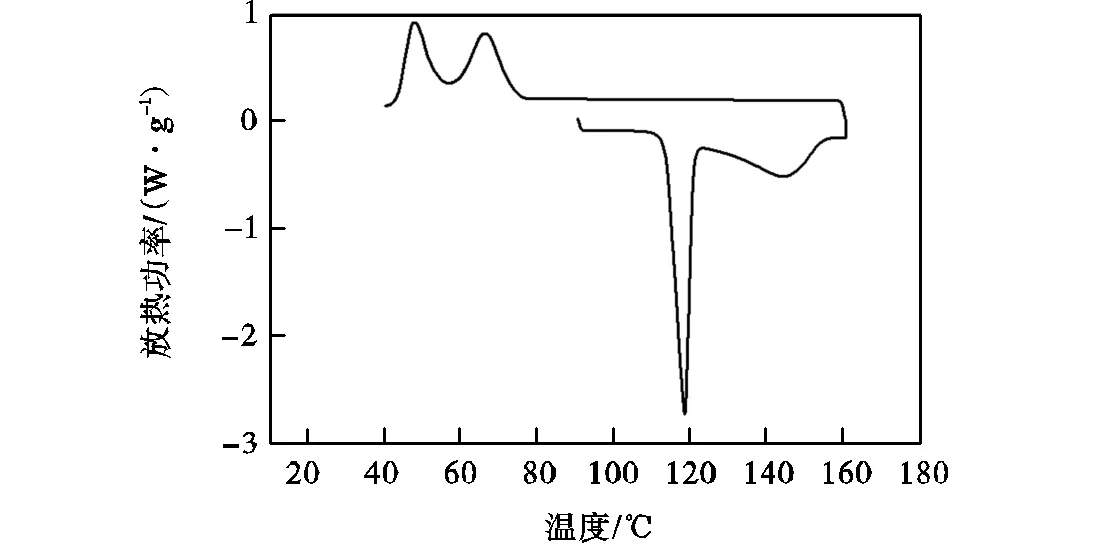
图3 赤藓糖醇/甘露醇等摩尔比混合物DSC测试图
为探究赤藓糖醇/甘露醇混合物中,使其相变温度范围较宽且相变潜热较高的最适合应用于中低温相变储能的最佳摩尔比,采用“研磨混合法”制备11组赤藓糖醇/甘露醇混合物,其中甘露醇与赤藓糖醇的摩尔比分别为0.3、0.5、0.8、1.0、1.1、1.2、1.3、1.5、1.7、1.9、2.0.对各组混合糖醇进行DSC测试,混合物的m、熔化终止点、及凝固起止点、凝固潜热值及实验误差如表4所示.
从表4的实验数据中可以看出,当甘露醇和赤藓糖醇摩尔比小于0.8时,混合物经过升温过程熔化后无法在降温过程出现凝固结晶现象.当甘露醇和赤藓糖醇摩尔比大于0.8时,混合物经过升温过程熔化后可以在降温过程出现凝固结晶现象.当甘露醇和赤藓糖醇摩尔比在0.8~2.0时,m、熔化温度范围及皆差别不大,最大值与最小值之间相差不超过5%.但是混合物的凝固物性差别较大,其中,当甘露醇和赤藓糖醇摩尔比为0.8时,其凝固潜热最低,为其他组数据最小值的68%.当甘露醇和赤藓糖醇摩尔比为1.1时,混合物凝固温度范围最小,在作为相变储能材料时,可以在换热流体温度降低时短时间较快地放出热量.甘露醇和赤藓糖醇摩尔比为1.1和1.2时的混合物凝固DSC测试图如图4所示,从图中可以看出,在降温段凝固过程中,甘露醇和赤藓糖醇摩尔比为1.1的混合物出现了凝固双峰部分重叠的现象,而甘露醇和赤藓糖醇摩尔比为1.2的混合物则出现了凝固双峰分离的现象.
表4 赤藓糖醇/甘露醇混合物DSC测试数据

Tab.4 DSC test data of erythritol/mannitol mixture
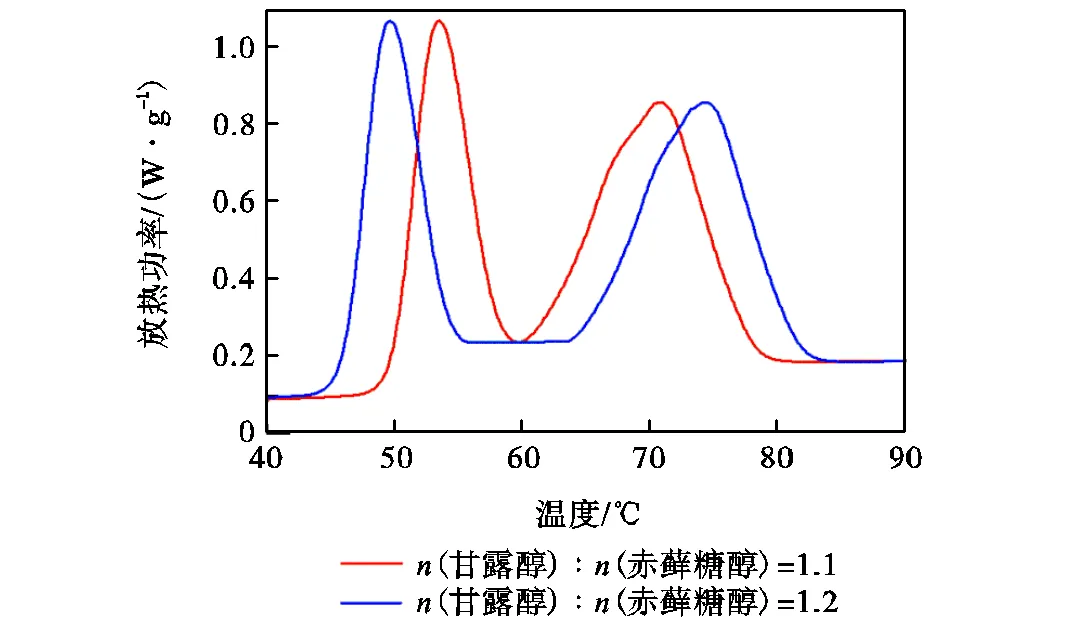
图4 甘露醇和赤藓糖醇摩尔比为1.1和1.2的混合物凝固DSC测试图
对甘露醇和赤藓糖醇摩尔比为1.1的混合物进行多次重复DSC测试,其DSC测试曲线如图5所示.从图5中可以看出,经过多次蓄放热过程,材料仍然可以发生熔化和凝固现象,其重结晶性较强.经过50次升降温过程,其熔化潜热仅损失2.8%,凝固潜热仅损失3.6%.
利用TOPEM方法对甘露醇和赤藓糖醇摩尔比为1.1的混合物的准稳态比热容进行测试,测试温度区间设置为25~100℃,升温速率设置为1K/min,脉冲高度设置为1K,脉冲宽度设置为15~30s,其测试结果如图6所示.其中图6(a)为不加蓝宝石标样的测试,图6(b)为加蓝宝石标样的测试.从图6中可以看出,在25~100℃的温度区间内,随着温度的升高,混合物的准稳态比热容总体上呈现出先减后增的趋势.不加蓝宝石标样测试的准稳态比热容在0.975~1.010J/(g·℃)之间,而加蓝宝石标样的测试的稳态比热容在0.990~1.025J/(g·℃)之间,但总体上差别不大,混合物的稳态比热容在0.990~1.010J/(g·℃)之间.
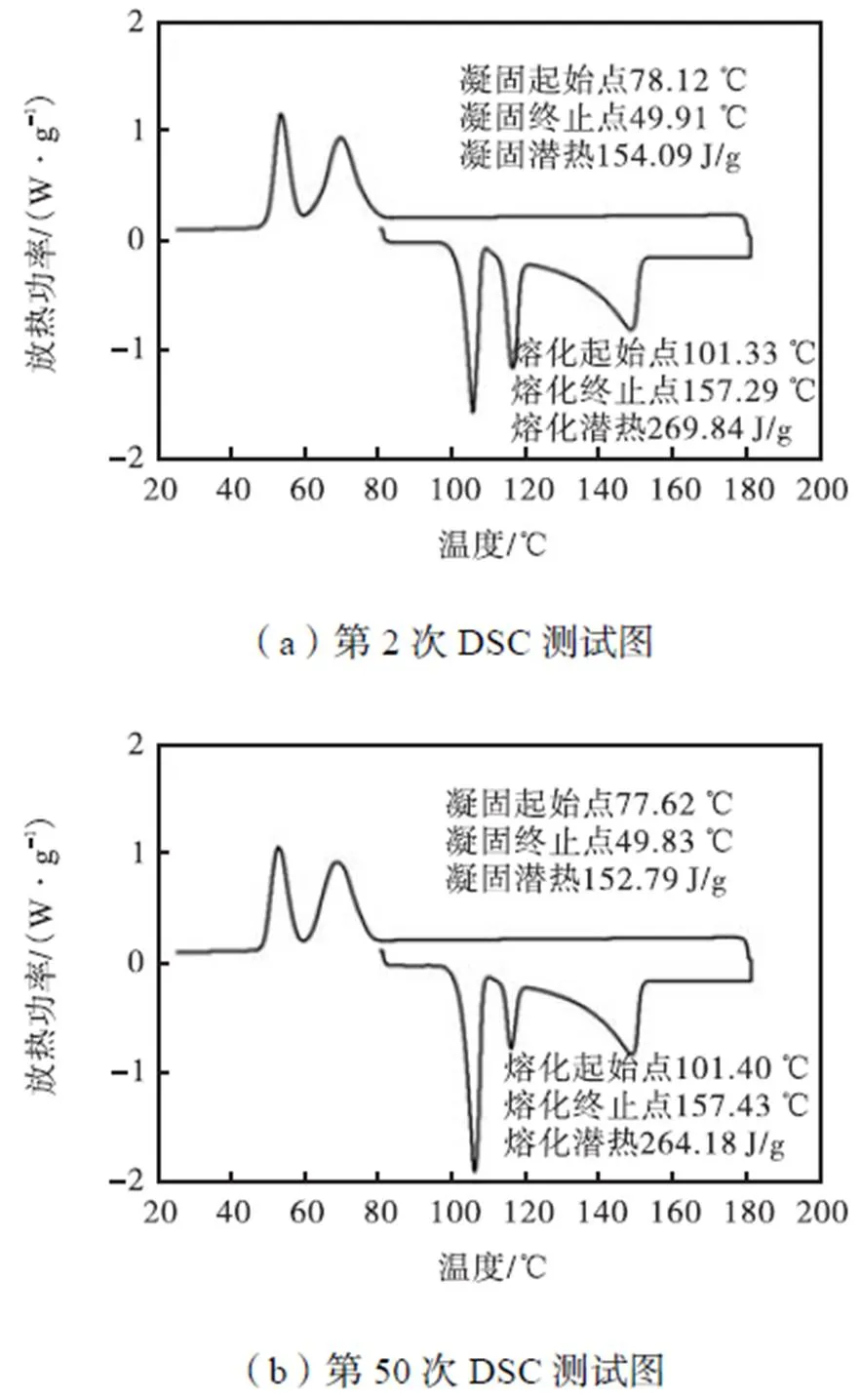
图5 甘露醇和赤藓糖醇摩尔比为1.1的混合物多次重复DSC测试图
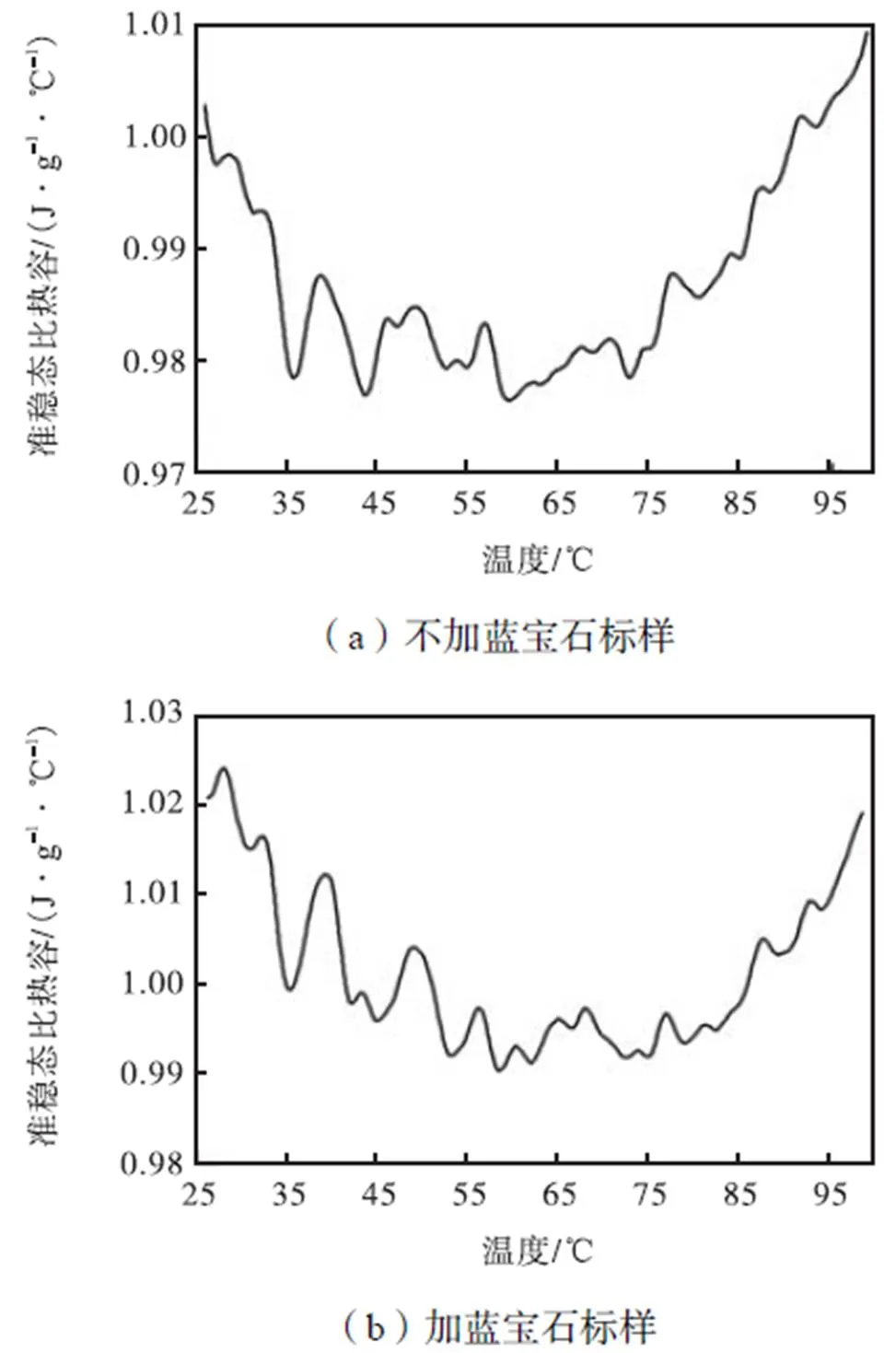
图6 甘露醇和赤藓糖醇摩尔比为1.1的混合物准稳态比热容测试图
由此可知,在甘露醇与赤藓糖醇的摩尔比为1.1时,熔化温度范围112.47~156.88℃,熔化潜热271.71J/g,凝固温度范围77.05~47.48℃,凝固潜热158.6J/g,且DSC凝固曲线双峰部分重叠.经过50次升降温过程,其熔化潜热仅损失2.8%,凝固潜热仅损失3.6%,重结晶性较强.混合物的准稳态比热容在0.990~1.010J/(g·℃)之间.作为相变储能材料在实际工程中的应用性较强.
3 结 论
为拓宽糖醇材料相变温度范围,同时获得较高的相变潜热,提高重结晶性,使其更加适合应用于中低温相变储能,本文主要基于吉布斯过剩自由能的热力学模型,采用“研磨混合法”制备了多元共晶糖醇体系及含有共晶体系的糖醇混合物.对一元糖醇、多元共晶糖醇及混合糖醇的蓄放热性能进行实验研究,得到的结论如下.
(1)通过DSC实验测试,将实验数据与参考文献数据进行比较,发现赤藓糖醇和甘露醇可以重结晶、熔化潜热较高但m偏高,而木糖醇和山梨糖醇不可以重结晶、熔化潜热较低但m偏低.赤藓糖醇和甘露醇在中低温相变储能中的实际工程应用性较强.
(2) 通过研磨混合的方式制取的多元共晶糖醇体系,其m较一元糖醇降低,部分多元共晶糖醇体系的较一元糖醇升高,赤藓糖醇-甘露醇二元共晶体系较一元甘露醇m降低30.9%,提高12%,作为中低温相变储能材料低熔点高焓值的性质提升效果最佳.但是所有多元共晶体系重结晶性均变差,在降温过程中均未出现凝固结晶现象.部分出现冷结晶现象,甚至玻璃化转变现象,无法重复使用,严重影响了糖醇作为相变储能材料在实际工程中的应用.
(3) 甘露醇对于赤藓糖醇-甘露醇二元共晶体系具有一定的成核剂作用,可以减小赤藓糖醇-甘露醇二元共晶体系的凝固过冷度,提高其重结晶性.在甘露醇与赤藓糖醇的摩尔比为1.1时,熔化温度范围112.47~156.88℃,熔化潜热271.71J/g,凝固温度范围77.05~47.48℃,凝固潜热158.6J/g,在升温后的降温段凝固过程中,出现了凝固双峰部分重叠的现象,其凝固温度范围较小且凝固点较高,在作为相变储能材料时,可以在换热流体温度降低时短时间较快地放出热量.经过50次升降温过程,其熔化潜热仅损失2.8%,凝固潜热仅损失3.6%,重结晶性较强.混合物在25~100℃的温度区间内,随着温度的升高,混合物的准稳态比热容在0.990~1.010J/(g·℃)之间总体上呈现出先减后增的趋势.作为相变储能材料在实际工程中的应用性较强.
[1] Xu B,Li P,Chan C. Application of phase change materials for thermal energy storage in concentrated solar thermal power plants:A review to recent developments[J]. Applied Energy,2015,160:286-307.
[2] Sun F,Zhao J,Fu L,et al. New district heating system based on natural gas-fired boilers with absorption heat exchangers[J]. Energy,2017,138:405-418.
[3] Sharma R K,Ganesan P,Tyagi V V,et al. Developments in organic solid-liquid phase change materials and their applications in thermal energy storage[J]. Energy Conversion & Management,2015,95:193-228.
[4] Seppälä A,Meriläinen A,Wikström L,et al. The effect of additives on the speed of the crystallization front of xylitol with various degrees of supercooling[J]. Experimental Thermal & Fluid Science,2010,34(5):523-527.
[5] Solé A,Neumann H,Niedermaier S,et al. Stability of sugar alcohols as PCM for thermal energy storage[J]. Solar Energy Materials & Solar Cells,2014,126(11):125-134.
[6] Sari A. Thermal characteristics of a eutectic mixture of myristic and palmitic acids as phase change material for heating applications[J]. Applied Thermal Engineering,2003,23(8):1005-1017.
[7] Makuta T,Kadoya K,Izumi H,et al. Synthesis of cyanoacrylate-covered xylitol microcapsules for thermal storage[J]. Chemical Engineering Journal,2015,273:192-196.
[8] Diarce G,Gandarias I,Campos-Celador A,et al. Eutectic mixtures of sugar alcohols for thermal energy storage in the 50—90 °C temperature range[J]. Solar Energy Materials & Solar Cells,2015,134(3):215-226.
[9] Shin H K,Rhee K Y,Park S J. Effects of exfoliated graphite on the thermal properties of erythritol-based composites used as phase-change materials[J]. Composites Part B,2016,96:350-353.
[10] Yu J S,Horibe A,Haruki N,et al. Melting and solidification characteristics of a mixture of two types of latent heat storage material in a vessel[J]. Heat & Mass Transfer,2016,52(11):1-12.
[11] Del Barrio E P,Godin A,Duquesne M,et al. Characterization of different sugar alcohols as phase change materials for thermal energy storage applications[J]. Solar Energy Materials & Solar Cells,2017,159:560-569.
[12] Del Barrio E P,Cadoret R,Daranlot J,et al. New sugar alcohols mixtures for long-term thermal energy storage applications at temperatures between 70 °C and 100 °C[J]. Solar Energy Materials & Solar Cells,2016,155:454-468.
[13] Diarce G,Gandarias I,Campos-Celador A,et al. Eutectic mixtures of sugar alcohols for thermal energy storage in the 50—90 °C temperature range[J]. Solar Energy Materials & Solar Cells,2015,134(3):215-226.
[14] Paul A,Shi L,Bielawski C W. A eutectic mixture of galactitol and mannitol as a phase change material for latent heat storage[J]. Energy Conversion & Manage-ment,2015,103:139-146.
[15] Cunha J P D,Eames P. Thermal energy storage for low and medium temperature applications using phase change materials—A review[J]. Applied Energy,2016,177:227-238.
[16] Pielichowska K,Pielichowski K. Phase change materials for thermal energy storage[J]. Progress in Materials Science,2014,65(10):67-123.
[17] Sharma A,Tyagi V V,Chen C R,et al. Review on thermal energy storage with phase change materials and applications[J]. Renewable & Sustainable Energy Reviews,2009,13(2):318-345.
[18] Halder G. Introduction to Chemical Engineering Thermodynamics[M]. Delhi:PHI Learning Prt. Lt.,2014.
[19] Schawe J E K,Huetter T,Heitz C,et al. Stochastic temperature modulation:A new technique in temperature-modulated DSC[J]. Thermochimica Acta,2006,446(1):147-155.
[20] 朱亚男. 关于非均匀成核理论[J]. 山东大学学报:自然科学版,1979(3):125-138.
Zhu Yanan. On the theory of nonuniform nucleation[J]. Journal of Shandong University:Natural Science Edition,1979(3):125-138(in Chinese).
[21] Diogo H P,Pinto S S,Moura Ramos J J. Slow molecular mobility in the crystalline and amorphous solid states of pentitols:A study by thermally stimulated depolarisation currents and by differential scanning calorimetry[J]. Carbohydrate Research,2007,342(7):961-969.
[22] Barrio E P D,Godin A,Duquesne M,et al. Characterization of different sugar alcohols as phase change materials for thermal energy storage applications[J]. Solar Energy Materials and Solar Cells,2017,159:560-569.
Thermal Energy Storage and Release Performance of Poly Sugar Alcohol Mixtures
Wang Feibo1, 2,Meng Xiangrui1, 2,Li Minxia1, 2,Ma Yitai1, 2
(1. School of Mechanical Engineering,Tianjin University,Tianjin 300350,China;2. Key Laboratory of Efficient Utilization of Low and Medium Grade Energy of Ministry of Education,Tianjin University,Tianjin 300350,China)
Sugar alcohols have a good application prospect in the field of thermal energy storage because of their high advantages, such as thermal energy storage density, low cost, non-toxicity, and non-corrosiveness. To broaden the phase-transition temperature range of sugar alcohol materials and obtain a higher latent heat of phase change, improve recrystallization, and make it more suitable for low- and medium-temperature phase-change energy storage, the thermal energy storage and release performance of erythritol, xylitol, sorbitol, mannitol, poly-eutectic sugar alcohols, and sugar alcohol mixtures were studied experimentally. Experimental results show that erythritol and mannitol have strong engineering application in low- and medium-temperature phase-change energy storage; the melting point of the poly-eutectic sugar alcohol system is lower than that of the unitary sugar alcohol, melting latent heat of some poly-eutectic sugar alcohol systems is higher than that of the unitary sugar alcohol, melting point of erythritol-mannitol binary eutectic system is 30.9% lower than that of the mono-mannitol system, and melting latent heat is 12% higher; however, the recrystallization of all poly-eutectic sugar alcohol systems is poor, and no solidification phenomenon occurs during the cooling process; mannitol has a certain nucleating agent effect on the erythritol-mannitol binary eutectic system and can improve its recrystallization. Herein, a new type of mixed sugar alcohol phase-change energy storage material was developed. The molar ratio of mannitol to erythritol is 1.1, melting temperature range is 112.47—156.88℃, latent heat of fusion is 271.71 J/g, solidification temperature range is 77.05—47.48℃, latent heat of solidification is 158.6J/g, and double peaks of differential scanning calorimetry (DSC) solidification curve partially overlap. The melting latent heat loss is only 2.8% and solidification latent heat loss is only 3.6% after 50 times heating and cooling processes, and the recrystallization is good. In the temperature range of 25—100℃, with the increase of temperature, the quasi-static specific heat capacity of the mixtures decreases first and then increases between 0.990 and 1.010 J/(g·℃). As a phase-change energy storage material, the developed material has strong application in practical engineering.
sugar alcohol;phase change material;melting;solidification;energy storage
Supported by the Science and Technology Program of Tianjin,China(No.16YFZCGX00080).
TK448.21
A
0493-2137(2020)05-0475-08
10.11784/tdxbz201904013
2019-04-06;
2019-06-03.
王飞波(1964— ),男,博士,教授,feibo_w@outlook.com.
李敏霞,tjmxli@tju.edu.cn.
天津市科技计划资助项目(16YFZCGX00080).
(责任编辑:田 军)
