赤藓糖醇生产母液中糖醇组分的定性鉴定*
2014-12-16赵祥颖张立鹤杨丽萍韩延雷田延军张家祥刘建军
赵祥颖,张立鹤,杨丽萍,韩延雷,田延军,张家祥,刘建军
(山东省食品发酵工程重点实验室,山东省食品发酵工业研究设计院,山东济南,250013)
赤藓糖醇是一种新型的功能性多元醇类甜味剂,甜味特征与蔗糖相似,而热量却接近零,作为甜味剂和填充剂在食品中添加可避免蔗糖或葡萄糖等糖品带来的高热量、糖尿病不适、致龋齿等困扰[1-2]。赤藓糖醇作为一种天然产物广泛存在于真菌(如海藻、蘑菇等)、水果(梨、甜瓜、葡萄等)以及各类发酵食品中(如葡萄酒、清酒、酱油、干酪等),在人或动物的血液、尿液中也可检测到该成分[3-4]。动物实验和临床研究表明,赤藓糖醇食用安全无毒[1],因为其安全性和优越的加工性能,商品赤藓糖醇1990年一经面市就受到食品加工行业的欢迎,可作为香味促进剂、保湿剂、稳定剂、增稠剂等替代蔗糖在各种食品和饮料中添加[5]。此外,研究证明它还具有清除自由基抗氧化活性,可以预防高血糖症对血管壁的伤害[6]。
商品赤藓糖醇是以葡萄糖为原料,经耐高渗酵母菌株发酵转化生成。虽然,已经面市多年,但与其生产相关的研究依然活跃[7-10],研究内容主要集中在菌种的筛选和工艺条件的优化,而对生产下游技术的和副产物的研究相对较少[11]。赤藓糖醇的生产下游提取工艺为:发酵液经菌体分离、脱色、净化、浓缩结晶、再经重结晶精制[12],重结晶母液返回工序循环利用,一次结晶母液经多次浓缩回收赤藓糖醇后废弃。废弃母液是赤藓糖醇生产中主要副产物之一,每生产1t赤藓糖醇就会产生大约0.8~1 m3废弃母液,因为缺乏有效的处理方法,生产企业现一般将母液作为污水处理排放,即浪费了资源,又增加了环境污染负荷和企业污水处理费用。作者等人[11]曾就回收母液中的赤藓糖醇进行研究,在此过程中发现母液中除赤藓糖醇外,还含有另外两种未知组分,初步分析认为这两种组分应是赤藓糖醇发酵过程中产生的其他多元糖醇产物。本研究拟对这两种未知糖醇组分进行鉴定,为赤藓糖醇母液的进一步资源化利用提供科学依据。
1 材料与方法
1.1 实验材料
赤藓糖醇母液由山东滨州三元生物科技有限公司提供。赤藓糖醇标准品,由本实验室用商品赤藓糖醇精制,纯度99.9%。其他试剂及标准物质从试剂公司购买。色谱柱:氨基柱(填料:Hypersil NH25μm,尺寸:4.6 mm ×250 mm),大连依利特分析仪器有限公司;糖分析柱(Shodex SC1011,钙型,8.0mm ×300 mm),昭和电工科学仪器(上海)有限公司。
1.2 仪器设备
UlitiMate3000标准型高效液相色谱仪,戴安(中国)有限公司;RI230型示差折光检测器,昭和电工科学仪器有限公司。
1.3 分析测定方法
1.3.1 HPLC 糖醇分析条件
赤藓糖醇生产母液,经脱色、除离子等净化处理后,配制成固形物1% ~2%的样品进样。其他标准物质配制成约1%的浓度进样。
氨基柱色谱条件:流动相为80∶20的乙腈和水,流速 0.5 mL/min,进样量20 μL,柱温60 ℃。
糖分析柱色谱条件:流动相为去离子水,流速0.5 mL/min,进样量20 μL,柱温 80 ℃。
1.3.2 液质联用分析
赤藓糖醇母液液质联用分析数据,是委托相关机构检验所得。
2 结果与分析
2.1 母液预处理及标准糖醇的选择
本文分析使用的赤藓糖醇母液是生产母液经活性碳脱色、离子交换脱盐、浓缩结晶回收赤藓糖醇后所得母液[11]。母液HPLC氨基柱色谱图如图1。
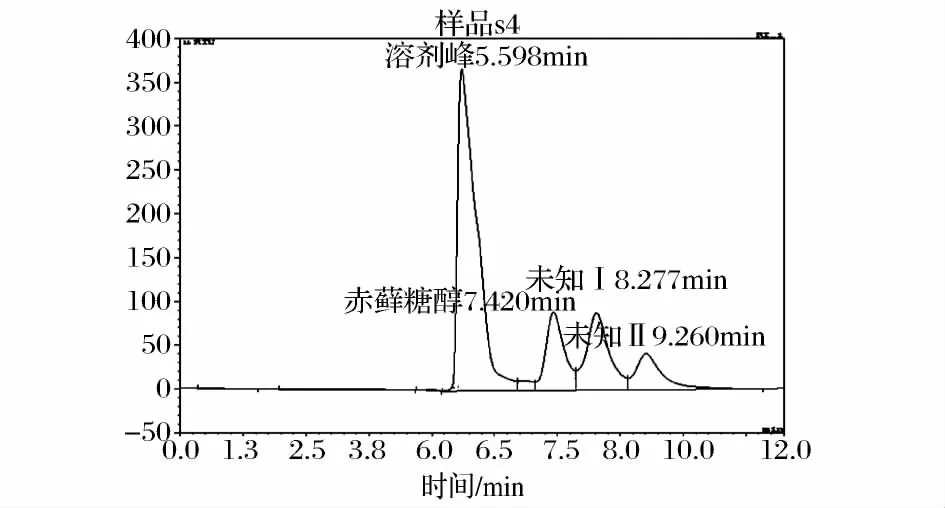
图1 赤藓糖醇母液的HPLC色谱图(氨基柱)Fig.1 The HPLC chromatogram of erythritol mother liquor(NH2column)
有关赤藓糖醇发酵副产物的报道并不多见,报道的主要是甘油[10,14-15],只有一篇文献提到副产物中含有核糖醇[15]。另外,文献中报道微生物合成的多元醇还有阿拉伯糖醇[16]、甘露糖醇[17]、山梨糖醇[18]和木糖醇[19]等。因此,本文选取甘油、赤藓糖醇、阿拉伯糖醇、核糖醇、木糖醇、甘露糖醇、山梨糖醇7种多元醇为标准物质,采用高效液相色谱(HPLC)和液质联用(LC-MS)对赤藓糖醇母液的未知糖醇组分进行定性鉴定。
2.2 氨基柱HPLC分析
图2为7种混合糖醇氨基柱色谱图。混合糖醇样品含有7种糖醇,采用氨基柱分析,谱图中只有4个物质峰,保留时间分别为 6.542、7.420 、8.283 和9.331 min,说明混合糖醇样品中,不同糖醇的保留时间有重叠。对比单一糖醇样品氨基柱色谱分析结果可知,6.542 min 峰为甘油,7.420 min 峰为赤藓糖醇;木糖醇、阿拉伯糖醇和核糖醇保留时间相同(均在8.3 min 左右),因此,8.283 min应为3 种五碳糖醇的叠加峰;甘露糖醇和山梨糖醇保留时间相同,图2中9.331 min峰应是这两种六碳糖醇的叠加峰。母液氨基柱色谱图(图1)中有3个峰,保留时间分别为7.420、8.277 和 9.260 min,没有和甘油保留时间相对应的峰,可以确定母液中不含甘油成分;谱图中7.420 min位置峰与标准赤藓糖醇对应,确定为赤藓糖醇成分。母液谱图中 8.277 min峰(未知峰Ⅰ)与木糖醇、阿拉伯糖醇和核糖醇保留时间基本一致,母液谱图9.260 min位置峰(未知峰Ⅱ),与甘露糖醇和山梨糖醇保留时间一致,因为保留时间重叠,因此,仅采用氨基柱HPLC分析,不能将两未知成分定性。
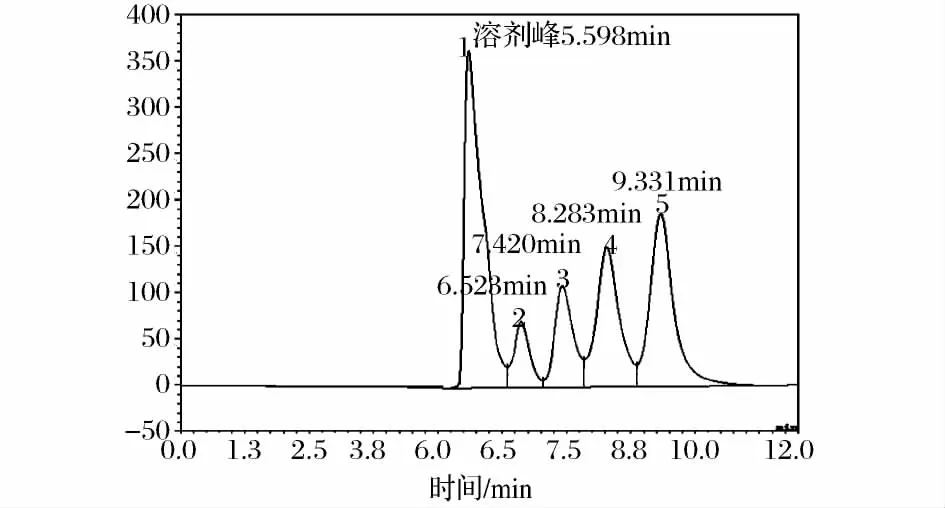
图2 混合糖醇标样的HPLC色谱图(氨基柱)Fig.2 The HPLC chromatograms of mixed sugar alcohol(NH2column)
2.3 糖分析柱HPLC分析
氨基柱分析结果排除了甘油,而木糖醇、阿拉伯糖醇和核糖醇3种五碳糖醇保留时间与母液中的未知峰Ⅰ一致,甘露糖醇和山梨糖醇两种六碳糖醇保留时间与母液中未知峰Ⅱ一致,未能将两未知成分定性。为了进一步区分阿拉伯糖醇、核糖醇和木糖醇,甘露糖醇和山梨糖醇,本文又选用糖分析专用柱(Shodex SC1011)对母液成分进行进一步分析。
母液糖分析柱谱图如图3。图中显示有3个物质峰,保留时间分别为 10.629、11.01 和 13.107 min。标准糖醇的单一糖分析柱分析保留时间分别为:赤藓糖醇 11.01 min,阿拉伯糖醇 13.319 min,核糖醇10.587 min,木糖醇 15.964 min,甘露糖醇 13.321 min,山梨糖醇16.532 min。比较母液色谱图和标准糖醇保留时间可以发现,母液色谱图中没有与木糖醇和山梨糖醇对应的物质峰,因此,可以确定母液中不含木糖醇和山梨糖醇成分,结合氨基柱分析结果,可以初步确定母液中应含有阿拉伯醇和甘露糖醇组分。图3中峰2与赤藓糖醇保留时间一致,可以确定为赤藓糖醇。图3中峰1保留时间与核糖醇接近,通过外加核糖醇分析,谱图中(图4)没有出现新的色谱峰,而峰1响应值明显升高,可以推定峰1为核糖醇成分。糖分析柱色谱阿拉伯糖醇和甘露糖醇保留时间非常接近,并且与峰3保留时间基本一致,所以峰3可能是阿拉伯糖醇或甘露糖醇或它们的混合物。

图3 赤藓糖醇母液HPLC色谱图(Shodex SC1011色谱柱)Fig.3 The HPLC chromatograms of mother liquor(Shodex SC1011 column)
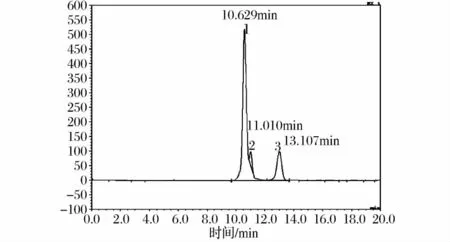
图4 母液外加核糖醇HPLC色谱图(Shodex SC1011色谱柱)Fig.4 The HPLC chromatograms of mother liquor and ribitol(Shodex SC1011 column)
2.4 母液未知组分定性
母液氨基柱色谱分析,未知峰Ⅰ可能是核糖醇、阿拉伯糖醇或木糖醇一种或几种,结合糖分析柱色谱结果,可以排除木糖醇的存在。通过比较母液两柱谱图(图1和图3),可以发现未知峰Ⅰ面积远大于图3中的核糖醇峰(峰1),所以未知峰Ⅰ不可能只含有核糖醇成分,应该是核糖醇与阿拉伯糖醇的混合物,并且以阿拉伯糖醇为主。母液氨基柱色谱分析,未知峰Ⅱ可能为山梨糖醇或甘露糖醇或两者的混合物,而糖分析柱色谱排除了山梨糖醇,所以未知峰Ⅱ应为甘露糖醇。再通过比较两谱图中的赤藓糖醇峰、未知峰Ⅱ(甘露糖醇)和峰3的面积,可以发现,氨基柱分析母液中甘露糖醇(未知峰Ⅱ)与赤藓糖醇相当,而糖分析柱分析结果显示峰3的面积明显比赤藓糖醇大,因此,可以推断峰3应是阿拉伯糖醇和甘露糖醇的混合物。
根据以上分析结果,基本可以推断赤藓糖醇母液中的未知糖醇成分主要是阿拉伯糖醇甘露糖醇以及少量的核糖醇。为了进一步验证HPLC分析结果,本文又采用LC-MS对母液中各组分的分子量进行了测定。
2.5 液质联(LC-MS)分析
LC-MS分析液相采用氨基柱。图5为母液质谱总离子流量图。图中给出3种物质[M+Na]+信号的质荷比(m/z)分别为 145.035 3、175.058 2 和205.079 4,据此可以推断出3种物质的分子质量分别为122、152和182,与赤藓糖醇、阿拉伯糖醇(核糖醇)和甘露糖醇分子质量一致,进一步证实了HPLC分析结果。另外,图中质荷比(m/z)为175.0582的主峰(对应分子量为152)左侧有小峰,推测主峰应为阿拉伯糖醇,小峰应为核糖醇。
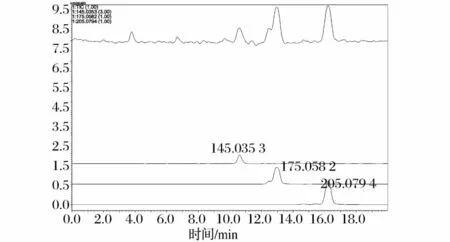
图5 母液的LC-MS谱图Fig.5 The LC-MS chromatograms of mother liquor
3 讨论
本文通过HPLC以及LC-MS分析对赤藓糖醇生产母液中的两种未知成分进行定性鉴定,结果显示,赤藓糖醇母液含有的未知糖醇成分主要是阿拉伯糖醇和甘露糖醇,另外,还含有少量的核糖醇。
目前糖和糖醇定性和定量分析主要采用HPLC分析,色谱柱主要选用糖分析柱(阳离子交换柱)[20]和氨基柱[21-22],检测器一般为示差折光检测器。本文采用HPLC分析对赤藓糖醇生产母液中的未知糖醇成分进行定性鉴定。首先选用氨基柱对赤藓糖醇母液进行分析,分离出3种主要组分,赤藓糖醇、五碳糖醇(阿拉伯糖醇、核糖醇、木糖醇)和六碳糖醇(甘露糖醇、山梨糖醇)。因为,同分异构体的五碳糖醇以及六碳糖醇糖在氨基柱的保留时间基本相同,所以单纯使用氨基柱未能对母液中的两种未知成分定性。本文随后又用糖分析柱(阳离子交换柱)对母液进行了分析,也分离出3种成分,通过与糖醇标准物比较,鉴定出母液中含有核糖醇成分,并排除了木糖醇和山梨糖醇的存在,结合氨基柱分析结果,推断出母液中的六碳糖醇应为甘露糖醇。最后通过比较两次分析中核糖醇峰面积与五碳糖醇峰面积,推断出母液中还应含有阿拉伯糖醇,并且阿拉伯糖醇含量要远大于核糖醇,质谱分析也佐证了这一结果。通过以上分析可以发现,因为标准糖醇保留时间有重叠,单独采用氨基柱或糖柱HPLC分析都未能对赤藓糖醇母液未知组分进行定性,通过两色谱柱的分析结果相互印证,以及质谱分子量的测定,才最终完成了对赤藓糖醇母液未知糖醇的定性鉴定。
本文研究用母液来自赤藓糖醇的生产企业。赤藓糖醇下游提取工艺均为物理过程,过程中不可能产生新的糖醇物质,所以母液中鉴定出的阿拉伯糖醇、甘露糖醇和核糖醇应是赤藓糖醇发酵过程中产生的副产物。赤藓糖醇生产发酵液HPLC分析(氨基柱)显示,发酵液中有少量副产物存在(生产监测数据,未列出),因为副产物含量较低,加之发酵液成分复杂,直接进行副产物分析鉴定难度较大。而母液是发酵液经净化除杂、浓缩结晶分离赤藓糖醇后剩余的料液,在此过程中这些多元醇副产物经多次浓缩,浓度大幅度提高,同时料液也被彻底净化,所以采用母液对这些副产物鉴定反而比较容易,特别是核糖醇这样含量比较少的副产物。
高渗酵母产多元醇的研究最常见的副产物的主要是甘油,赤藓糖醇发酵产甘油也有报道[10,14-15],Lin等研究丛梗孢酵母(Moniliella)赤藓糖醇发酵时发现,副产物中除甘油外还含有核糖醇,副产物产率约占总糖醇产率的1/4[15]。耐高渗酵母以葡萄糖为底物,可以转化生成阿拉伯糖醇,也常伴有大量甘油副产物[23]。微生物产甘露糖醇主要有乳酸菌和酵母菌[17],最近有报道耶氏解脂酵母酵母利用甘油为底物,发现有甘露糖醇副产物[7,24],但未见有以葡萄糖为底物赤藓糖醇发酵产阿拉伯糖醇和甘露糖醇副产物的文献报道。
本文通过HPLC和LC-MS分析,首次鉴定出赤藓糖醇生产母液中含有阿拉伯糖醇、甘露糖醇和少量核糖醇,不含其他杂质。这几种多元糖醇都是食品用多元糖醇常见品种,这为母液资源化开发利用提供了科学依据。本研究明确了生产中赤藓糖醇发酵多元醇副产物的种类和含量,也为今后赤藓糖醇生产菌株的改良和发酵效率的提高奠定了理论基础。
[1] Munro C,Bernt W O,Borzelleca J F,et al.Erythritol:an interpretive summary of biochemical,metabolic,toxicological and clinical data [J].Food and Chemical Toxicol,1998,36(12):1 139-1 174.
[2] 刘建军,赵祥颖,田延军,等.低热值甜味剂——赤藓糖醇[J].食品与发酵工业,2007,33(9):133-135.
[3] Shindou T,Sasaki Y,Eguchi T,et al.Identification of erythritol by HPLC and GC-MS and quantitative measurement in pulps of various fruits[J].Agric Food Chem,1989,37(6):1 474-1 476.
[4] Shindou T,Sasaki Y,Miki H,et al.Determination of erythritol in fermented foods by high performance liquid chromatography[J].Shokuhin Eiseigaku Zasshi,1988,29(6):419-422.
[5] Hee-Jung Moon,Marimuthu Jeya,In-Won Kim,et al.Biotechnological production of erythritol and its applications[J].Appl Microbiol Biotechnol,2010,86(4):1 017-1 025.
[6] Den Hartog G,Boots A,Adam-Perrot A,et al.Erythritol is a sweet antioxidant[J].Nutrition,2010,26(4):449-458.
[7] Tomaszewska L,Rywinska A,Gladko wski W.Production of erythritol and mannitol by Yarrowia lipolytica yeast in media containing glycerol[J].J Ind Microbiol Biotechnol,2012,39(9):1 333-1 343.
[8] DENG Huihui,HAN Ye,LIU Yuanyuan.Identifi cation of a newly isolated erythritol-producing yeast and cloning of its erythritol reductase genes[J].J Ind Microbiol Biotechnol,2012,39(11):1 663-1 672.
[9] 高慧,窦文芳,陆茂林,等.碳源对圆酵母(Torula sp.)B84512发酵合成赤藓糖醇及副产物甘油的影响[J].食品与发酵工业,2013,39(3):17-21.
[10] YANG Li-Bo,ZHAN Xiao-Bei.A novel osmotic pressure control fed-batch fermentation strategy for improvement of erythritol production by Yarrowia lipolytica from glycerol[J].Bioresource Technology,2014,151(1):120-127.
[11] 张立鹤,赵祥颖,张家祥,等.从赤藓糖醇生产废弃母液中回收赤藓糖醇[J].食品与发酵工业,2013,39(4):24-28.
[12] 刘建军,赵祥颖,田延军,等.利用膜分离技术从发酵液中分离提纯赤藓糖醇的方法[P].中国.专利号:CN 101182282A,2008.
[13] 张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:4-8.
[14] 蔡威,张建志,江正强,等.梅利斯丛梗孢酵母发酵生产赤藓糖醇的条件优化[J].食品科学.2013,34(21):259-263.
[15] Shie-Jea Lin,Chiou-Yen Wen,Jian-Ching Liau,et al.Screening and production of erythritol by newly isolated osmophilic yeast-like fungi[J].Process Biochemistry,2001,36(12):1 249-12 58.
[16] Onishi H.Studies on osmophilic yeasts.PartⅧ.Polyalcohol production by various genera and species of yeasts[J].Bull Agric Chem Soc Jpn,1960,24(2):131-140.
[17] Saha B C,Racine F M.Biotechnological production of mannitol and its applications[J].Appl Microbiol Biotechnol,2011,89(4):879-891.
[18] Ladero V,Ramos A,Wiersma A,et al.High-level production of the low-calorie sugar sorbitol by Lactobacillus plantarum through metabolic engineering[J].Appl Environ Microbiol,2007,73(6):1 864-1 872.
[19] Prakasham R S,Rao R S,Hobbs P J.Current trends in biotechnological production of xylitol and future prospects[J].Current Trends in Biotechnology and Pharmacy,2009,3(1):8-36.
[20] GB/T 22222-2008.食品中木糖醇、山梨糖醇、麦芽糖醇的测定高效液相色谱法[S].
[21] 施燕支,郭雪清,余启荣,等.HPLC示差折光分析法测定口香糖中的木糖醇等多种糖醇的含量[J].首都师范大学学报:自然科学版,2005(1):61-63.
[22] 李黎,刘玉峰,唐华澄,等.高效液相色谱法测定食品中的糖醇[J].食品科学,2007,28(6):278-280.
[23] 李泽,赵祥颖,刘建军.产D-阿拉伯醇酵母菌株的筛选及鉴定[J].食品工业,2012,33(10):27-30.
[24] Miron czuk A M,Furgala J,Rakicka M,et al.Enhanced production of erythritol by Yarrowia lipolytica on glycerol in repeated batch cultures[J].J Ind Microbiol Biotechnol.2014,41(1):57-64.
