基于枝角金纳米颗粒的LSPR传感器制备与免疫检测
2020-04-27苏荣欣唐艺文尹慧廷黄仁亮何志敏
苏荣欣,唐艺文,尹慧廷,黄仁亮,齐 崴,何志敏
基于枝角金纳米颗粒的LSPR传感器制备与免疫检测
苏荣欣1, 2, 3,唐艺文1, 2,尹慧廷1, 2,黄仁亮1, 2,齐 崴1, 2, 3,何志敏1, 2
(1. 天津大学化工学院,天津 300072;2. 化学工程联合国家重点实验室(天津大学),天津 300072;3. 天津化学化工协同创新中心,天津 300072)
枝角状纳米金结构具备尖锐的边缘和耦合区域的“热点”,可极大增强粒子的周围电场,使纳米粒子具备很强的局域表面等离子共振(LSPR)性能.本文在光纤表面原位制备具有枝角结构的金纳米材料,构建光纤LSPR传感器,并将其应用于免疫检测中.首先在预处理的光纤表面修饰一层聚多巴胺黏附层,再连接金纳米晶种,进一步利用原位还原与银诱导法,合成具有枝角状结构的金纳米颗粒.实验过程中,优化了多巴胺聚合温度、时间和金膜生长时间,最佳反应条件为:多巴胺聚合温度10℃,聚合时间15min,金纳米晶种镀膜时间5min.最优条件下制备的枝角状金膜光纤LSPR传感器在1.333~1.381的折射率区间,灵敏度高达4091nm/RIU.进一步考察了传感器的稳定性,发现经过溶剂冲洗、透明胶带撕拉与食人鱼溶液浸泡等处理后,传感器仍能保持光谱信号的稳定.此外,镀膜液采用质量分数为0.01%的氯金酸,仅为传统方法用量的1/10,因此在制备成本方面更具经济性.将人免疫球蛋白G固定在LSPR传感器上,可实现兔抗人免疫球蛋白G在0~75μg/mL浓度区间的定量检测,其灵敏度为0.086(nm/μg)·mL.
表面等离子共振;枝角结构;多巴胺;IgG
局域表面等离子共振(LSPR)是基于贵金属纳米颗粒中自由电子的集体振荡而产生的一种物理光学现象.利用这种光学现象制作的传感器,可实现目 标物的高灵敏定量检测[1-3],同时具有无需标记、操作简便、实时分析等优点,因此在生命科学[4]、食品安全[5]、环境监测[6]和药物筛查[7]等领域得以广泛应用.
金纳米颗粒具有较高的化学稳定性,在可见光-近红外波长范围内具有高反射率,因此成为LSPR传感器中应用最多的材料.金属纳米颗粒的大小、形状、位置以及介电环境,均可影响LSPR传感器的共振光谱分布.通过优化,LSPR光谱可分布在近紫外到可见光,乃至中红外波长范围[8-10].金属纳米颗粒的LSPR效应主要受其组成、尺寸及形貌的影响,其中形貌的影响至关重要[11].因此,制备不同形貌的纳米颗粒以提高LSPR效应是当前的研究热点.目前,许多学者已构建纳米三角[12]、纳米双锥[13]、纳米笼[14]、纳米梭[15]等具有独特形貌的纳米颗粒.通常,具有更尖锐的边缘和枝角有利于增强纳米颗粒LSPR电场强度[16].寻求具有枝角结构的金纳米颗粒成为LSPR传感器与其他纳米传感领域的重要研究方向.
目前制备枝角结构的金纳米颗粒主要有两种方法:一步合成法和种子生长法.其中,一步合成法是通过调节反应物的浓度以及合成时间实现对纳米颗粒的形貌控制.而种子生长法首先要合成直径在几纳米左右的金纳米晶种,再通过还原剂、形貌诱导剂以及稳定剂的共同作用,最终促成枝角状形貌的生成.十六烷基三甲基溴化铵(CTAB)常用来作为稳定剂及保护剂引导枝角状结构的生成[17].此外,通过调节AgNO3的浓度,也可以诱导生成枝角状的金纳米结构.Yuan等[18]通过调节AgNO3的浓度,制备无需表面活性剂CTAB的枝状纳米结构,制备方式简单快捷.相比于一步生成法,种子生长法在光纤表面的可控性更强.
采用光纤作为光学传感介质,同时结合终端反射式传感器结构,所制作的光纤LSPR传感器具有体积小、便携、远程传输潜力大、无需复杂光学元件组合和流通池配合的优点.本文采用种子生长法在光纤表面制备具有枝角结构的金纳米颗粒,构建高灵敏度的LSPR传感器,并应用于免疫检测中.
1 实 验
1.1 实验材料与仪器
实验试剂:HAuCl4·3H2O,美国Sigma公司;硝酸银、牛血清蛋白(BSA)、多巴胺盐酸盐、NH2OH·HCl,上海阿拉丁生化科技股份有限公司;兔抗人IgG(RAHIgG)、人IgG(HIgG),北京博奥森生物技术有限公司;三(羟甲基)氨基甲烷(Tris)缓冲溶液(pH=8.5,10mmol/L)和磷酸盐缓冲溶液(PBS,pH=7.4,10mol/L)均由超纯水配制.其他试剂均为分析纯.多模光纤,数值孔径为0.22,芯径为400μm,购于美国海洋光学公司.
实验仪器:HL-2000型光源、HR2000+型光谱仪、SPLIT-400-VIS-NIR型Y型光纤,美国海洋光学公司;BT125D型电子天平,赛多利斯公司;PHI-5000 VersaProbe型X射线光电子谱仪,日本UIVAC-PHI公司;S-4800型场发射扫描电子显微镜/能谱仪,日本日立公司.
1.2 实验方法
1.2.1 光纤预处理
将打磨平整的光纤一端1.5cm区域插入90℃浓硫酸,水浴1h,去除表面黄色聚合物层.取出光纤用去离子水冲洗,氮气吹干,再将光纤端面1cm的部分浸入40%的氢氟酸刻蚀30min.处理后的光纤冲洗吹干备用.
1.2.2 金种制备
金种采用Grabar等[19]建立的方法制备:将50mL的1mmol/L氯金酸放入圆底烧瓶,加热至沸腾,并用磁子高速搅拌,迅速加入5mL 38.8mmol/L的柠檬酸钠溶液,此时溶液逐渐由淡黄色变为深紫色.混合溶液持续加热搅拌,10min后移走热源,继续搅拌15min即得金种溶液,随后过膜备用.
1.2.3 LSPR传感器制备
将处理后的光纤插入食人鱼溶液(浓硫酸与30%H2O2体积比7∶3),85℃水浴加热1h,使光纤表面连接羟基,随后用去离子水冲洗并用氮气吹干.将经食人鱼溶液处理后的光纤置于110℃的烘箱固化1h,水洗吹干.将光纤置于1mg/mL的多巴胺(DA)Tris溶液(pH=8.5,10mmol/L)中发生聚合,随后取出光纤,并水洗吹干,再将光纤浸入第1.2.2节中制作的金种溶液中3h,在多巴胺表面连接金种.此后将呈淡紫色的光纤取出并放入镀膜液(0.01%的HAuCl4·3H2O、1mmol/L的NH2OH·HCl及2.5×10-6mol/L的硝酸银的混合溶液),在金种的基础上生长具有枝角结构的金纳米颗粒.
1.2.4 端面封银
为增强传感器的信号,应用银镜反应在传感端面1~2mm的区域镀上银膜.先将2%的氨水滴入2mL 0.1mol/L的硝酸银溶液直至沉淀溶解,再加入1.4mL 0.8mol/L的KOH溶液,溶液变为黑色.继续加入氨水直至沉淀溶解,再加入0.4mL 0.1mol/L的葡萄糖溶液,同时将0.2%氯化亚锡敏化2min的传感器插入溶液,5min后取出光纤,此时端面已形成银膜,再经水洗吹干后备用.
1.2.5 免疫检测应用
本文采用光纤LSPR传感器对IgG抗原抗体进行定量检测.首先将制备完成的光纤浸入2mg/mL的多巴胺Tris溶液,搅拌30min,在传感器表面修饰PDA功能层.再将功能化的光纤浸入200μg/mL的HIgG溶液,同时利用光纤测量系统记录光谱变化.待抗原结合达到平衡后,用PBS冲洗光纤表面,再将光纤置入2%的BSA溶液以封闭未结合位点.进一步,将连接HIgG的光纤LSPR传感器浸入不同浓度的RAHIgG溶液中,37℃孵育30min,记录孵育前后的LSPR光谱.结合完毕的生物传感器浸入10mmol/L的NaOH 15min,解除抗原抗体之间的结合,以便下一次应用.
1.2.6 自主搭建的光纤SPR测量系统
图1为实验室自主搭建的光纤LSPR测量系统示意.将上文制备完成的光纤传感器一端浸入待测溶液,另一端连接Y型光纤.从光源处发出的可见光通过Y型光纤进入光纤传感器,并激发表面等离子共振效应,之后通过Y型光纤的另一端将信号传至光谱仪.将光谱仪与计算机连接后,可实现传感信号的监测.

图1 光纤LSPR测量系统示意
1.2.7 材料表征
SEM/EDS表征:截取小段光纤传感区域并粘于SEM样品台,放入镀膜机镀铂层.制样完毕后用扫描电子显微镜观察粒子形貌,同时用EDS测试样品表面元素峰谱.
XPS表征:将光纤镀金膜部分截取小段并用导电胶将其粘于硅片表面,使用X射线光电子谱仪对光纤传感器表面进行Au、Ag元素以及全谱扫描.运用XPSPEAK41软件对测得的数据进行处理,分析得Au、Ag两种元素价态情况.
2 结果与讨论
2.1 传感器的制备原理
图2显示了传感器制备和免疫检测的过程.首先在预处理完毕的光纤表面修饰PDA层,再将光纤置于金种溶液中.金种通过黏附作用固定在PDA层.之后将连有金种的光纤置于HAuCl4·3H2O、NH2OH·HCl和低浓度硝酸银的混合溶液中,通过如下反应促进金种的生长,直至形成具有枝角结构的金纳米颗粒:

Ag+(aq)+Cl-(aq)→AgCl(s)(2)
氯金酸在盐酸羟胺的还原下生成Au0,因此金种逐渐生长成较大的金纳米颗粒.另一方面,AuCl4-/Au的标准还原电势(0.80V,相较于标准氢电极)小于Ag+/Ag的标准还原电势(0.99V,相较于标准氢电极),溶液中的银离子与氯离子结合生成氯化银沉淀,并取代附着在金种表面的柠檬酸盐[20],最终导致金纳米颗粒的各向异性生长.生长完毕的传感器通过端面封银提高其端面的平整性以实现光学信号的反射.

图2 光纤LSPR传感器构建及免疫检测应用原理
2.2 LSPR传感器制备条件的优化
光纤LSPR传感器的制备主要分为多巴胺功能化和金膜生长两个重要的步骤,这也是决定传感器传感性能的主要因素.多巴胺基于自聚作用在光纤表面形成连续的聚多巴胺层,尽管其聚合机理至今仍不甚清楚,但聚合温度和聚合时间被认为是影响聚合速率和聚合程度的重要因素[21-22].为了考察多巴胺聚合温度对LSPR传感器性能的影响,将聚合时间固定为15min,金膜生长时间固定为5min.反射率和半峰宽是衡量光纤SPR传感性能的两个重要指标.一般而言,反射曲线的反射率越低,半峰宽越窄,传感器的SPR光谱质量越高.如图3所示,从0℃升至10℃时,传感器光谱的半峰宽和反射率发生显著降低.但当温度升至20℃时,半峰宽及反射率增加.因此,10℃为传感器的最适聚合温度.
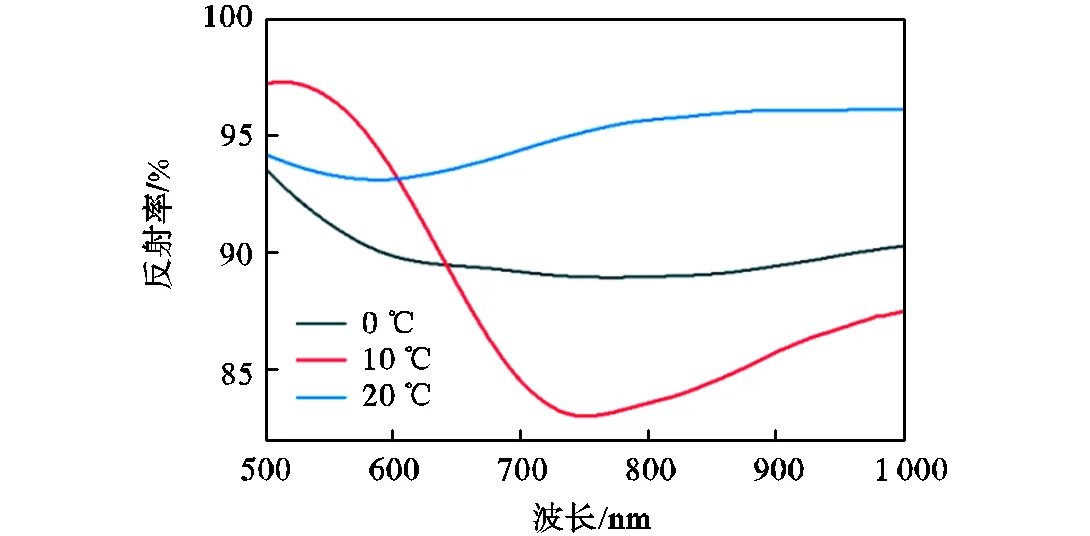
图3 不同DA聚合温度制备的传感器在水中的SPR光谱
为了考察DA聚合时间对传感性能的影响,聚合温度固定为10℃、金膜生长时间固定为5min.图4(a)显示了不同聚合时间制备传感器的LSPR谱图.当聚合时间由10min增至15min后,LSPR谱图的反射率降低,半峰宽变窄.要得到连续平整的PDA膜,一般需要超过10min的自聚时间[21].此外,过短的自聚时间也会使得形成PDA中氨基与亚氨基含量较少[21],不利于金种的连接.但当聚合时间进一步增加到20min或25min后,反射率上升,半峰宽也逐渐变大.图4(b)对比了聚合时间为15min和20min时传感器共振波长随时间的变化,研究发现聚合15min时,传感器灵敏度更高.因此,聚合温度选择为15min.
为了考察金膜生长时间的影响,DA的聚合温度和时间分别固定为10℃和15min.图5(a)显示了不同镀膜时间制得传感器的LSPR谱图.由图可见,镀膜时间为5min时传感器的半峰宽最小、反射率最低.过短和过长的镀膜时间都会引起传感性能的降低.图5(b)探究了镀膜时间分别为4min、5min和6min时传感器的灵敏度大小,通过比较拟合直线的斜率,发现5min的金膜生长时间制备的传感器不仅光谱信号较好,灵敏度也最高.因而选择5min为传感器的最佳金膜生长时间.
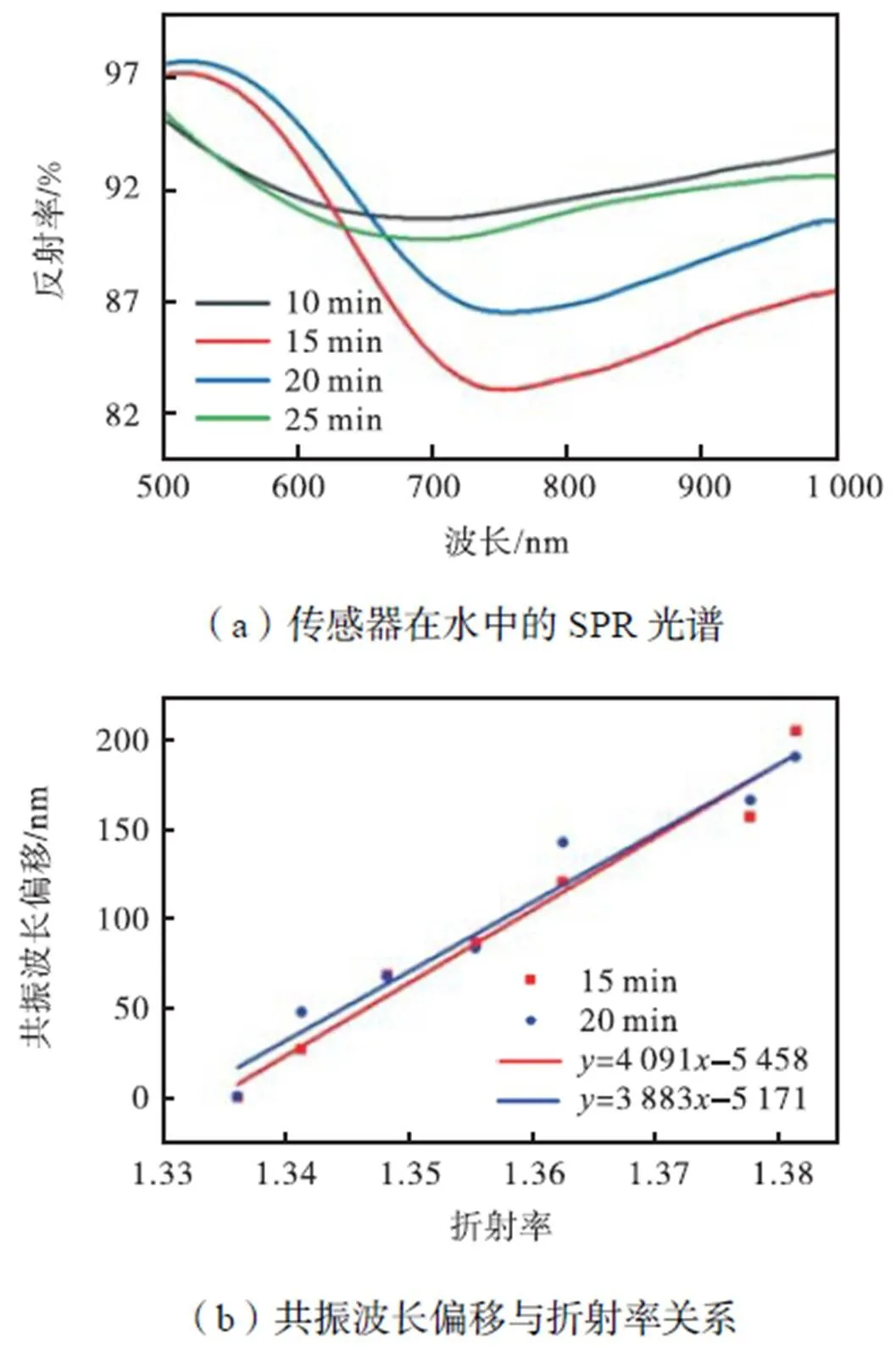
图4 不同DA聚合时间对传感器光学性能的影响

图5 不同金膜生长时间对传感器光学性能的影响
2.3 LSPR传感器表征及性能评价
利用场发射扫描电子显微镜对LSPR传感器表面及截面进行了表征,如图6(a)和(b)所示.光纤表面密集生长着一层连续且凹凸不平的枝角型颗粒,而传感器截面图充分显示了枝角型结构的金纳米颗粒形貌.与溶液中制备的具有星型枝角的结构不同[18],由于光纤表面PDA层的影响,限制了纳米颗粒的生长,从而形成了与溶液中不同的形貌.凹凸起伏的枝状金膜结构,能增大金膜表面与待测物的接触面积,且突出的枝角结构增强了纳米粒子之间的耦合作用,因而此独特形貌能够增强传感器的SPR效应[23].图6(c)为与SEM表征同时进行的能谱分析,图中Au、Ag两种元素清晰的峰佐证了金膜表面Ag元素的存在.

图6 传感器表面纳米金的SEM及EDS表征
由于在传感器的制备过程中同时引入了Au、Ag两种元素,因此利用XPS对光纤表面的金属成分进行了价态分析.图7为Au4f和Ag3d区域的高倍扫描谱图.图7(a)显示了在83.9eV和87.6eV处的两个特征峰,分别代表了Au4f7/2和 Au4f5/2的结合能,两者的轨道间距为3.7eV,证明了Au0在传感表面的存在.图7(b)为Ag元素的谱图,在367.6eV和373.6eV处分别出现了两个峰,对应了Ag3d5/2和Ag3d3/2的结合能.其轨道间距为6.0eV,证实了Ag元素在传感器表面的存在.此外,由于Ag3d区域的峰相对零价的Ag元素峰有所偏移[24],验证了氧化态Ag元素的存在,即金纳米颗粒中存在AgCl.

图7 传感器表面纳米金的XPS表征
图8(a)为光纤LSPR传感器在不同浓度的蔗糖中的光谱.由图可见,随着被测溶液折射率的增大,传感器的共振波长红移.传感器的灵敏度[25]计算式为

由图8(b)可知,当折射率由1.333增至1.381时,LSPR传感器共振波长红移了204.8nm.经过拟合,传感器在折射率1.333~1.381范围内平均灵敏度可达4091nm/RIU.目前构建LSPR传感器的方法主要分为物理溅射法、光刻法和化学法,其中化学法制备的LSPR传感器工艺简捷且灵敏度较高,因此本文重点对比了采用湿化学法制备的LSPR传感器灵敏度.由表1可见,由金纳米球[26]、金纳米棒[26]、金纳米三角[27]、金纳米笼[28]和金纳米立方[29]构建的LSPR传感器灵敏度均小于2000nm/RIU.此外,对比本课题组前期运用多巴胺辅助湿化学法制备的球状颗粒金膜传感器[30],本文所制备的传感器平均灵敏度更高.由此可见枝角金颗粒能有效提升LSPR传感器灵敏度.
本文制备的传感器具备较高灵敏度,可能的原因如下:首先,传感器的灵敏度与共振波长范围有关,较高的起始共振波长意味着同样折射率范围下传感器有更高的灵敏度[31];其次,传感器表面凹凸不平的结构意味其具有较大的表面积,从而得到更强的电场分布和更多与待测样品接触的面积[32-33];最后,传感器表面分布着连续的金膜和间隔的枝角结构,这表明传感表面存在SPR和LSPR效应的耦合,两种效应的耦合可以带来更强的电场分布,从而提高传感器的灵敏度[34].
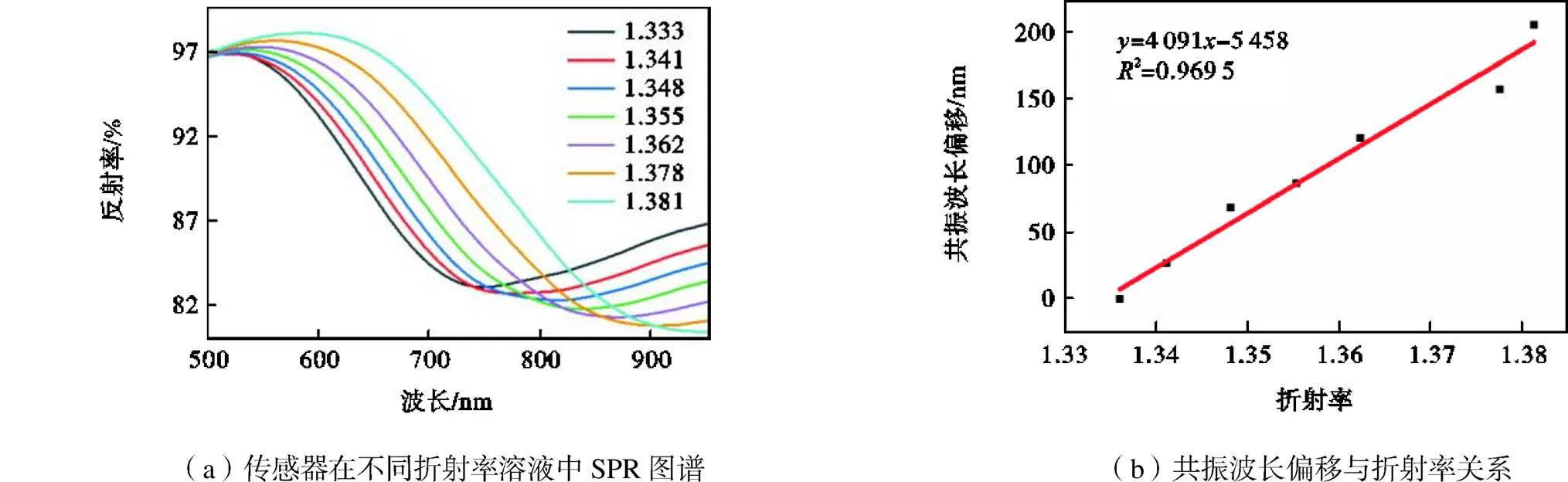
图8 传感器在不同折射率溶液的光谱图及标准曲线
表1 本文制备的传感器与其他LSPR传感器的灵敏度对比
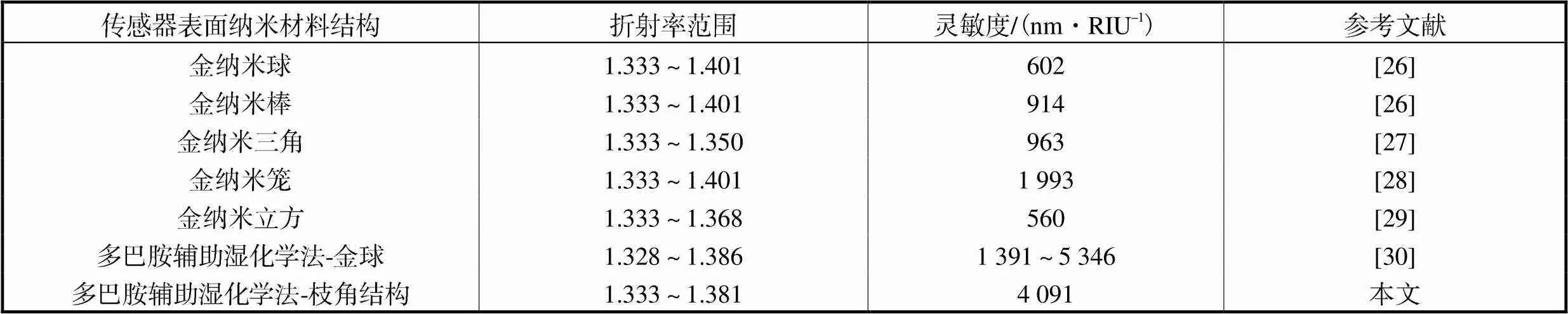
Tab.1 Sensitivity comparisons of the fabricated branched structure LSPR sensor with other LSPR sensors
为评价制得的传感器金膜在光纤表面的黏附力和稳定性,本文用以下3种方式处理光纤,对比处理前后光纤信号的变化:将光纤用大量水和乙醇冲洗、用透明胶带撕拉以及将光纤浸入食人鱼溶液中.通过观察处理前后光纤在水中的光谱,发现经过冲洗的光纤信号完全不受影响,经过透明胶撕拉和食人鱼处理的光纤光谱只有略微的波动,这表明本方法制备的光纤传感器具备很好的稳定性,见图9.
综上所述,本文所构建的传感器具备以下优势:首先,利用多巴胺辅助的湿化学法可降低制备难度,且制成的传感器灵敏度比物理溅射法(1557nm/RIU)[35]、光刻法(595nm/RIU)[36]和普通湿化学法(2054nm/RIU)[37]均有较显著的提升;其次,将枝角金纳米材料固定在光纤表面,可避免溶液型LSPR传感器易聚沉的不足,提升了传感器稳定性;最后,本文在利用湿化学法还原氯金酸时,将氯金酸浓度降至传统方法[30]的1/10,节约了制备成本.本文仍存在不足的地方是所制备的金膜厚度均匀度不高,对半峰宽和反射率有一定影响,后续将更精细地调控枝角金颗粒的粒径,以进一步提升其LSPR性能[38].

图9 LSPR传感器经不同处理后的光谱图
2.4 传感器的生物检测应用
图10显示了LSPR传感器连接HIgG、BSA封闭与RAHIgG抗体结合这3个过程共振波长的总偏移量.通过多巴胺与HIgG抗原的作用,一定量的抗原结合在了光纤表面,导致光纤表面折射率的变化,使共振波长偏移13.60nm.BSA封闭后,共振波长继续偏移0.65nm,表明光纤表面剩余未结合的多巴胺位点较少.在抗体结合阶段,质量浓度为75μg/mL的RAHIgG与传感器表面的HIgG结合引起共振波长偏移6.01nm,证明传感器可很好地分析HIgG和RAHIgG之间的特异性结合.

图10 不同修饰操作后LSPR传感器共振波长的偏移量
图11为不同质量浓度的抗体与光纤表面抗原结合引起共振波长偏移的标准曲线.由图可见,在0~75μg/mL的抗体浓度范围内,共振波长偏移随抗体质量浓度变化的标准曲线呈现很好的线性关系 (2=0.9761).曲线斜率即生物传感器灵敏度为0.086(nm/μg)·mL.实验表明,本文制备的LSPR传感器对IgG抗体具有很好的检测效果.

图11 LSPR传感器对RAHIgG检测的标准曲线
本文所制备的传感器具有很好的生物检测效果,主要归因于其较高的LSPR灵敏度以及传感表面HIgG抗原偶联效率较高.其中,较高的LSPR灵敏度使相同生物分子的结合引起更大的共振波长偏移.而传感器表面抗原分子的高偶联效率可增加对抗体的偶联量,进一步提升共振波长的偏移值.
3 结 语
本文利用聚多巴胺辅助法,在光纤表面制备了具有枝角结构的金纳米颗粒.枝角状纳米金结构具备尖锐的边缘和耦合区域的“热点”,可极大增强纳米粒子的局域表面等离子共振(LSPR)性能.实验过程中,优化了PDA镀膜时间、温度以及金膜生长时间,提升了传感器性能.最佳PDA聚合温度、聚合时间以及金膜生长时间分别为10℃、15min和5min.在折射率1.333~1.381范围内,LSPR传感器灵敏度为4091nm/RIU.进一步,在LSPR传感器表面修饰了HIgG,实现了对不同浓度的RAHIgG的高灵敏特异性检测,检测灵敏度为0.086(nm/μg)·mL.
[1] 栗大超,伍 鹏,杨 佳,等. 基于硼酸盐聚合物绑定的SPR葡萄糖测量方法[J]. 天津大学学报:自然科学与工程技术版,2013,46(8):680-685.
Li Dachao,Wu Peng,Yang Jia,et al. A surface plasmon resonance glucose measurement method based on borate polymer binding[J]. Journal of Tianjin University:Science and Technology,2013,46(8):680-685(in Chinese).
[2] 黄福祥,栗大超,伍 鹏,等. 表面等离子共振检测葡萄糖浓度的数据处理方法[J]. 天津大学学报,2011,44(1):69-72.
Huang Fuxiang,Li Dachao,Wu Peng,et al. Data analysis method for glucose detection based on surface plasmon resonance[J]. Journal of Tianjin University,2011,44(1):69-72(in Chinese).
[3] Zhao Y,Deng Z Q,Wang Q. Fiber optic SPR sensor for liquid concentration measurement[J]. Sensors and Actuators B:Chemical,2014,192:229-233.
[4] Liu X H,Wang Z C,Zhang X B,et al. Screening of lomefloxacin aptamers based on polydopamine nano-spheres[J]. Chinese Journal of Analytical Chemistry,2017,45(12):1971-1979.
[5] 石 婷,刘 瑾,张婉洁,等. 基于SPR生物传感器的抗生素残留检测及影响因素分析[J]. 天津大学学报,2010,43(3):255-261.
Shi Ting,Liu Jin,Zhang Wanjie,et al. Analysis of influencing factors on detection of antibiotics residues based on surface plasmon resonance biosensor [J]. Journal of Tianjin University,2010,43(3):255-261(in Chinese).
[6] Lin S Y,Liu S W,Lin C M,et al. Recognition of potassium ion in water by 15-crown-5 functionalized gold nano-particles[J],Analytical Chemistry,2002,74(2):330-335.
[7] Wang C,Zhao Y,Xu L,et al. Specific electron-transfer and surface plasmon resonance integrated boosting visible-light photoelectrochemical sensor for 4-chlorophenol[J]. Journal of Electroanalytical Chemistry,2019,833:251-257.
[8] Fiorani D. Surface Effects in Magnetic Nanoparti-cles[M]. New York:Springer,2005.
[9] Link S,El-Sayed M A. Optical properties and ultrafast dynamics of metallic nanocrystals[J]. Annual Review of Physical Chemistry,2003,54(54):331-366.
[10] Hyunjoon S,Franklin K,Stephen C,et al. Pt nanocrystals:Shape control and Langmuir-Blodgett monolayer formation[J]. Journal of Physical Chemistry B,2005,109(1):188-193.
[11] Miller M M,Lazarides A A. Sensitivity of metal nanoparticle surface plasmon resonance to the dielectric environment[J]. Journal of Physical Chemistry B,2005,109(46):21556-21565.
[12] Sun Y G,Xia Y N. Triangular nanoplates of silver:Synthesis,characterization,and use as sacrificial templates for generating triangular nanorings of gold[J]. Advanced Materials,2003,15(9):695-699.
[13] Fang C,Zhao G,Xiao Y,et al. Facile growth of high-yield gold nanobipyramids induced by chloroplatinic acid for high refractive index sensing properties[J]. Scientific Reports,2016,6:36706.
[14] Skrabalak S E,Chen J,Au L,et al. Gold nanocages for biomedical applications[J]. Advanced Materials,2010,19(20):3177-3184.
[15] Bai T,Sun J,Che R,et al. Controllable preparation of core-shell Au-Ag nanoshuttles with improved refractive index sensitivity and SERS activity[J]. ACS Applied Materials & Interfaces,2014,6(5):3331.
[16] Nehl C L,Liao H,Hafner J H. Optical properties of star-shaped gold nanoparticles[J]. Nano Letters,2006,6(4):683-688.
[17] Wu H L,Chen C H,Huang M H. Seed-mediated synthesis of branched gold nanocrystals derived from the side growth of pentagonal bipyramids and the formation of gold nanostars[J]. Chemistry of Materials,2009,21(1):110-114.
[18] Yuan H,Ma W H,Chen C C,et al. Shape and SPR evolution of thorny gold nanoparticles promoted by silver ions[J]. Chemistry of Materials,2007,19(7):1592-1600.
[19] Grabar K C,Freeman R G,Hommer M B,et al. Preparation and characterization of Au colloid monolayers[J]. Analytical Chemistry,1995,67(4):735-743.
[20] Bell S E J,Sirimuthu N M S. Surface-enhanced Raman spectroscopy as a probe of competitive binding by anions to citrate-reduced silver colloids[J]. Journal of Physical Chemistry A,2005,109(33):7405-7410.
[21] Zangmeister R A,Morris T A,Tarlov M J. Characterization of polydopamine thin films deposited at short times by autoxidation of dopamine[J]. Langmuir,2013,29(27):8619-8628.
[22] Jiang J,Zhu L,Zhu L,et al. Surface characteristics of a self-polymerized dopamine coating deposited on hydro-phobic polymer films[J]. Langmuir,2011,27(23):14180-14187.
[23] Saito Y,Wang J J,Smith D A,et al. A simple chemical method for the preparation of silver surfaces for efficient SERS[J]. Langmuir,2002,18(8):2959-2961.
[24] Kaushik V K. XPS core level spectra and Auger parame-ters for some silver compounds[J]. Journal of Electron Spectroscopy & Related Phenomena,1991,56(3):273-277.
[25] Srivastava S K. Fiber optic plasmonic sensors:Past,present and future[J]. Open Optics Journal,2013,7(1):58-83.
[26] Cao J,Tu M H,Sun T,et al. Wave-length-based localized surface plasmon resonance optical fiber biosensor[J]. Sensors & Actuators B Chemical,2013,181(5):611-619.
[27] Liu R M,Zhou J H,Zhou Z K,et al. On-demand shape and size purification of nanoparticle based on surface area[J]. Nanoscale,2014,6(21):13145-13153.
[28] Tu M H,Sun T,Grattan K T V. LSPR optical fibre sen-sors based on hollow gold nanostructures[J]. Sensors & Actuators B Chemical,2014,191:37-44.
[29] Li L,Wu S,Li L,et al. Gap-mode excitation,manipulation,and refractive-index sensing application by gold nanocube arrays[J]. Nanoscale,2019,11(12):5467-5473.
[30] Shi S,Wang L B,Wang A K,et al. Bioinspired fabrication of optical fiber SPR sensors for immunoassays using polydopamine-accelerated elec-troless plating[J]. Journal of Materials Chemistry C,2016,4(32):7554-7562.
[31] Karakouz T,Holder D,Goomanovsky M,et al. Morphology and refractive index sensitivity of gold island films[J]. Chemistry of Materials,2009,21(24):5875-5885.
[32] Dmitriev A,Hãgglund C,Chen S,et al. Enhanced nano-plasmonic optical sensors with reduced substrate ef-fect[J]. Nano Letter,2008,8(11):3893-3898.
[33] Hatab N A,Hsueh C H,Gaddis A L,et al. Free-standing optical gold bowtie nanoantenna with variable gap size for enhanced Raman spectroscopy[J]. Nano Letter,2010,10(12):4952-4955.
[34] Prodan E,Radloff C,Halas N J,et al. A hybridization model for the plasmon response of complex nanostruc-tures[J]. Science,2003,302(5644):419-422.
[35] Suzuki H,Sugimoto M,Matsui Y,et al. Effects of gold film thickness on spectrum profile and sensitivity of a multimode-optical-fiber SPR sensor[J]. Sensors & Actuators B Chemical,2008,132(1):26-33.
[36] Jia P P,Yang J. A plasmonic optical fiber patterned by template transfer as a high-performance flexible nanoprobe for real-time biosensing[J]. Nanoscale,2014,6(15):8836-8843.
[37] Shi S,Wang L,Su R,et al. A polydopamine-modified optical fiber SPR biosensor using electroless-plated gold films for immunoassays[J]. Biosensors & Bioelectron-ics,2015,74:454-460.
[38] Piella J,Bastus N G,Puntes V. Size-controlled synthesis of sub-10-nanometer citrate-stabilized gold nanoparticles and related optical properties[J]. Chemistry of Materials,2016,28(4):1066-1075.
Fabrication of LSPR Sensors Based on Branched Gold Nanoparticles for Immunoassays
Su Rongxin1, 2, 3,Tang Yiwen1, 2,Yin Huiting1, 2,Huang Renliang1, 2,Qi Wei1, 2, 3,He Zhimin1, 2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. State Key Laboratory of Chemical Engineering,Tianjin University,Tianjin 300072,China;3. Collaborative Innovation Center of Chemical Science and Engineering(Tianjin),Tianjin 300072,China)
Branched gold nanostructures have unique sharp tips and “hot spot”, which can strongly enhance their surrounding electric fields. As a result, branched nanoparticles have strong local surface plasmon resonance (LSPR) signals. Herein, gold nanomaterials with branched nanostructures weresynthesized on an optical fiber, and optical fiber LSPR sensors were fabricated and applied for immunoassays. An adhesive layer of polydopamine (PDA) was first prepared on the preprocessed optical fiber and then applied to bind gold seeds. Based onreduction and silver induction, gold nanomaterials with branched nanostructures were fabricated on an optical fiber. The temperatures and time of dopamine polymerization, as well as the gold plating time, were optimized. The optimized values are set as 10℃, 15min, and 5min. The LSPR sensor fabricated under optimal condition showed a high sensitivity of 4091nm/RIU with a refractive index ranging from 1.333 to 1.381. Moreover, high stability of the fabricated sensor was demonstrated by comparing the spectrum of the original sensor with the spectra of the sensor after solvent rinsing, scotch tape tearing, and immersion in piranha solution. In addition, 0.01% gold chloride was applied as a plating solution, whose concentration was only one-tenth of that of the traditional methods. As a result, the presented method is more economical. Moreover, HIgG was immobilized on the gold film to detect RAHIgG. The fabricated biosensor reached a detection sensitivity of 0.086(nm/μg)·mL during the RAHIgG concentration of 0—75μg/mL.
surface plasmon resonance;branched structure;polydopamine(PDA);IgG
Supported by the National Natural Science Foundation of China(No.21777112,No.51473115).
TP212.3
A
0493-2137(2020)05-0441-09
10.11784/tdxbz201904014
2019-04-08;
2019-04-29.
苏荣欣(1980— ),男,博士,教授.
苏荣欣,surx@tju.edu.cn.
国家自然科学基金资助项目(21777112,51473115).
(责任编辑:田 军)
