辛弗林分子印迹聚合物的制备及其在固相萃取中的应用
2020-04-25苏学素张耀海焦必宁刘金涛董家吏
李 玲,苏学素*,张耀海,焦必宁,刘金涛,董家吏
(1.西南大学化学化工学院,重庆 400715;2.中国农业科学院柑桔研究所(西南大学柑桔研究所),农业农村部柑桔产品质量安全风险评估实验室,重庆 400712)
辛弗林是一种生物碱,是麻黄属植物的主要活性成分,我国每年至少有5.5万 t的辛弗林急待开发和利用[1]。Pellati等[2]研究发现辛弗林可提高新陈代谢、氧化脂肪,是一些减肥药物的有效成分,在治疗因肥胖引起的轻度和中度抑郁症中显示了良好的疗效。胡源祥等[3]研究表明枳实中的辛弗林对肠胃运动具有调节作用,肯定了辛弗林为枳实作用于胃肠运动的有效成分之一。除此以外,辛弗林具有扩张气管和支气管、收缩血管、升高血压的作用,临床用于治疗支气管哮喘以及手术和麻醉过程中出现的低血压、虚脱、休克、体位性低血压等症状[4-6]。随着研究的深入和美国、加拿大、澳大利亚和新西兰等国家相继禁止销售含有麻黄和麻黄碱的膳食补充剂后[7],辛弗林由于结构与麻黄碱相似,在食品、药品、饮料等保健行业显示出了极大的应用潜力[8-9]。巨大的应用潜力和良好的生理活性导致辛弗林的需求量不断增加,它的开发和利用受到了极大的关注,提取和纯化更是近些年研究的热点之一。目前辛弗林的分离纯化方法主要有超临界提取法[10]、微波提取法[11]、真空气流提取法[12]、大孔树脂吸附法[13]、反胶束提取法[14]、溶剂提取法[15-16]、煎煮法[17]等,但这些技术普遍存在提取率低、纯度低、有机溶剂消耗量大、工艺繁琐等缺点,而且对辛弗林的提取和纯化不具有特异性,因此,开发经济、高效、简洁的提纯化辛弗林的方法尤为重要。
分子印迹固相萃取(solid phase extraction,SPE)技术是一种有望在生物工程、临床医学、环境监测、食品工业等行业形成产业化应用的新型SPE技术[18-19]。分子印迹聚合物(molecularly imprinted polymer,MIPs)一般具有特定的结合位点,这些位点可以选择性地识别模板分子或与模板分子结构相似的化合物,具有高选择性、化学和物理稳定性、可重复使用性和低成本制备性等优点[20-22]。由于其突出的优势,MIPs在食品分析、药物分析、药物输送、SPE等领域显示出良好的应用前景。Ghasemi等[23]利用分子印迹技术制造具有特定纳米空腔的聚砜膜,从纯净溶液和紫杉树提取物中选择性分离和富集紫杉醇;Zhang Jiawei等[24]利用合成的MIPs为特定的吸附剂,首次从柠檬汁中去除柠檬苦素,然后将含有柠檬苦素的MIPs直接制成水溶性凝胶治疗小鼠的炎症;Xie Jing等[25]制备了毛蕊花素MIPs,通过SPE程序使用毛蕊花素分子印迹材料用于扣除雌激素受体中的类黄酮糖苷配基。目前合成分子印迹的方法主要有沉淀聚合法、本体聚合法、悬浮聚合法、原位聚合法、表面印迹法、溶胀聚合法等。本体聚合法由于在制备过程中聚合物内部的印迹孔穴经过研磨可能被破坏,在一定程度上会降低MIPs的选择性和吸附性,原位聚合法聚合程度难以控制,溶胀聚合法制备工艺繁琐、耗时长,悬浮聚合法受溶剂影响大,表面印迹法过程复杂且需要载体材料[26-27]。由于沉淀聚合法制备过程简单、成本低、产率和印迹效果好,因此本实验采用沉淀聚合法制备辛弗林MIPs,测定MIPs的吸附性和选择性,并利用MIPs对枳实粗粉中的辛弗林进行SPE研究,以期为辛弗林的提取和纯化提供一种高效、经济的方法。
1 材料与方法
1.1 材料与试剂
辛弗林标准品、甲基丙烯酸(methacrylic acid,MAA)、偶氮二异丁腈(azobisisobutyronitrile,AIBN) 上海泰坦科技股份有限公司;丙烯酸羟乙酯(2-hydroxyethyl acrylate,HEA) 上海源叶生物科技有限公司;丙烯酰胺 重庆姣姣商贸有限公司;乙二醇二甲基丙烯酸羟乙酯(ethyleneglycol dimethacrylate,EGDMA) 上海腾怀生物科技有限公司;甲醇重庆跃翔化工有限公司;乙酸 上海麦瑞尔化学科技有限公司;乙腈 上海阿拉丁生化科技有限公司;乙酸乙酯(ethyl acetate,EA) 西格玛奥德里奇贸易有限公司;实验试剂均为色谱纯,水均为超纯水。
1.2 仪器与设备
高效液相色谱(high performance liquid chromatography,HPLC)仪 安捷伦科技有限公司;SZCL-3A数显智能控温磁力搅拌器 郑州科泰实验设备有限公司;SB-5200D超声波清洗器 宁波新芝生物科技有限公司;TM-1810紫外分光光度计 北京普析通用仪器有限责任公司;旋涡机 重庆瑞丽电子仪器设备有限公司;纯水机 法国MilliQ公司;CZX-GFC.101-2-BS电热恒温鼓风干燥箱 上海博泰实验设备有限公司;梅特勒AB304-S/FACT电子天平 上海志荣电子科技有限公司;IECCL31R台式冷冻离心机 德国Thermo Fisher公司;SPE柱 美国Agilent科技有限公司;Sμpelco真空SPE装置 上海楚定分析仪器有限公司;SM8010型扫描电子显微镜(scanning electron microscope,SEM)日本Hitachi公司。
1.3 方法
1.3.1 MIPs的制备和表征
1.3.1.1 沉淀聚合法制备MIPs
以MIPs2为例,使用沉淀聚合法制备MIPs2时,在加入0.22 mmol MAA和0.18 mmol HEA作为双功能单体的条件下,准确称取0.1 mmol模板分子(辛弗林)溶于10.0 mL致孔剂(乙腈)中,加入20 mmol交联剂EGDMA,超声30 min静置过夜,再加入0.2 mmol引发剂AIBN,超声处理30 min通氮气除氧20 min后置于60 ℃恒温水浴中反应24 h得聚合物。用甲醇-乙酸8∶2(V/V)混合溶液索氏提取除去聚合物中的模板分子及未反应的单体,再用甲醇溶液洗脱除去剩余的乙酸分子,将反应所得固体颗粒用丙酮反复沉降除去细小粒子,过滤,干燥得辛弗林MIPs。非印迹聚合物(non-imprinted polymer,NIPs)的合成方法与MIPs合成方法一致,只是在合成时不加入模板分子。
1.3.1.2 MIPs形态表征
利用SEM对合成的MIPs2进行形貌表征。首先将待测的样品均匀涂覆到导电胶上,然后采用离子溅射仪对MIPs进行喷金30 s后,室温下进行SEM测试。
1.3.2 吸附实验
1.3.2.1 静态吸附
准确称取10 mg MIPs和NIPs于10 mL离心管中,加入100 mg/L的辛弗林标准液,摇床恒温振荡2 h,10 000 r/min高速离心5 min,取出上清液,氮气吹干后用甲醇复溶至1 mL,过0.22 μm滤膜,用HPLC测定其浓度并计算吸附量和印迹因子(IF),公式如下:

式中:Q为MIPs对辛弗林的吸附量/(μmol/g);Qc为溶液中辛弗林的初始质量浓度/(mg/L);Qe为吸附平衡时辛弗林的质量浓度/(mg/L);V为辛弗林溶液的体积/mL;m为加入的MIPs的质量/mg;QMIP为MIPs对辛弗林的吸附量/(μmol/g);QNIP为NIPs对辛弗林的吸附量/(μmol/g)。
1.3.2.2 吸附等温线和Scatchard模型考察
准确称取10 mg MIPs2,加入不同浓度的辛弗林标准液,摇床恒温振荡2 h,10 000 r/min高速离心10 min,取出上清液,氮气吹干后用甲醇复溶至1 mL,过0.22 μm滤膜,用HPLC测定并计算其浓度。应用Scatchard模型以Q/Ce对Q作图,根据线性关系的斜率和截距可求得吸附平衡常数Kd和最大表观结合量Qmax。如式(3)所示:

式中:Ce为吸附平衡时的浓度。
1.3.2.3 吸附动力学
准确称取10 mg MIPs2,分别加入100 mg/L的辛弗林标准液,摇床恒温振荡吸附10、20、30 min后10 000 r/min高速离心10 min,取出上清液,氮气吹干后用甲醇复溶至1 mL,过0.22 μm滤膜,用HPLC测定其浓度。采用准一级动力学方程和准二级动力学方程研究MIPs2对辛弗林的吸附速率和吸附机理。
准一级动力学方程式:
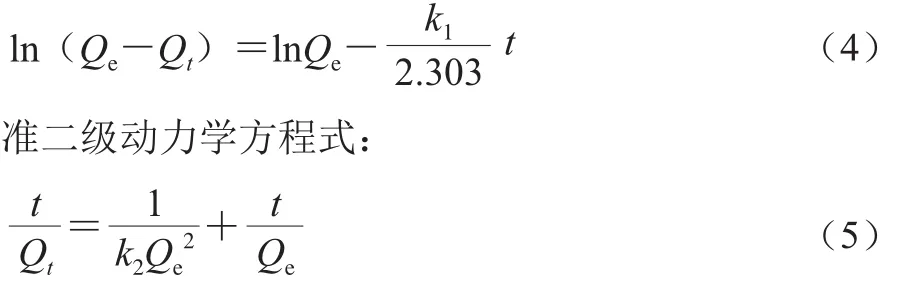
式中:Qe为平衡时吸附量/(μmol/g);Qt为测量时间为t时的吸附量/(μmol/g);t为时间/min;k1为一级动力学常数;k2为二级动力学常数。
1.3.2.4 选择性吸附
称取3 份10 mg的MIPs2放入10 mL离心管中,分别加入100 mg/L的辛弗林、酪胺、大麦芽碱标准溶液,于室温下恒温振荡2 h,10 000 r/min高速离心10 min,取出上清液,氮气吹干后用甲醇复溶到1 mL,溶液过0.22 μm滤膜,用HPLC测定其浓度。3 种被测物结构如图1所示。
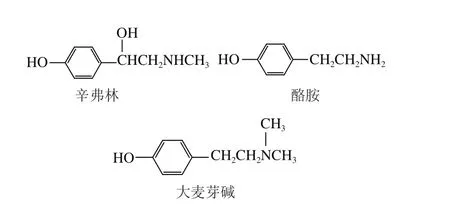
图 1 辛弗林、酪胺、大麦芽碱结构Fig. 1 Structures of synephrine, tyramine and maltine
1.3.3 分子印迹SPE
用MIPs2作填充材料制备分子印迹SPE柱。准确称取一定质量MIPs2溶于2 mL丙酮,装入SPE柱(Agilent,3 mL)中,用筛板压严实。依次用甲醇、乙腈、水各2 mL对SPE柱进行活化,然后加入一定体积的枳实粗粉提取液吸附一定时间后,进行淋洗和洗脱,分别收集上样液、淋洗液、洗脱液,浓缩至干,再用甲醇复溶,进行HPLC分析。
1.4 数据统计及图表绘制
实验采用Excel对测量结果进行统计计算,用Origin进行图表的绘制。
2 结果与分析
2.1 MIPs制备条件的优化
2.1.1 模板分子和功能单体的相互作用
功能单体能否与模板分子相互作用形成稳定的聚合物是MIPs能否具有高选择性和高吸附性的关键点。本研究利用紫外分光光度计测定辛弗林与不同的功能单体MAA、HEA、丙烯酰胺(acrylamide,AM)、MAAHEA的混合溶液预聚合后紫外最大吸收峰的变化情况。如图2所示,当功能单体为MAA-HEA时,预聚合物的紫外最大吸收峰发生了较明显的红移,可能原因是辛弗林虽然同时具有弱酸性和弱碱性,但其碱性大于酸性所以更易于与具有弱酸性的MAA结合,而加入HEA具有稳定分子间作用力的用途[28],所以预聚合物发生了相对明显的红移。故本研究选择MAA-HEA作为双功能单体。

图 2 辛弗林与不同功能单体预聚合后紫外波长变化Fig. 2 Change in maximum ultraviolet absorption wavelength after prepolymerization of synephrine with different functional monomers
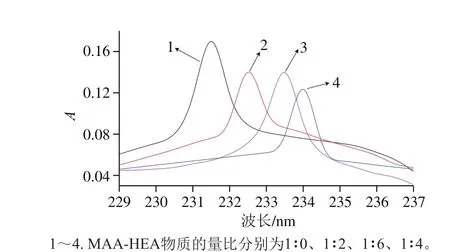
图 3 辛弗林与不同比例MAA-HEA预聚合后紫外波长变化Fig. 3 Change in maximum ultraviolet absorption wavelength in synephrine after prepolymerization with different ratios of MAA to HEA
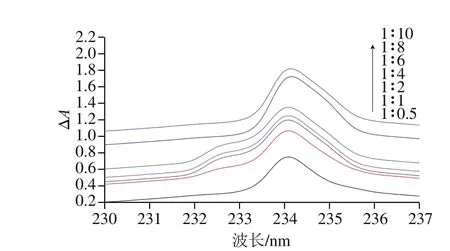
图 4 不同浓度功能单体与模板分子作用紫外吸收值差异Fig. 4 Comparison of UV absorption values of complexes between functional monomers at different concentrations and template molecules
模板分子与功能单体的比例同样影响MIPs的选择性和吸附性,同理利用紫外分光光度计检测辛弗林与MAAHEA在不同的物质的量之比(1∶0、1∶2、1∶4、1∶6)预聚合后最大吸收峰的变化,从图3可以看出,当辛弗林与功能单体的比例为1∶4时,紫外最大吸收发生了较显著的红移,所以模板分子与MAA-HEA的最佳比例为1∶4。为了进一步探究辛弗林与功能单体的结合机理,参照文献[29]固定辛弗林的浓度为0.1 mmol/L,从0.05~1 mmol逐渐增加功能单体的浓度,在紫外分光光度计上测得混合溶液的吸光度,从而绘制出紫外吸光度差光谱图4,在理论上,模板分子(T)与功能单体(M)形成复合物的过程,可以用下式表示:

式中:k为结合常数,n=1、2、3……。
由于功能单体的浓度(b0)远大于模板分子的浓度(a0),因此复合物的浓度(c)可推导为:

由于功能单体与模板分子以及其主客体复合物最大吸收在234 nm波长处,所以功能单体与模板分子在甲醇溶液中作用前后吸光度差ΔA可表示为:

式中:A0为开始时的吸光度;A为平衡时的吸光度;∆ξ为波长差/nm;b0为功能单体质量浓度/(mg/L);K为结合速率常数;ΔξC为复合物波长变化/nm;a0为模板分子质量浓度/(mg/L);l为平衡时波长/nm。
以ΔA/b0n对ΔA作图可以推导出n值,从而得知在甲醇溶液中一个模板分子的周围有几个功能单体与其作用,从而揭示分子印迹作用机理。
从图5可以看出,当n=2时,ΔA/b0n对ΔA作图是一条直线(R2=0.913 1),说明在研究的浓度范围内主客体主要存在形式为1 个辛弗林分子与2 个MAA-HEA发生作用。但是单独通过氢键识别是不稳定的,因为空间效应也可能对识别有很大作用。
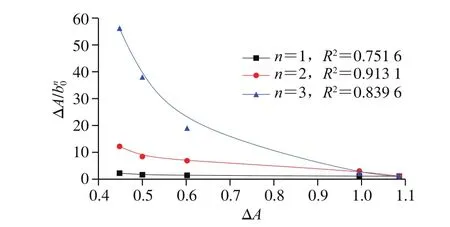
图 5 ΔA/b0 n与ΔA在234 nm波长处的关系Fig. 5 Plots of ΔA/b0 n versus ΔA at 234 nm
功能单体和模板分子间的结合强度、聚合物形态结构以及动力学性质取决于溶剂的种类及用量,本研究测定了不同种类溶剂和同一溶剂不同体积对聚合物吸附量的影响。引发剂也是影响聚合物吸附量的一个重要因素,参照文献[30]关于辛弗林MIPs的研究,引发剂的量应为功能单体和交联剂质量的1%,但是在本研究中按照此比例却不能得到MIPs,所以本研究探讨引发剂用量对辛弗林MIPs吸附量的影响,结果见表1。制备辛弗林MIPs的最优条件为当辛弗林为0.1 mmol,功能单体MAA(0.22 mmol)-HEA(0.18 mmol),致孔剂为乙腈且体积为10 mL、引发剂为AIBN且用量为32.0 mg、EDGMA为交联剂且用量为20 mmol时,聚合物的吸附效果最好。
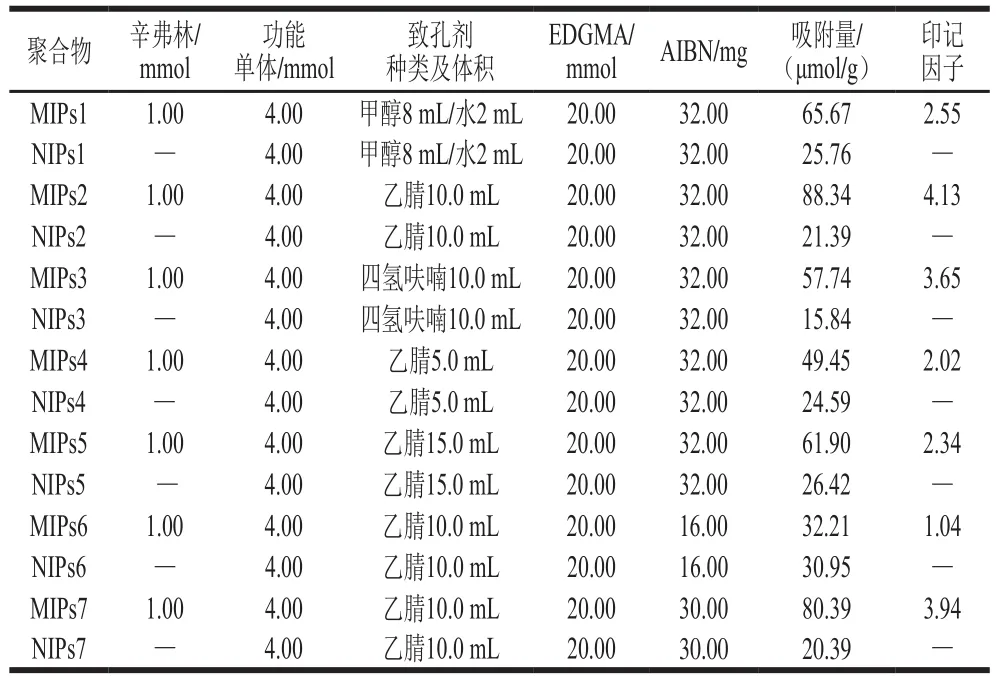
表 1 MIPs的制备条件及吸附性能Table 1 Preparation conditions of MIPs and corresponding adsorption capacity
2.1.3 SEM分析
取少量MIPs2和NIPs2通过SEM对聚合物的形貌进行表征,如图6所示。MIPs2结构疏松,具有网状结构的孔道,模板分子可通过这些孔道进入“预定”的孔穴,并与之发生相互识别。网状结构使聚合物在SPE过程中具有较大比表面积与较低流动阻力,这些优点有助于增强其在样品中特异性吸附性能。而NIPs2结构致密,尺寸结构均一、空穴较少,导致相应的吸附能力降低。

图 6 MIPs2 (a)和NIPs2(b)SEM图Fig. 6 Scanning electron microscopic images of MIPs2 (a) and NIPs2 (b)
2.2 聚合物静态吸附
2.2.1 MIPs和NIPs的识别属性
25 ℃条件下MIPs2和NIPs2的吸附等温线结果如图7a所示(多次测量统计结果),随着溶液中辛弗林质量浓度的增大,MIPs2和NIPs2对辛弗林的吸附量均逐渐升高,但MIPs2吸附量的增加幅度显著大于NIPs2,表明MIPs的吸附性能显著强于NIPs。结合图7b Scatchard模型讨论MIPs的吸附特性,对于MIPs2,以Q/Ce对Q作图呈现两条不同斜率的直线,说明MIPs对辛弗林的吸附存在2 种不同的结合位点(高亲和力结合位点和低亲和力结合位点)。其中,高亲和力结合位点的存在反映出MIPs2对辛弗林的特异性吸附,NIPs2对辛弗林的结合能力远低于MIPs2,这意味着NIPs2不具有与辛弗林匹配的特异性结合位点,并且仅具有差的非特异性吸附。通过分子印迹实现MIPs2的特异性吸附是显而易见的。

图 7 辛弗林吸附在MIPs和NIPs上的吸附等温线(a)和Scatchard图(b)Fig. 7 Corresponding adsorption isotherms (a) of synephrine adsorption onto MIPs and NIPs and Scatchard plots (b)
2.2.2 吸附动力学

图 8 MIPs2和NIPs2对辛弗林的吸附动力学分析Fig. 8 Adsorption kinetics of synephrine by MIPs2 and NIPs2
为确定吸附平衡时间,对MIPs2和NIPs2做吸附动力学实验。由图8(3 次测量后统计结果)可以看出,MIPs2对辛弗林的吸附量在60 min内快速增加,在60 min左右达到平衡后吸附量基本不变。因此,MIPs2的吸附平衡时间确定为60 min。并且MIPs2吸附量高于NIPs2,这是因为MIPs2的孔穴被辛弗林成功印迹,随着时间的推移,MIPs2的孔穴逐渐被填满导致吸附速度变缓最终达到动态平衡。而NIPs2由于没有特定的印迹孔穴,只能依靠聚合物表面的非特异性吸附作用进行少量的吸附,所以吸附量有限。为进一步探究吸附过程的动力学机理,对其进行了一级动力学模型和二级动力学模型拟合。

表 2 动力学方程拟合参数Table 2 Kinetic parameters of pseudo first-order and pseudo secondorder equations for synephrine adsorption by MIPs2 and NIPs2
对表2准一级动力学方程和准二级动力学方程的拟合结果进行分析可知,准一级动力学方程的拟合结果相关系数R2均较准二级动力学方程的R2要好,且由准一级动力学计算的平衡吸附量QeMIPs2和NIPs2(分别为205.43 μmol/g和50.81 μmol/g)接近于实验值(分别为228.82 μmol/g和54.91 μmol/g),说明MIPs2和NIPs2对辛弗林的吸附过程更符合准一级动力学方程。
为了保证对花溪区红岩水库数据录入的准确性和效率性,需要采用本地数据和远程数据结合录入方式对应基础工程数据的录入。如果在对相关工程数据进行录入发现格式错误,可调用WEbService软件出发数据库存储过程,对于相关数据直接对应数据库列表进行文件域名修改。
2.2.3 选择性吸附
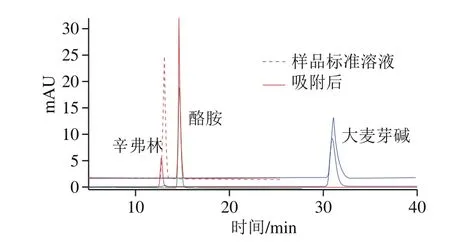
图 9 样品标准溶液和MIPs2吸附后HPLC图Fig. 9 HPLC chromatograms of synephrine standard solution and synephrine-rich extract from Fructus Aurantii immaturus after MIPs2 adsorption
选取与辛弗林结构类似的酪胺和大麦芽碱作为底物进行吸附选择性研究,结果见图9。对比吸附前后溶液的HPLC可知,MIPs2对3 种物质都具有吸附性能,但对辛弗林的吸附性能明显优于其他2 种。这是由于MIPs2中具有与辛弗林结构相匹配的印迹孔穴,对辛弗林有特异识别性,由于酪胺和大麦芽碱与辛弗林结构相似,分子中具有一部分相同的基团,所以也能被少量的吸附。
2.3 分子印迹SPE条件优化
以MIPs2作为SPE吸附填充物,洗脱液中辛弗林含量和提取率为比较标准,用HPLC法分别检测并计算上样液、淋洗液、洗脱液中辛弗林含量,优化聚合物与枳实提取液的最佳比例、优化淋洗液种类及比例、洗脱液比例。当聚合物质量为200 mg,柱压适中时,淋洗和洗脱操作方便快速,所以MIPs质量为200 mg为基础进行研究,淋洗剂是SPE中至关重要的因素,它应尽可能地消除MIPs对模板分子非特异性相互作用而最大限度地保留住特异性相互作用,所以本研究在优化了上样量、洗脱液比例后,特别比较了不同极性溶剂(乙腈-水、乙腈-EA不同比例混合溶剂)对辛弗林SPE的影响,平行测定3 次,测量结果取平均值,见表3。当MIPs质量为200 mg,枳实提取液为0.20 mL,淋洗液为EA-乙腈(6∶4,V/V),洗脱液为甲醇-乙酸(8∶2,V/V)时,SPE效果最佳,洗脱液中辛弗林质量分数达最大值为93.34%,提取率为73.90%。

表 3 固相提取条件优化Table 3 Optimization of solid phase extraction conditions
3 结 论
采用沉淀聚合法制备一系列辛弗林MIPs,当辛弗林添加量为0.1 mmol、交联剂选择 EDGMA(2 mmol)、单体选择MAA(0.22 mmol)和HEA(0.18 mmol)、致孔剂为10 mL乙腈,交联剂为0.2 mmol AIBN时,MIPs2对辛弗林有特异吸附性能且吸附量大,最大吸附量为228.82 μmol/g,此吸附量优于报道的辛弗林MIPs吸附量73.91 μmol/g[30]和155.54 μmol/g[31]。将MIPs用于SPE填充物对枳实中的辛弗林进行提取和纯化,当聚合物质量为200 mg,枳实提取液体积为0.2 mL,淋洗液为EA-乙腈6∶4(V/V),洗脱液为甲醇-乙酸8∶2(V/V)时,辛弗林的质量分数由1.93%提高到93.34%,提取率为73.90%。该方法具有快速、经济、高效的特点,可应用于枳实粗粉中辛弗林的提取和纯化。
