废弃黑葵花籽壳绿色制备金纳米粒子及其抗氧化和催化性能
2020-04-25关桦楠龚德状韩博林刘晓飞
关桦楠,宋 岩,龚德状,刘 博,韩博林,杨 帆,刘晓飞,张 娜
(哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
近年来,金属纳米材料因其特殊的物理化学性质,已成为诸多领域的研究热点[1-3]。以金纳米粒子(AuNPs)为典型代表的贵金属纳米材料已被广泛应用于生化分析[4]、生物制药[5]、光学成像[6]、催化合成[7]和半导体制备[8]等领域。AuNPs具有良好的生物相容性,因其微小的粒径和较高的比表面积具有良好的催化、光学、电化学、吸附特性以及表面等离子体共振等优良性能[9-10]。AuNPs的制备通常采用化学还原法,利用还原剂将Au(III)转变为单质金种,继而生长为不同表观形态的AuNPs。还原剂种类对AuNPs的粒径、形状、稳定性甚至诸多特性均有显著影响[11]。AuNPs通常被应用于医药、食品加工和物质分析等领域,对其生物相容性和安全性有较高的要求,鉴于此,AuNPs绿色制备技术研发已吸引了国内外诸多研究机构的热切关注[12-14]。
目前,AuNPs绿色制备技术中的还原剂多采用具有天然还原性成分的植物源材料,主要包括植物茎叶提取物[15]、花瓣提取物[16]、根系提取物[17]、种子油脂提取物[18]、果实提取物及多种植物生物质材料[19]。这些提取物材料中大多含有较高浓度的脂肪酸类、维生素类、多酚类和黄酮类等具有还原性的天然活性成分[20]。这些还原性物质在制备过程中,因其结构的不同,多数成分以稳定剂的形式分布在AuNPs外表层,在防止AuNPs聚集的同时还能有效提升AuNPs的相关性能。研究表明,采用不同植物成分所制备的AuNPs,不仅具有良好的生物安全性,而且可有效改良AuNPs的抗菌性能、催化性能、抗氧化性能和光电化学性能[21-23]。
黑葵花籽在我国北方地区分布广泛,相关的食品种类也十分丰富,其食品加工过程中会产生大量的葵花籽壳废弃物,如果处理不当不仅污染环境,而且容易传播疾病[24-25]。与此同时,多项研究成果表明,黑葵花籽壳中含有丰富的花色苷类物质和多酚类物质。本实验拟采用废弃黑葵花籽壳提取物快速绿色制备AuNPs,并考察AuNPs的稳定性、抗氧化活性和催化活性,为贵金属纳米材料在食品和医药行业的进一步应用提供基本资料。
1 材料与方法
1.1 材料与试剂
黑葵花籽 黑龙江省密山大成瓜子经销有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、氯金酸、硼氢化钠 美国Sigma-Aldrich公司;4-硝基苯酚(4-nitrophenol,4-NP)、2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT) 国药集团化学试剂有限公司;实验试剂均为分析纯。
1.2 仪器与设备
FWl00高速万能粉碎机 中国天津市泰斯特仪器有限公司;R-201旋转蒸发仪 中国上海申顺生物科技有限公司;BT-9300H激光粒度分布仪 美国惠普公司;JEOL2000透射电子显微镜 日本电子株式会社;MAGNA-IR560E.S.P傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Nicolet公司;phi-5000Versaprobe X射线衍射仪(X-ray diffraction,XRD) 美国ULVCA-PHI公司。
1.3 方法
1.3.1 黑葵花籽壳提取物的制备
将黑葵花籽手动剥壳,采用双蒸水清洗黑葵花籽壳3 次,真空干燥后粉碎。精确称取黑葵花籽壳粉末10 g,首先采用100 mL石油醚对其进行脱脂,再用300 mL体积分数为60%的乙醇溶液在50 ℃条件下回流提取1 h,过滤浓缩,获得浓缩液100 mL,于4 ℃保存待用,此为黑葵花籽壳提取物原液(即100%提取物)。采用去离子水稀释成不同体积分数的工作液,由低到高分别为0%提取物、10%提取物、20%提取物、40%提取物、60%提取物和80%提取物。
1.3.2 AuNPs的绿色合成
室温条件下,将提前4 ℃预冷的20 mL氯金酸溶液(0.01 g/mL)置于锥形瓶中,伴随磁力搅拌器温和搅动(100 r/min);1 min后,迅速加入不同体积分数黑葵花籽壳提取物2 mL;随即观察颜色的变化,即体系由淡黄色开始变为淡红色时,立刻提升搅拌速率(200 r/min),当体系颜色完全变为酒红色时,将整个体系于4 ℃贮存10 min,用以终止制备过程;4 000 r/min离心10 min去上清液,采用去离子水清洗沉淀1 次,4 000 r/min离心10 min后,再用5 mL去离子水溶解沉淀,此为黑葵花籽壳提取物绿色合成的AuNPs溶胶,计算溶胶中AuNPs的质量浓度;拟通过紫外-可见光光谱、粒径分布和表观形貌筛选最适工作液质量浓度。
1.3.3 AuNPs的稳定性分析
将AuNPs置于4 ℃保存不同时间(5、10、15、20、25、30、35、40、45、50、55 d和60 d)。充分振荡后,吸取1 mL AuNPs溶胶置于比色皿中,再添加2 mL的去离子水,置于紫外-可见光分光光度计中,考察相同波长下,特征吸收峰的峰值变化情况;考察不同温度条件下(25、35、45、55、65 ℃和75 ℃)AuNPs的稳定性;考察不同盐浓度条件下(100、200、300、400、500、600 mmol/L和700 mmol/L)AuNPs的稳定性,充分振荡后,吸取1 mL AuNPs溶胶置于比色皿中,再添加2 mL的不同浓度NaCl溶液,静置反应10 min后,摇匀,置于紫外-可见光分光光度计中,考察相同波长下,特征吸收峰的峰值变化情况;考察不同pH值条件下(2、3、4、5、6、7、8、9、10和11)AuNPs的稳定性,采用NaOH和盐酸调节pH值。
1.3.4 AuNPs的抗氧化性分析
采用DPPH法测定所制备AuNPs的抗氧化活性[15]。向离心管中依次添加3 mL的DPPH-乙醇溶液(40 mg/L)和不同质量浓度的AuNPs溶胶(10、20、30、40、50、60、70 µg/mL和80 µg/mL),混匀后,室温避光条件下,振荡孵育1 h。吸取上清液,考察517 nm波长处的可见光特征峰峰值的变化。以DPPH-乙醇溶液作为空白对照,以相同质量浓度的BHT作为标准抗氧化剂。抗氧化活性以抑制率指标,计算见式(1)[15]:

式中:I为抑制率/%;A0为空白对照的吸光度;A1为不同质量浓度AuNPs溶胶和BHT样品的吸光度。
1.3.5 AuNPs的催化活性
选择催化4-NP液相还原为对氨基苯酚(4-aminophenol,4-AP)探针反应验证所制备AuNPs的催化活性。向20 mL的4-NP溶液(2.5×10-4mol/L)中,依次加入3 mL AuNPs溶胶和1 mL新鲜配制的NaBH4(0.25 mol/L),混匀后静置不同时间。在总体系中吸取反应液0.5 mL,加入到比色皿中,再加入2 mL去离子水,混合均匀后,置于紫外-可见光分光光度计中,扫描反应体系的吸收光谱,观察295 nm和400 nm波长处的特征吸收峰变化。AuNPs催化反应速率kapp计算见式(2)[19]:

式中:A0为4-NP初始吸光度,At为4-NP在不同催化时间t(min)时的吸光度。
1.4 数据处理
实验均重复3~5 次,利用Origin 9.0软件作图,采用DPS 7.05软件对数据进行统计学分析。
2 结果与分析
2.1 黑葵花籽壳提取物最适体积分数筛选及AuNPs的表征
由图1可知,0%提取物制备体系无明显的吸收峰,而10%~100%提取物制备体系都在波长526 nm处呈现出明显的吸收峰。根据Mie理论,该峰为AuNPs的特征峰,且在波长520 nm左右出现明显吸收峰的AuNPs,一般粒径在3~20 nm范围内[4]。图1说明黑葵花籽提取物中的活性成分可以作为还原剂制备出粒径合适的AuNPs。从图1可知,体积分数为100%、80%和60%提取物制备的AuNPs特征峰峰值皆高于0.5,而40%及以下提取物所制备的AuNPs峰值较弱,说明伴随提取物体积分数越高,AuNPs的数量越多。鉴于体积分数为100%、80%和60%提取物制备的AuNPs数量较为接近,继续通过粒径分布数据对这3 个体积分数提取物制备的AuNPs进行筛选。
测定体积分数为100%、80%和60%提取物制备的AuNPs粒径分布,见图2。一般认为,AuNPs诸多性能与其粒径大小和形状有密切相关性,粒径越小,性能越优越[15,19,22]。由图1可知,3 个体积分数提取物制备的AuNPs形状差异不大(吸收峰波长基本一致),鉴于此,本实验基于平均粒径的大小筛选最适的提取物体积分数。由图2可知,100%提取物制备的AuNPs平均粒径为(7.84±2.56)nm,80%提取物制备的AuNPs平均粒径为(7.25±2.24)nm,60%提取物制备的AuNPs平均粒径为(7.49±1.31)nm。该结果表明,粒径与提取物体积分数无直接相关性,可能是因为100%体积分数提取物中在含有还原性物质之外还含有高浓度的大分子物质(如氨基酸或者有机酸等),这类物质反而影响了金种的生长,造成金种成长过程中的聚集,导致粒径偏大,而体积分数偏低的提取物没有足够剂量还原性物质,也会影响AuNPs的生长[18]。综上所述,选择80%提取物制备AuNPs参与后续实验。
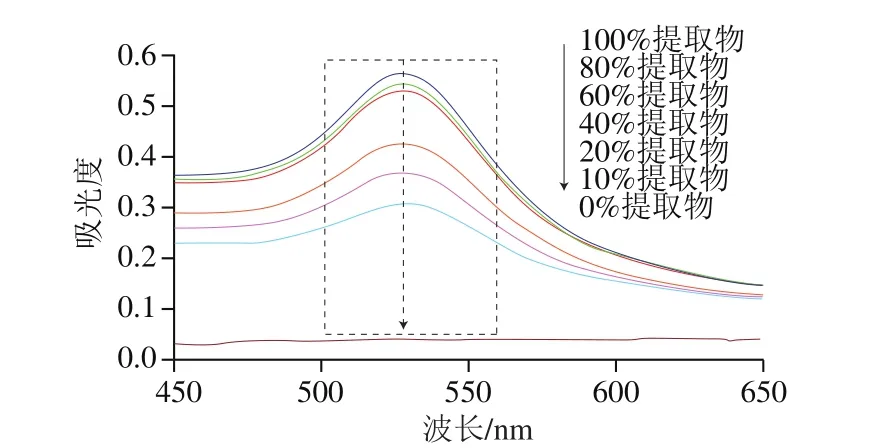
图 1 不同体积分数提取物制备AuNPs的紫外-可见光光谱Fig. 1 UV-visible spectra of gold nanoparticles prepared with different concentrations of the extract


图 2 不同体积分数提取物制备AuNPs的粒径分布Fig. 2 Size distribution of gold nanoparticles prepared with different concentrations of the extract
采用透射电子显微镜表征80%提取物制备的AuNPs表观形貌。由图3A可知,AuNPs呈现圆球形,分散性良好,无明显聚集现象,粒径分布较为均匀,在6~10 nm之间,这与图2B中粒径表征结果基本一致。
为进一步揭示黑葵花籽壳提取物中的天然成分在AuNPs形成过程中的作用,采用FTIR表征葵花籽壳提取物和AuNPs表面化合物结构。从图3B可以看出,AuNPs分别在3 268、1 644 cm-1和1 475 cm-1处具有明显吸收峰,分别对应O—H、C=C和O—H。部分研究成果表明,黑葵花籽壳中富含的花色苷是一种以黄酮核为基础含有C6—C3—C6骨架的类黄酮物质,表面富含大量的—OH[26]。通过与提取物吸收峰作比较,AuNPs在1 644 cm-1处对应的C=C应该来自于提取物中的碳骨架,在1 475 cm-1处对应的O—H应该来源于花色苷中丰富的羟基基团和多酚类物质。而在3 268 cm-1处所对应的O—H,因其较高的透光率峰值,推断可能来自于体系中残留的乙醇或者提取物中的其他的多酚类物质[19,26]。对比研究葵花籽壳提取物与制备反应后的体系上清液(主要成分为残余的提取物和氯金酸)之间的成分变化,可以看出在1 644 cm-1和1 475 cm-1处的吸收峰强度明显下降,说明C=C和O—H基团数量减少,表明提取物中的类黄酮和花色苷等活性成分含量降低,进一步说明提取物中的活性成分参与AuNPs的还原制备过程。综上所述,图3B结果充分说明提取物中的花色苷和多酚类物质不仅作为AuNPs合成过程中的还原剂,还可与AuNPs表面结合充当保护剂。
从图3C可见,衍射峰(111)、(200)、(220)和(311)分别对应2θ为38.25°、44.58°、64.93°和77.61°,皆为AuNPs的特征衍射峰[27],其中(111)和(311)说明AuNPs为催化裂化型晶格,有助于提升该纳米粒子的催化性能。

图 3 AuNPs透射电子显微镜图(A)、FTIR光谱图(B)和XRD图(C)Fig. 3 TEM image of gold nanoparticles with (A), FTIR spectra of gold nanoparticles and the extract (B), and X-ray diffraction pattern of gold nanoparticles (C)
2.2 稳定性分析
AuNPs稳定性主要体现粒子尺寸依赖性上,根据其表面等离子共振特性,当粒径、间距和形状发生变化时,紫外-可见光光谱中的表面离子共振特征峰会发生衰减或偏移(红移或蓝移)[11]。本实验分别评估黑葵花籽壳提取物绿色制备的AuNPs在不同贮藏时间、温度、盐浓度和pH值条件下的稳定性,以特征峰波长526 nm处的吸光度作为指标,考察不同条件下其变化情况。
由图4A可知,在4 ℃长期贮存条件下,AuNPs在前30 d贮存期内,特征峰的峰值变化不大,说明贮藏30 d过程中,AuNPs没有发生团聚,且数量稳定,没有出现沉淀;当贮存时间超过30 d以后,峰值开始出现轻微的下降;贮存60 d后的峰值与初始峰值之比,仍然高于90%,说明制备的AuNPs具有良好贮存稳定性。选择25~75 ℃水浴加热20 min,评估AuNPs在常见温度范围内的稳定性,见图4B。结果表明,温度对AuNPs的稳定性影响较小,峰值变化不大。AuNPs的“高盐聚集”是其一个非常重要的现象,但是却在某些领域上限制了其广泛应用,尤其在食品药品催化加工或者成分检测时,盐浓度对其稳定性的影响不可忽视。本研究以氯化钠为模型,考察AuNPs在高盐浓度下的稳定性。如图4C所示,当体系中NaCl浓度超过300 mmol/L时,特征峰的峰值开始出现明显下降趋势;当NaCl浓度达到700 mmol/L时,峰值下降至初始峰值的1/3。该结果是因为高浓度金属阳离子(Na+)大量吸附在某些AuNPs表面,与部分AuNPs表面的负电荷物质(花色苷或多酚类物质)发生静电吸附,导致不同粒子之间的聚集,从而引起吸收峰位置的红移[13]。但是在NaCl浓度不超过300 mmol/L时,仍然保持较高的稳定性,已优于其他研究的成果[16,21,27]。由图4D可知,AuNPs在强酸体系中(pH<3),峰值出现明显下降,呈现出不稳定性。根据之前的实验结果推测,所制备的AuNPs表面会有花色苷或者某些多酚物质作为保护剂,而其中花色苷对pH值较为敏感。当花色苷处于酸性体系中时,其结构会逐渐转变为黄盐阳离子,该阳离子所带正电荷会加剧AuNPs的聚集甚至出现沉淀,导致特征峰峰值剧烈下降[27]。鉴于此,也可推断AuNPs表面应该覆盖有负电荷。综上所述,AuNPs分别在在不同贮藏时间、温度、盐浓度和pH值条件下都体现了良好的稳定性。该结果可对AuNPs在某些领域的使用进行有效指导。


图 4 AuNPs的稳定性分析Fig. 4 Stability of gold nanoparticles
2.3 抗氧化活性分析
本实验以BHT对照,以DPPH自由基抑制率为指标,考察黑葵花籽壳提取物制备AuNPs的抗氧化活性即供氢能力。由图5可知,当添加的AuNPs和BHT质量浓度在10~30 µg/mL范围内时,AuNPs的抗氧化能力与BHT有一定差距;AuNPs质量浓度逐渐增加时,抗氧化能力随之提高,当添加质量浓度为80 µg/mL时,AuNPs对DPPH的抑制率(27.9%)与BHT(28.1%)极为接近。结果表明,绿色制备的AuNPs在适宜质量浓度下有良好的抗氧化活性。同时也再一次证明,AuNPs表面存在花色苷和多酚类物质作为保护剂,此类物质的羟基等基团具有良好的抗氧化性能。

图 5 黑葵花籽壳提取物合成AuNPs的抗氧化活性Fig. 5 Antioxidant activity of gold nanoparticles synthesized with black sunflower seed shell extract
2.4 催化活性分析
采用绿色制备的AuNPs催化4-NP转化4-AP,以此作为评估其催化活性的探针反应。一般研究认为贵金属纳米粒子作为催化剂,可在体系中含有过量NaBH4情况下,将BH4-和4-NP同时吸附在粒子表面,促进电子由供体(BH4-)向受体(4-NP)转移,进而将4-NP转化为4-AP,引起体系紫外-可见光吸收峰的位移[28-29]。由图6可知,当体系中只含有4-NP和NaBH4两种成分时,两者之间没有发生任何反应,其紫外光谱显示仅在波长400 nm处具有吸收峰,此为4-NP的特征吸收峰。当向该体系中加入AuNPs时,波长400 nm处的吸收峰峰值开始下降,并伴随着在波长295 nm处出现新的吸收峰(4-AP的特征峰),这充分证明了AuNPs能够催化此还原反应,将4-NP逐渐转化为4-AP。随着催化时间的延长,4-NP的吸收峰峰值逐渐降低,对应的4-AP的吸收峰峰值在逐渐增大,见图6A。当催化时间为11 min后,体系中的4-NP已接近全部转化为4-AP。由图6B可知,AuNPs在催化该反应过程中,ln(A0/At)和反应时间t之间存在良好的线性关系,说明该反应符合准一级反应动力学,因此,AuNPs催化4-NP转化为4-AP反应可用一级动力学体系评估其催化反应速率。根据该方程计算,kapp值为0.004 23 s-1,该反应速率优于大部分研究结果[11,14-15,17,30-31],其原因为AuNPs表面的富含多种活性基团,有助于吸附BH4-和4-NP,可促进电子的传递,该结果与其他研究类似[30-31]。综上所述,采用黑葵花籽壳提取物所制备的AuNPs具有良好的催化活性。

图 6 AuNPs催化活性Fig. 6 Catalytic activity of gold nanoparticles
3 结 论
本实验采用废弃的黑葵花籽壳提取其活性成分,绿色还原氯金酸盐成功制备具有微小粒径和良好性能的AuNPs。结果表明,选择80%提取物制备的AuNPs最为合适,平均粒径为(7.25±2.24)nm。该粒子在不同温度、贮藏时间、pH值和盐浓度条件下具有良好的稳定性,说明黑葵花籽壳中的活性成分(花色苷和多酚类)在AuNPs形成过程中既是还原剂又是保护剂。表面固着的活性成分极大改善了AuNPs的抗氧化活性。此外,利用黑葵花籽壳提取物制备AuNPs的催化动力学研究中所获得的kapp值可达0.004 23 s-1,进一步说明其还具有良好的催化活性。采用此方法制备AuNPs不仅具有广阔的应用前景和实践价值,还可以拓宽其适用领域,在条件苛刻的食品药品催化生产、食品药品成分原位分析、医疗靶向及成像和环境保护方面显示出较高的实用价值。同时,也可为其他种类贵金属纳米粒子和部分新型纳米材料绿色制备技术的改良提供基础资料。
