亚麻籽粕制备小分子抗氧化活性肽
2020-04-25张文敏周浩纯刘新旗
张文敏,张 健,周浩纯,赵 迪,李 赫,*,刘新旗,肖 林
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学食品学院,北京 100048;2.山东龙力生物科技股份有限公司,山东 禹城 251200)
亚麻(Linum usitatissimumL.)属于亚麻科的1 a生草本植物,起源于中亚或地中海地区,后来传播到中国和印度。全亚麻籽中包含营养物(油、蛋白质、膳食纤维)、非营养物(木酚素)和抗营养因子(黏胶、植酸、变应原、生氰糖苷、胰蛋白酶抑制剂、抗67-因子)等[1]。亚麻籽经过提取油脂后得到的粕的蛋白约占32%~49%,是非常好的蛋白资源[2],但亚麻籽粕仅被用作动物饲料、肥料或者废料处理,造成了资源的极大浪费。由于蛋白多肽具有良好的生理功能,特别是抗氧化活性肽能够清除体内过剩的活性氧自由基等,防止机体防御机能受损,维持正常生长代谢,已然成为学者们研究的热点[3]。而亚麻籽粕中丰富的蛋白资源也引起了学者们的关注。
亚麻籽蛋白主要由球蛋白(11S、12S)和白蛋白(1.6S、2S)组成,分别占总亚麻籽蛋白的56%~73.4%和20%~42%,其分子质量分别约为252~298、10~50 kDa和10、16~17 kDa[4-6]。亚麻籽蛋白具有与大豆分离蛋白相当的氨基酸模式,含人体所必需的8 种氨基酸,是一种优质的植物蛋白[7-9]。亚麻籽蛋白经蛋白酶水解氨基酸之间的肽键后产生不同分子质量大小的肽和游离氨基酸,该混合物的特点是易于吸收、利用率高、氨基酸平衡好[10]。有研究表明亚麻籽蛋白酶解产物具有抗氧化[4]、降血压[11]、降胆固醇[12]以及提高机体免疫力[13]等活性。Karamać等[14]发现亚麻籽蛋白酶解产物的抗氧化活性明显优于亚麻籽蛋白,其中螯合金属离子能力最强的为胰酶酶解产物,高达71.5%。Hwang等[4]利用不同的超滤膜分离亚麻籽蛋白酶解产物后分析不同组分的抗氧化活性,结果表明:1~3 kDa的多肽与VC、VE和丁基羟基茴香醚相比,具有更好的抗氧化活性。因此,亚麻籽蛋白酶解产物可作为天然抗氧化剂用来开发具有强抗氧化活性的功能性食品以改善机体健康状况[14-15]。但关于亚麻籽抗氧化活性肽的结构知之甚少,并且研究多集中于从亚麻籽中提取蛋白[16]。
本实验以副产物亚麻籽粕为研究对象,分析亚麻籽粕蛋白的氨基酸组成,使用3 种不同蛋白酶制备酶解产物,比较不同酶解产物的抗氧化活性以及与分子质量大小的关系,确定亚麻籽抗氧化活性肽的结构特征,旨在为利用亚麻籽粕开发蛋白质和活性肽提供理论基础。
1 材料与方法
1.1 材料与试剂
亚麻籽粕 荣海生物科技有限公司;碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg)、胰蛋白酶(250 U/mg) 源叶生物科技有限公司;BCA试剂盒美国热电公司;其他所用试剂为分析纯或优级纯。
1.2 仪器与设备
Milli-Q Integral 5纯水仪、8050超滤杯 美国Millipore公司;KJELTEC 8000全自动凯式定氮仪 丹麦Foss公司;Cary 60紫外-可见分光光度计、1260 Infinity高效液相色谱仪 美国Agilent科技有限公司;Biochrom30+氨基酸自动分析仪 英国Biochrom公司;Mini-PROTEAN Tetra小型垂直电泳仪、ChemiDoc MP蛋白成像分析系统 美国Bio-Rad公司;infinite 200 Pro Nanoquant酶标仪 瑞士Tecan公司;THZ-92B旋涡振荡器、HH.S11-4电热恒温水浴锅 上海博讯实业有限公司;C-MAG HS 7磁力搅拌器 德国IKA公司;X-30R台式高速离心机 美国Beckman公司;AKTA pure蛋白纯化系统 美国GE公司;Scientic EASY-nLC 1000 System(Nano HPLC)高效液相色谱、Q-Exactive质谱系统 美国Thermo公司。
1.3 方法
1.3.1 碱提酸沉法提取蛋白流程
参考文献[17-18]并略作修改。粉碎亚麻籽粕并去除其杂质(如小石块等),将筛选后的粕过80 目筛,密封保存。将粕与纯水按照1∶20的比例制成悬浮液,50 ℃条件下调pH 9.5,恒温水浴浸提2 h。浸提结束后,4 ℃、4 500 r/min离心30 min,取上清液备用。进行二次浸提,将2 次上清液合并,并调上清液pH 4.8,4 ℃、4 500 r/min离心30 min,将沉淀用纯水复溶,调pH值至中性,4 ℃透析,冷冻干燥,-20 ℃保存(图1)。

图 1 蛋白提取流程以及酶解流程图Fig. 1 Flow charts of flaxseed protein extraction and enzymatic hydrolysis
1.3.2 亚麻籽粕蛋白含量的测定
采用凯氏定氮法,参考GB 5009.5—2016《食品中蛋白质的测定》,转换系数设置6.25。
1.3.3 亚麻籽粕蛋白的氨基酸组成分析
酸水解方法参考GB 5009.124—2016《食品中氨基酸的测定》。碱水解方法参考文献[19]并略作修改。配制不同质量浓度(0.05、0.1、0.2、0.3、0.4、0.5 mg/mL)的色氨酸标准溶液,绘制标准曲线。称取蛋白含量在10~20 mg之间的样品,加入含5%氯化亚锡的5 mol/L NaOH溶液3 mL和消泡剂4 滴,水解管冰水浴15 min,经反复3 次抽真空、氮吹以排除空气后旋紧水解管,110 ℃水解20 h。冷却后,用6 mol/L HCl溶液中和,纯水稀释定容后离心取上清液,在高效液相色谱分析。
1.3.4 酶解流程
参考文献[14,20-21,24]并略作修改。配制2%亚麻籽粕蛋白溶液,分别用碱性蛋白酶、中性蛋白酶和胰蛋白酶酶解亚麻籽粕蛋白溶液,将反应温度与溶液的pH值调至酶的最适温度与pH值。按照4 500 U/g的加酶量添加酶,酶解过程中用1 mol/L NaOH或HCl溶液调节溶液pH值保持不变,控温磁力搅拌酶解6 h,酶解结束后立即85 ℃灭酶15 min,冷却后,4 ℃、4 500 r/min离心30 min,膜过滤提纯,取过滤液冷冻干燥,-20 ℃保存(图1)。
1.3.5 水解度和酶解产物中多肽含量的测定
1.3.5.1 水解度的测定
采用pH-stat法,亚麻籽蛋白酶解产物的水解度[22]计算如下:

式中:h为水解过程中切割的肽键数;htot为蛋白质中肽键的总数;B为水解过程中消耗的碱量/mL;Nb为碱液浓度/(mol/L);MP为水解液中蛋白的质量/g;1/α为校正系数。
1.3.5.2 多肽含量的测定
利用三氯乙酸沉淀蛋白并结合凯氏定氮法测定酶解产物中多肽的百分含量。转换系数设置6.25。利用BCA试剂盒测定蛋白多肽的质量浓度。
1.3.6 亚麻籽粕蛋白及其不同酶解产物分子质量分布的测定
1.3.6.1 SDS-PAGE分析
参考文献[14,23]并略作修改。胶体选用12%的分离胶和5%的浓缩胶。配制10 mg/mL的蛋白样品溶液。样品设置3 组:组a为亚麻籽粕蛋白,组b为添加β-巯基乙醇的亚麻籽粕蛋白,组c为亚麻籽蛋白,沸水浴8 min后离心上样,进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE),电压设置80 V,时间2 h,上样量10 μL。采用G-250考马斯亮蓝染色,脱色液脱色至凝胶背景无色,凝胶成像仪拍照分析。
1.3.6.2 凝胶色谱法
凝胶色谱柱Superdex 200 10/300 GL(10 mm×300 mm)。流动相:含0.15 mol/L NaCl的0.05 mol/L磷酸盐,等度洗脱,流速0.5 mL/min,280 nm波长处测定吸光度。配制不同质量浓度标准溶液,其分子质量分别为75、43、29、13.7、6.5 kDa。样品质量浓度10 mg/mL,上样量100 μL。
1.3.7 FRAP的测定
参考文献[24]并略作修改。配制总抗氧化能力(Ferric ion reducing antioxidant power,FRAP)工作液(现用现配):300 mmol/L、pH 3.6的醋酸盐缓冲液、10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液按10∶1∶1比例混合均匀。
配制不同浓度(0.2、0.5、1、1.5、1.8、2.0 mmol/L)的FeSO4标准溶液,绘制标准曲线。测定酶解产物和超滤组分活性时,取10 mg/mL的样品0.1 mL加入4 mL工作液和1 mL纯水,振荡混匀;测定组分F1~F4活性时,取0.1 mg/mL的样品1 mL加入4 mL工作液和0.1 mL纯水,振荡混匀。593 nm波长处测定初始反应时体系的吸光度。37 ℃水浴锅中反应1 h,每隔10 min测定吸光度,并绘制动力学曲线。
1.3.8 ABTS阳离子自由基清除能力的测定
参考文献[25]并略作修改。将5 mL的7 mmol/L 2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)溶液与88 μL的140 mmol/L过硫酸钾溶液混合,室温避光条件下静置12~16 h,得到ABTS储备液。用10 mmol/L的磷酸盐缓冲液(pH 7.4)稀释至734 nm波长处的吸光度为0.7±0.02即可得到ABTS工作液。配制不同浓度(0.15、0.3、0.6、0.9、1.2、1.5 mmol/L)的Trolox标准品,绘制标准曲线。取10 mg/mL的样品10 μL加入190 μL的ABTS工作液,室温反应6 min,测定734 nm波长处吸光度。
1.3.9 羟自由基清除能力的测定
采用水杨酸法,参考文献[26]并略作修改。取10 mg/mL的样品0.1 mL置于试管中,加入6 mmol/L FeSO4溶液和6 mmol/L H2O2溶液各1 mL,振荡混匀,放置10 min后加入1 mL的6 mmol/L水杨酸溶液,再次混匀,37 ℃水浴锅中静置30 min,测定510 nm波长处的吸光度。按式(3)计算羟自由基清除率。

式中:A1为空白组,使用蒸馏水替代样品;A2为样品组,加入标准品或者样品的吸光度。
1.3.10 抗氧化活性肽的分离纯化及其活性分析
1.3.1 0.1 超滤法
参考文献[27]并略作修改。利用不同截留分子质量的超滤膜(3、10 kDa)分离酶解产物,每种酶解产物被分成高分子质量(3~10 kDa)和低分子质量(<3 kDa)2 个组分,然后测定各个组分的抗氧化活性,选取抗氧化活性最高的组分进行收集,冷冻干燥,-20 ℃保存。
1.3.1 0.2 凝胶色谱法
将抗氧化活性最高的超滤组分通过AKTA Pure蛋白纯化系统进一步分离纯化,方法参考文献[27]并略作修改。凝胶色谱柱型号:Superdex Peptide 10/300 GL(10 mm×300 mm),流动相:含0.15 mol/L NaCl的0.05 mol/L磷酸盐,等度洗脱,流速0.5 mL/min,220 nm波长处测定紫外吸光度。样品质量浓度10 mg/mL,上样量500 μL,样品被分成4 个组分F1~F4,收集各个组分,冷冻干燥,-20 ℃保存。
1.3.11 抗氧化活性肽的高效液相色谱-串联质谱联用分析
将组分F2用20 μL 2%甲醇、0.1%甲酸溶液复溶。12 000 r/min离心10 min,取上清液,采取夹心法上样,上样体积10 μL。
色谱条件:预柱(Acclaim PepMap100 column,2 cm×100 μm,C18,3 μm);色谱柱(EASY-Spray column,12 cm×150 μm,C18,1.9 μm);流动相A:100%超纯水,0.1%甲酸;流动相B:100%乙腈,0.1%甲酸;流速600 nL/min。梯度洗脱过程:0~16 min,5%~10% B;16~51 min,10%~22% B;51~71 min,22%~30% B;71~72 min,30%~95% B;72~78 min,95% B。
质谱条件:电喷雾离子化;正离子模式;喷雾电压2 000 V;全扫描模式,扫描范围m/z300~1 400;二级质谱扫描方式:直线扫描。
质谱原始文件(raw文件)采用Thermo公司的配套商用软件Proteome Discoverer2.1进行查库鉴定分析。数据库选用uniprot-Linum usitatissimum,检索参数设置:静态修改:C端羧甲基化(57.021 Da);动态修改:Oxidation(M);前体离子质量差±15×10-6;片段离子质量差±20 mmu;酶切位点数:漏切位点数。
1.4 数据处理
数据均以 ±s(n=3)表示。采用SPSS Statistics软件进行统计分析。多组均数进行相关性分析、方差齐性检验和单因素方差分析和Duncan多重比较,P<0.05,差异显著。
2 结果与分析
2.1 亚麻籽粕蛋白SDS-PAGE分析

图 2 亚麻籽粕蛋白SDS-PAGE图谱Fig. 2 SDS-PAGE analysis of flaxseed meal proteins under reducing and non-reducing conditions
如图2所示,从亚麻籽粕中提取的蛋白与从亚麻籽中提取的蛋白条带数量和分布没有明显差异,说明亚麻籽粕中的蛋白与亚麻籽中的蛋白种类相同。亚麻籽粕蛋白在非还原条件下显示15 个条带,蛋白分子质量分布范围为250~11.9 kDa,且主要集中在50~30 kDa之间。在还原条件下显示6 个条带,蛋白分子质量分布范围49.6~10.9 kDa;与非还原条件下相比,有3 条条带没有发生变化,说明其不是由亚基构成的。非还原条件下,以50 kDa的条带为例,主要由20 kDa和30 kDa的亚基组成。
2.2 亚麻籽粕蛋白的氨基酸组成分析
本实验中亚麻籽粕蛋白占(88.39±0.4)%(n=3),可进一步分析利用。氨基酸组成是蛋白质的一个重要化学特性,决定了蛋白质的营养价值。如表1所示,作为参照,同时列出Karamać等[14]得到的亚麻籽蛋白的氨基酸组成和FAO/WHO(2007)推荐的适于成人的必需氨基酸标准。

表 1 亚麻籽粕蛋白的氨基酸组成(n=3)Table 1 Amino acid composition of flaxseed meal protein (n= 3)
由表1可知,亚麻籽粕蛋白氨基酸种类齐全,和FAO/WHO(2007)推荐的适于成人的必需氨基酸标准相比,富含人体所需的8 种必需氨基酸,能满足成人的需求,是一种优质的植物蛋白。对于成人而言,第1限制性氨基酸为蛋氨酸,蛋氨酸和赖氨酸含量相对较低体现了植物蛋白的一般特征。
在亚麻籽粕蛋白氨基酸组成中,含量相对较高的是谷氨酸、天冬氨酸和精氨酸。另外,疏水性氨基酸占比达33.48%,酸性氨基酸占比32.49%,碱性氨基酸占比15.75%,有研究表明,含疏水性氨基酸及其残基较多的活性肽表现出更强的抗氧化活性[3,28]。因此,该亚麻籽粕蛋白可用来制备抗氧化活性肽。
2.3 亚麻籽粕蛋白不同酶解产物凝胶色谱分析
利用Superdex 200 10/300GL高性能色谱柱分离不同酶解产物,不同分子质量范围的酶解产物可以用百分比表示。根据标准品的相对分子质量的对数与Kav值作曲线,得到标准曲线方程为y=-0.339 6x+2.066 7(R2=0.993 4),说明线性关系良好。

表 2 不同酶解产物的分子质量分布Table 2 Molecular mass distribution of different enzymatic hydrolysates
由表2可知,3 种蛋白酶的酶解效果:碱性蛋白酶>中性蛋白酶>胰蛋白酶,分子质量低于6.5 kDa的碱性蛋白酶酶解产物占比80.72%,而中性蛋白酶酶解产物和胰蛋白酶酶解产物分别占比73.06%和50.78%。另外,三者平均分子质量也有所不同:碱性蛋白酶酶解产物(3.3 kDa)<中性蛋白酶酶解产物(4.3 kDa)<胰蛋白酶酶解产物(6.5 kDa)。
2.4 水解度和酶解产物中多肽含量的测定结果
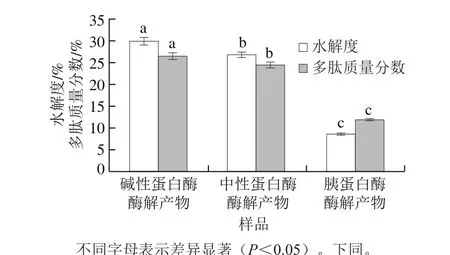
图 3 不同酶解产物水解度及多肽含量(以亚麻籽粕蛋白提取物计算)的比较Fig. 3 Comparison of hydrolysis degree and polypeptide content of different enzymatic hydrolysates flaxseed meal protein extract
如图3所示,3 种蛋白酶的水解度之间存在显著性差异。胰蛋白酶的水解度为8.73%,显著低于其他蛋白酶,这一实验结果与Karamać等[14]早期的研究结果一致。而碱性蛋白酶的水解度达29.95%,与Silva等[29]的研究结果19.3%相比,有效提高了其蛋白水解度,增加了酶解产物中多肽的含量。在本研究中,胰蛋白酶的低水解度和碱性蛋白酶的高水解度可能是由于酶对底物的特异性选择导致的。碱性蛋白酶酶切位点相对比较广泛,可作用于疏水性或芳香族氨基酸的肽键,中性蛋白酶酶切位点主要是疏水性氨基酸[30],而亚麻籽粕蛋白中疏水性氨基酸占比达33.48%,因此两者水解度相对较高;胰蛋白酶主要作用于碱性氨基酸,仅将蛋白水解成较大片段的多肽[30]。经不同蛋白酶酶解后,酶解产物中多肽含量有所不同,且三者之间存在显著性差异。碱性蛋白酶酶解产物多肽含量最高,胰蛋白酶酶解产物多肽含量最低。对水解度和酶解产物中多肽含量进行相关性分析发现:酶解产物中多肽含量与水解度呈正相关(r=0.985)。
2.5 酶解产物抗氧化活性的比较

图 4 同等质量浓度(10 mg/mL)下不同酶解产物的抗氧化活性比较Fig. 4 Comparison of antioxidant activity of different enzymatic hydrolysates at 10 mg/mL
如图4所示,在ABTS阳离子自由基清除实验和FRAP实验中,具有较多高分子质量多肽的胰蛋白酶酶解产物的抗氧化活性显著高于其他酶解产物。而在羟自由基清除实验中,具有较多低分子质量多肽的碱性蛋白酶酶解产物的清除率显著高于胰蛋白酶酶解产物。有研究表明酶解产物的抗氧化活性虽然与分子质量有关,但主要取决于氨基酸组成以及序列结构[3]。
不同抗氧化实验的抗氧化剂作用机制有所不同,本实验中,ABTS阳离子自由基清除实验和FRAP实验结果比较一致,两种方法的抗氧化机理相似,都是通过氢原子转移反应实现的[31]。酶解产物的抗氧化活性由高低分子质量肽联合作用产生[32],部分低分子质量多肽由于包含某些活性氨基酸序列或是具有大量疏水区的蛋白多肽的特定结构,能够提高抗氧化活性[33]。为探究蛋白多肽最具抗氧化活性组分,采用超滤法继续分离胰蛋白酶与碱性蛋白酶酶解产物的高低分子质量组分。
2.6 超滤产物抗氧化活性的比较

图 5 同等质量浓度(10 mg/mL)下不同超滤产物的抗氧化活性比较Fig. 5 Comparison of antioxidant activity of different ultrafiltration fractions at 10 mg/mL
如图5所示,在3 种抗氧化实验中,低分子质量多肽(碱性蛋白酶)组分的抗氧化活性优于其他组分。蛋白多肽的抗氧化活性主要取决于一级结构的氨基酸组成[34],与芳香族或疏水性氨基酸及其残基含量有关[35]。由于碱性蛋白酶的酶切位点主要是羧基侧为芳香族或者疏水性氨基酸的肽键,而胰蛋白酶的酶切位点是羧基侧为碱性氨基酸的肽键[30],亚麻籽粕蛋白中疏水性氨基酸含量高于碱性氨基酸含量,所以通过碱性蛋白酶酶切暴露的疏水性氨基酸残基更多,因此有助于增强多肽的抗氧化活性。可以发现,蛋白酶解的特异性和酶解产物中肽段分子质量的大小共同影响其抗氧化活性的高低。
2.7 凝胶色谱法分离抗氧化活性肽
利用蛋白纯化系统将低于3 kDa多肽(碱性蛋白酶)分成4 个组分F1~F4(图6);由于FRAP法具有高重复性,简单、快速且显示出与还原性物质的最高相关性[36],因此,选择FRAP法测定各组分的抗氧化活性。
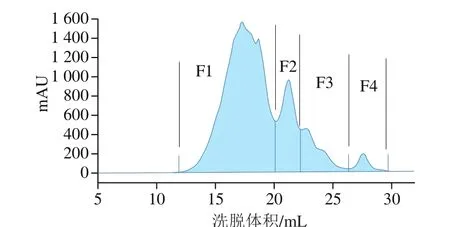
图 6 利用Superdex peptide 10/300GL高性能色谱柱分离碱性蛋白酶(<3 kDa多肽)Fig. 6 Separation of < 3 kDa polypeptides from alkaline protease hydrolysate using Superdex peptide 10/300GL column by high performance chromatography

图 7 不同多肽组分F1~F4肽质量占比及同等质量浓度(0.1 mg/mL)下FRAP的比较Fig. 7 Percentages of peptides F1 through F4 and their total antioxidant capacity at 0.1 mg/mL
如图7所示,在FRAP实验中,组分F2的活性显著高于其他组分,这和组分F2中所含多肽氨基酸侧链基团的提供电子能力强有关。多肽是电子供体,可与自由基反应,将它们转化成更为稳定的物质,从而终止自由基链反应[4]。样品质量浓度为0.1 mg/mL时,组分F2的FRAP为0.29 mmol/L,而同等质量浓度的谷胱甘肽的FRAP为0.31 mmol/L,尽管两者之间存在显著性差异,但在本研究中,占多肽质量20%的组分F2,其FRAP抗氧化活性贡献率占整体组分的45.3%,说明组分F2中含有抗氧化活性很强的多肽。
2.8 抗氧化活性肽的高效液相色谱-串联质谱联用分析
在质谱分析中,精确质量数扫描可确定离子所带电荷数,利用二级质谱图得到的碎片离子可识别肽段的氨基酸序列。通过与数据库比对并结合肽段检测频次,筛选肽段,具体结果见表3。

表 3 通过高效液相色谱-串联质谱联用分析鉴定的抗氧化活性肽组分Table 3 Antioxidant peptide components identified by HPLC-MS/MS analysis
通过对组分F2进行高效液相色谱-串联质谱联用分析,发现有14 个肽段可与数据库中7 种来自亚麻籽的测序蛋白相匹配。有文献表明:大多数食物源抗氧化活性肽的分子质量集中在500~1 800 Da[37];由表3可知,实验结果与该结论相符。据文献报道,具有抗氧化活性的氨基酸有丙氨酸(A)、组氨酸(H)、脯氨酸(P)、色氨酸(W)、酪氨酸(Y)和蛋氨酸(M)[24,38],这些氨基酸及其残基在Fe3+还原能力方面具有重要作用,通过给电子形式将Fe3+还原为Fe2+[39]。鉴定的14 个肽段中,均至少含有一种具有抗氧化活性的氨基酸。另外,有7 个肽段的疏水性氨基酸含量占比达50%以上,同时14 个肽段均含有碱性氨基酸。Silva等[24]发现亚麻籽抗氧化活性肽序列GFPGRLDHWCASE的疏水性氨基酸含量占比46.15%,而本实验酶解获得的肽段VIPTEPPAIH,疏水性氨基酸含量占比高达70%,其中异亮氨酸和脯氨酸占50%。多肽抗氧化活性的高低不仅与疏水性氨基酸及其残基含量有关,也受碱性氨基酸的影响,14 个肽段的N-末端氨基酸残基是疏水性氨基酸的占35.70%,是碱性氨基酸的占42.90%。肽段VIPTEPPAIH的N-末端是组氨酸,结构中含有咪唑环,不仅具有螯合金属离子的能力,还可提供氢原子破坏自由基链反应,同时可作为氢受体,捕捉羟自由基、单质氧和过氧化氢自由基[40],因此具有较强的抗氧化活性。
分析14 个肽段可发现序列中脯氨酸含量占比较高,这也是抗氧化活性较高的原因之一。脯氨酸等疏水性氨基酸可以向缺电子基团提供质子,维持基团稳定性[24]。
3 结 论
利用酶切位点广泛的碱性蛋白酶、中性蛋白酶和高特异性的胰蛋白酶酶解亚麻籽粕蛋白,得到具有较高抗氧化活性的酶解产物。不同酶解产物的水解度与分子质量之间呈正相关。通过比较高分子质量(3~10 kDa)和低分子质量(<3 kDa)的不同蛋白多肽的抗氧化活性,发现低分子质量(<3 kDa)的蛋白多肽(碱性蛋白酶)具有更好的抗氧化活性。通过Superdex peptide 10/300GL高性能色谱柱分离碱性蛋白酶(<3 kDa多肽)得到了一组抗氧化活性较强的组分。利用高效液相色谱-串联质谱联用鉴定了该组分中14 种抗氧化活性肽的序列,有7 个肽段的疏水性氨基酸含量占比达50%以上,具有代表性的序列是VIPTEPPAIH。本实验为亚麻籽粕开发制备高抗氧化活性多肽提供了理论依据。
