HBV介导的肝星状细胞和天然免疫细胞的相互作用
2020-04-24杨苗苗邬志惠涂正坤
杨苗苗, 邬志惠, 涂正坤
吉林大学第一医院 转化医学研究院, 长春 130021
HBV感染是一个关乎全世界人类健康的公共卫生问题。HBV感染肝细胞后不直接造成肝细胞损伤,但诱导肝脏内固有免疫和适应性免疫应答,从而引起肝脏炎症和损伤[1]。持续的HBV感染最终导致各种肝脏疾病,包括肝硬化、肝癌以及肝衰竭[2]。
肝星状细胞(HSC)作为肝纤维化形成的主要效应细胞,占所有肝实质细胞的5%左右[3]。位于肝窦间隙的HSC,与肝细胞及肝脏非实质细胞存在密切关系。在非酒精性脂肪性肝病(NAFLD)的研究[4]中发现,活化的HSC诱导肝脂肪病变并且促进炎性分子的产生。在稳定的生理条件下,HSC通过分泌趋化因子诱导外周单核细胞向肝脏的募集维持肝脏巨噬细胞的水平,同时将单核细胞印上Kupffer细胞的记号,形成肝组织特异性的巨噬细胞[5]。患者肝脏中HSC与自然杀伤细胞(NK细胞)的接触更加频繁,免疫组织化学结果显示HSC周围的NK细胞数量明显增加。因此,探究HBV作用下HSC与肝内细胞之间的相互作用对明确HBV引起的肝脏疾病的发病机制具有重要指导作用。
肝脏内单核/巨噬细胞通过其强大的吞噬能力、细胞表面高密度的模式识别受体以及释放的细胞因子调节肝脏的天然免疫,抵御病原体的侵害维持肝脏环境稳定。在肝损伤后单核/巨噬细胞通过降解细胞外基质和释放抗炎细胞因子缓解炎症和纤维化。随着不断深入的研究发现单核/巨噬细胞的极化和功能可以被病原体以及肝内细胞调节,其中HSC对单核/巨噬细胞的调节至关重要[6]。
NK细胞是机体抵抗病毒感染和肿瘤的主要天然免疫成分[7],在抑制肝纤维化方面发挥着重要作用,主要通过杀伤活化的HSC发挥抗纤维化功能[8]。但是对于病原体及肝内细胞对NK细胞的调节作用研究相对较少。事实证明,HBV感染导致肝内NK细胞的功能障碍,活化的HSC可抑制NK细胞的活力。
本文探讨了HBV诱导免疫应答和肝脏炎症对肝纤维化的作用。在HBV作用的条件下,强调HSC、单核/巨细胞和NK细胞的免疫调节作用,从不同的角度阐述肝内非实质细胞对HBV相关的疾病的影响。
1 HBV诱导的肝脏炎症及其对肝纤维化的影响
1.1 HBV与肝脏炎症 HBV感染后引起的异常的免疫应答导致肝脏炎症的形成,但是,对于HBV感染诱导的肝脏炎症的确切机制尚不完全清楚。大量证据[9]表明,由内源性损伤相关分子模式(damage-associated molecular patterns,DAMPs)触发的HBV非特异性免疫应答是引发肝脏炎症的主要原因。HBV感染后导致天然免疫细胞的浸润和活化,导致凋亡或坏死肝细胞中DAMPs的积累,而DAMPs是最有效的炎症信号。内源性DAMPs被认为具有特定的免疫原性,可以作用于单核/巨噬细胞表面的Toll样受体(TLR)2和TLR4,促进Caspase-1激活释放IL-1β,也可与树突状细胞细胞的TLR9作用募集MyD88,随后激活NF-κB和AP-1,从而传递炎症信号。HBV感染后肝脏中NK细胞的数量增加了近20倍,主要通过产生IFNγ发挥作用,激活NKT细胞导致快速的肝脏炎症反应。HBV感染后导致中性粒细胞的浸润并且通过释放细胞毒素和活性氧(ROS)影响肝脏炎症,肝细胞的坏死也可引起严重的中性粒细胞炎症导致肝损伤加重[10]。
1.2 肝纤维化的启动 关于肝纤维化发病机制的一般理论认为,纤维化是由炎症引起的,慢性炎症激活HSC分化为肌成纤维细胞样细胞,产生细胞外基质,同时天然免疫系统在调节纤维化过程中也起关键作用,但对于HBV相关的肝纤维化机制尚未完全阐明。HBV引起肝脏炎症后,大量的炎性因子刺激免疫细胞表达血小板生长因子、结缔组织生长因子,TGFβ以及IL-13,诱导HSC活化[11]。研究[12]显示,肝损伤后肝细胞通过释放可溶性细胞因子启动HSC的活化,而坏死的肝细胞释放的DAMPs引发的炎症通过直接或间接的方式启动纤维化的发生。早期研究[13]表明HSC能够吞噬肝细胞的凋亡小体,诱导HSC中还原性烟酰胺腺嘌呤二核苷酸磷酸氧化酶的激活,从而激活HSC。因此,HSC的激活离不开肝内细胞及其产生的细胞因子的作用。
2 单核/巨噬细胞与HSC的相互作用
2.1 HBV诱导抑制性单核/巨噬细胞 单核/巨噬细胞是一种异质性的天然免疫细群,主要分为两大类,即“促炎性”的M1和“免疫调节性”的M2样巨噬细胞。M1型细胞的主要功能是清除细菌、抗病毒以及释放炎性细胞因子(TNF、IL-1、IL-12、ROS);M2型细胞促进组织纤维化、组织重塑、创伤愈合及分泌免疫调节介质(IL-10、TGFβ、IL-4)[14]。
临床资料[15]显示,HBV诱导的肝脏疾病与M2样巨噬细胞高水平浸润有关。在慢性HBV感染者体内发现M2样巨噬细胞积累,在急性HBV诱发的肝衰竭患者中,肝脏中M2样巨噬细胞形成加速肝纤维化的发生。笔者在人源化小鼠HBV感染模型中已经证实,HBV诱导的肝脏疾病和肝脏免疫损伤与M2样巨噬细胞的产生有关,HBV诱导M2样巨噬细胞表现为CD14highCD68highCD16lowCD163highCD206highIL-1RAhigh。同时,HBV诱导的M2样巨噬细胞是强效的免疫抑制细胞,表达高水平的IL-10、共抑制分子(B7-H4),下调IL-12、TNFα和共刺激分子(CD86)。进一步的体外实验[16]表明,HBsAg和HBV通过TLR/MyD88/NF-κB信号通路诱导单核细胞程序性死亡受体-配体1(PD-L1)、人类白细胞抗原(HLA)-E及免疫调节因子表达。由此推测,HBV诱导的抑制性单核/巨噬细胞对HBV的持续感染以及肝纤维化的发生可能具有重要作用。
2.2 单核/巨噬细胞激活HSC 单核/巨噬细胞在慢性肝脏疾病的发病机制中起着重要作用,被认为是调节肝纤维化的潜在靶点。体外实验[17]显示,HBV感染期间单核/巨噬细胞产生大量的细胞因子和趋化因子,包括TNFα,IL-1β,TGFβ,单核细胞趋化蛋白1(MCP1)和趋化因子(CCL5)等,而单核/巨噬细胞分泌的CCL5通过NF-κB/ERK信号转导途径可诱导HSC活化,导致HSC炎症分子[NOD样受体蛋白3(NLRP3)、IL-1β、IL-6]和促纤维化基因的表达[18]。此外,HBV感染后优先刺激肝脏巨噬细胞产生促纤维化/抗炎性细胞因子TGFβ,而不是促炎性细胞因子IL-6,IL-1和TNFα[19]。众所周知,TGFβ是激活肝脏HSC最有效的分子,TGFβ通过与HSC表面的TGFβ受体结合,诱导胞质内Smad2/Smad3复合物磷酸化,再与Smad4结合形成核转录调节分子,启动HSC促纤维化基因(α-SMA、Collagen Ⅰ、MMPs、TGFβ)的表达,导致胶原蛋白等细胞外基质向胞外释放引起肝纤维化的发生[17]。
2.3 HSC调节单核/巨噬细胞 HBV诱导单核细胞激活HSC后,活化的HSC反过来调节单核/巨噬细胞的分化及功能。活化的HSC诱导外周单核细胞以及肝内单核细胞分化成为可分泌IL-10和TGFβ的具有免疫调节作用的单核细胞[20]。活化的HSC促进骨髓来源的免疫抑制性细胞(myeloid immunosuppressive cell,MDSC)的积累,尤其是单核来源的MDSC。活化的HSC通过COX2-PGE2-EP4信号传导促进MDSC分化,用COX2抑制剂抑制PEG2的产生可显著减少MDSC的积累,而且活化的HSC诱导的MDSC通过诱导型一氧化氮合酶、精氨酸酶1和IL-4Rα发挥免疫抑制作用[21]。研究[22]报道,活化的HSC通过CD44依赖的方式诱导外周血单核细胞分化为CD14+HLA-DRlowMDSC, MDSC以精氨酸酶依赖性方式抑制T淋巴细胞增殖。除此之外,活化的HSC产生许多可溶性因子,如粒细胞-单核细胞集落生长因子(GM-CSF)、单核细胞集落生长因子(M-CSF)、血管内皮生长因子(VEGF)和C3都参与MDSC分化。
随着研究的不断探索,进一步证实了活化的HSC免疫调节作用,将单核细胞与活化的HSC共培养发现,活化的HSC可以上调单核细胞表面CD15和CCL2受体(CCR2)的表达,其中CCR2与免疫抑制性的M2表型有关[23],上调免疫抑制细胞因子(IL-10、TGFβ1)的表达,下调炎症细胞因子(TNFα、IL-1β)的产生[24]。这些研究结果显示活化的HSC对单核细胞具有重新编程能力。
3 NK细胞与HSC的相互作用
3.1 HBV感染导致NK细胞功能障碍 NK细胞作为肝脏内一类重要的固有免疫细胞,约占肝脏内淋巴细胞的30%[25]。众所周知,外周血中NK细胞主要分为两群,其中超过95%的是CD56dimCD16+NK细胞,其含有大量的细胞毒性颗粒可清除体内感染、衰老以及受损的细胞;而CD56brightCD16-NK细胞仅占5%左右,其细胞毒作用小,主要以分泌细胞因子为主,具有免疫调节功能[26-27]。
临床数据[28]显示,HBV慢性感染者血清中的外泌体内含有HBV核酸和蛋白,NK细胞将含有HBV的外泌体摄入后,导致NK细胞IFNγ的产生、细胞毒作用、细胞增殖和存活等能力下降。与健康对照相比,慢性HBV患者体内的NK细胞数量以及细胞因子的表达显著降低[29]。同时,HBV感染后体内高水平的IL-10是导致NK细胞功能缺陷的主要原因,阻断IL-10或使用抗病毒治疗药物可恢复NK细胞的杀伤活力和IFNγ的产生[30]。HBV相关的免疫微环境抑制了NK细胞表面模式识别受体的表达,导致NF-κB和P38丝裂原活化蛋白激酶途径被抑制,使NK细胞在清除HBV感染的肝细胞过程中出现功能障碍[31]。笔者实验[32]结果证明,HBV调节的单核细胞与NK细胞表达的程序性死亡受体(PD-1)、CD94通过受体-配体结合的方式相互作用,诱导NK细胞表达IL-10产生免疫抑制效应。因此,在HBV感染期间NK细胞呈现功能失活的状态,丧失对病毒感染的肝细胞以及衰老细胞的清除作用,促进了肝脏疾病的发展。
3.2 NK细胞杀伤HSC 自2006年首次提出NK细胞对激活的HSC具有细胞毒作用以来,人们对NK细胞与HSC相互作用的机制进行了广泛的研究[32]。早期HBV感染,NK细胞通过各种不同的作用机制诱导活化的HSC凋亡从而控制纤维化的发生。首先必须明确,HBV不能直接作用于NK细胞诱导细胞的激活,而是在HBV作用的免疫微环境中借助其他细胞因子(IL-18、TNFα)诱导NK细胞的激活。激活的NK细胞通过TRAIL杀伤活化的HSC被认为是NK细胞发挥抗纤维化作用的有效作用机制之一。同时,笔者[33]实验室研究发现IL-18和poly I∶C 协同作用激活NK细胞的P38/PI3K /AKT信号通路,诱导NK细胞IFNγ和TNF相关的凋亡诱导配体的表达增加,活化的NK细胞以TRAIL依赖的脱颗粒方式分泌穿孔素和颗粒酶B靶向杀伤活化的HSC[34]。但是,与早期HBV相关的肝纤维化患者相比,晚期患者NK细胞的激活受体表达、细胞因子和穿孔素的产生发生了明显变化,其中NK细胞的数量、NKp46的表达、穿孔素和IFNγ的产生明显降低,这些结果提示晚期患者肝内NK细胞对活化的HSC杀伤作用降低,抗纤维化功能减弱[35]。
3.3 HSC调节NK细胞功能 迄今为止,对NK细胞的免疫特性以及肝纤维化过程中HSC对NK细胞调节的研究较少,特别是在慢性HBV感染相关的肝纤维化患者中。事实上,慢性肝损伤期间TGFβ通过下调NKG2D(CD314)和2B4(CD244)的表达抑制NK细胞的抗纤维化活性。在晚期肝纤维化中活化的HSC通过上调TGFβ的表达抑制NK细胞的脱颗粒作用以及IFNγ的产生,从而破坏NK细胞对HSC的杀伤作用[36]。HSC活化期间,视黄醇被代谢成维甲酸,维甲酸通过诱导HSC的细胞因子抑制信号1产生,抑制NK细胞的活力和IFNγ的产生[37]。近年来研究[38]发现,活化的HSC以内吞的方式将功能受损的NK细胞吞入细胞内,在HSC细胞内溶酶体及各种水解酶作用下进行消化,减少NK细胞的数量并且阻碍NK细胞的功能。因此,HBV感染期间,活化的HSC通过调节NK细胞的功能促进肝纤维化进展。
4 小结
HBV感染引起肝脏免疫应答是由肝细胞、HSC、单核/巨噬细胞及NK细胞共同参与的反应,它们在肝脏中通过双向调节维持肝脏的免疫稳态,控制纤维化的发生和修复。如图1所示,HBV感染后形成的炎症微环境,不仅引起免疫细胞的激活,而且激活HSC导致肝脏纤维化。NK细胞在肝脏中除了调控HBV感染,也可杀伤活化的HSC控制纤维化的发展。HSC诱导单核细胞分化为具有免疫抑制作用的调节细胞,诱导NK细胞功能障碍。综上所述,HBV感染引起的肝纤维化不是某种细胞单独作用的结果,而是多种细胞共同作用的结果,了解各个细胞之间的相互作用才能更好地预防和治疗肝纤维化。
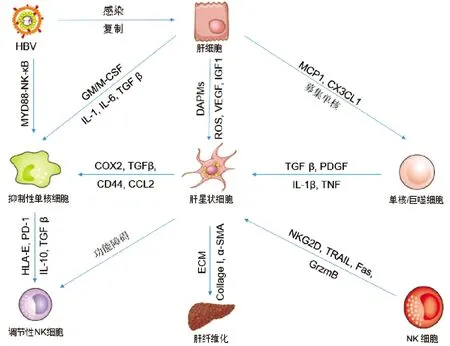
注:ECM,细胞外基质;PDGF,血小板衍生生长因子;COX2,环氧合酶2;GrzmB,颗粒酶B。
图1HBV相关的肝细胞、单核/巨噬细胞、NK细胞和HSC之间的相互作用示意图
