瘦素、IL⁃18、NLRP3与高血压性脑出血严重程度、预后的关系及其在预后评估中的价值
2020-04-18李改胡兵张会敏
李改 胡兵 张会敏
1河南南阳南石医院检验科(河南南阳473000);2新乡医学院(河南新乡453000)
高血压性脑出血(HICH)属于临床危重症,发病率高,占全部脑出血类型的70%左右[1],致死致残率高,预后差,严重威胁人类的生命健康。近年来,临床常采用评分量表预测HICH患者预后,但仍缺乏准确可靠的实验室预测指标。病理生理研究表明[2],HICH发病过程涉及炎症、氧化应激、细胞凋亡等多种机制,其中炎症反应与急性脑损伤及预后关系密切。已有研究证实[3],核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)的激活可介导白介素-18(IL⁃18),从而参与炎症反应,进而损伤脑组织。瘦素是一种分泌型多肽,结构与IL⁃18、IL⁃6等相似,属于细胞因子,在多种炎性疾病中均有重要生物学效应[4]。上述研究均提示瘦素、IL⁃18、NLRP3均参与炎症反应,与脑出血病情严重程度有关,但关于三者在HICH预后评估中应用较少,因此,了解HICH后炎症相关因子瘦素、IL⁃18、NLRP3的表达与疾病严重程度及预后的关系,对指导临床治疗及改善预后有重要意义。
1 资料与方法
1.1 一般资料 采用前瞻性随机对照研究方法,选取2018年1-12月医院收治的132例HICH患者,设为疾病组,其中男79例,女53例;年龄35~79岁,平均(58.50±6.41)岁;高血压病程1~20年,平均(8.50±1.34)年;发病至手术时间1~24 h,平均(15.71±2.14)h;出血部位:皮质33例,基底节69例,丘脑17例,小脑13例;出血量10~85 mL,平均(32.17±5.10)mL;入院高血压分级[5]:Ⅰ级29例,Ⅱ级66例,Ⅲ级37例;入院格拉斯哥昏迷(GCS)评分[6]:13~15分60例,9~12分44例,≤8分28例;临床神经功能缺损程度[7]:轻型62例,中型44例,重型26例;合并糖尿病29例;手术方式:小骨窗开颅术37例,骨瓣开颅血肿清除术65例,脑室外引流术30例;同时选取同时期体检中心收入的50例健康受试者,设为健康组,男30例,女20例;年龄35~75岁,平均(57.83±6.24)岁;疾病组和健康组性别构成比、年龄比较,差异无统计学意义(P>0.05)。纳入标准:(1)疾病组均符合HICH诊断标准[8],且经颅脑影像学证实、首发病例、均接受手术治疗;(2)健康组经体检合格;(3)均签署知情同意书;排除标准:(1)疾病组排除动静脉畸形、颅脑内肿瘤等其他原因引起的出血;(2)疾病组排除脑干出血、双侧脑疝等;(3)均合并机体重要脏器功能严重不全者;(4)健康组排除心血管、内分泌系统疾病或骨关节病者。本次研究获得医院伦理委员会审批。
1.2 方法
1.2.1 瘦素、IL⁃18检测 收集患者入院24 h内及健康受试者空腹静脉血3 mL(不含抗凝剂的真空采血管),静止自然分层后,2 800 r/min离心10 min,收集上层血清,应用瘦素酶联免疫吸附(ELISA)试剂盒、IL⁃18 ELISA试剂盒(上海康朗生物科技有限公司)检测血清瘦素、IL⁃18水平,严格按照试剂盒说明书步骤操作,于酶标仪下测定吸光光度值,并根据标准曲线计算样本浓度。
1.2.2 NLRP3 mRNA表达检测 采用含乙二胺四乙酸(EDTA)的真空采血管,采集疾病组和健康组受试者空腹静脉血5 mL,2 800 r/min离心10 min,收集上层血浆1 mL,加入等体积磷酸盐缓冲液(PBS)混匀,加入2 mL淋巴细胞分离液,2 000 r/min离心20 min,取第二层液体,即为外周血单个核细胞(PBMCs),PBS重悬再次离心2次,取下层沉淀;沉淀采用Trizol法提取总核糖核酸(RNA),逆转录获得互补链脱氧核糖核酸(cDNA),然后应用SYBR Premix Ex TaqTM试剂盒(日本TakaRa公司)进行实时荧光定量聚合酶链反应(RT⁃qPCR),按照试剂盒说明书设定反应体系,以β⁃actin为管家基因,2⁃△△CT为目的基因的相对表达强度,所有实验重复3次取Ct平均值。
1.2.3 预后判定 患者入院后确诊为HICH 6个月后,以复诊或电话方式随访,采用格拉斯哥预后(GOS)评分[9]评估患者预后情况,预后共分5级:5级为恢复良好,有轻度缺陷但可正常生活;4级为轻度残疾,但可独立生活或保护下工作;3级为重度残疾,神志清醒但不能独立生活;2级为植物生存;1级为死亡。1~3级为预后不良,4~5级为预后良好。
1.2.4 临床资料调查及危险因素赋值 根据预后情况将患者分为预后良好组和预后不良组,收集2组临床资料,包括性别、年龄、高血压病程、发病至手术时间、神经功能缺损程度、出血部位、是否破入脑室、出血量、入院高血压分级、GCS评分、是否合并糖尿病、手术方式及外周血瘦素、IL⁃18、NLRP3 mRNA相对表达量。将上述可能导致预后不良的因素进行赋值,并以之为自变量,以预后是否不良(否=0、是=1)为因变量进行Logistic回归分析(表1)。
1.3 统计学方法 SPSS 24.0处理数据,计量资料均用表示,两两样本比较采用独立样本t检验;多样本计量资料比较用单因素方差分析,进一步两两比较采用SNK⁃q检验;计数资料用[例(%)]表示并用检验,等级计数资料用秩和检验;应用Logistic回归分析法分析导致预后不良危险因素的比值比(odds ratio,OR)及95%置信区间(confidence interval,CI)。P<0.05为差异有统计学意义。
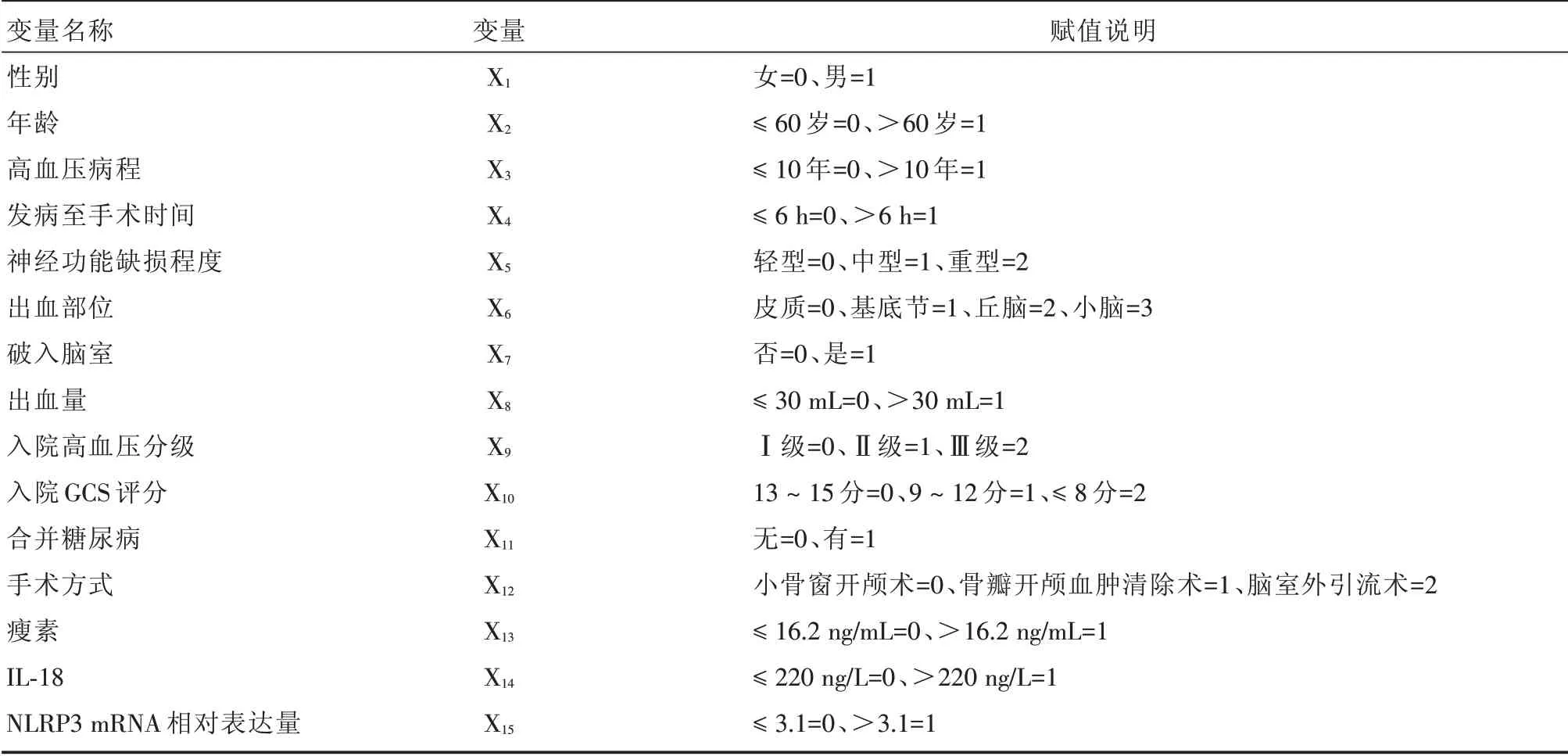
表1 Logistic回归分析赋值Tab.1 Logistic regression analysis assignments
2 结果
2.1 健康组和不同严重程度患者瘦素、IL⁃18、NLRP3对比 健康组、不同严重程度疾病组外周血瘦素、IL⁃18、NLRP3比较,差异均有统计学意义(P<0.05);不同严重程度疾病组外周血瘦素、IL⁃18、NLRP3均高于健康组,差异均有统计学意义(P<0.05),且重型组大于轻型和中型组,中型组大于轻型组,差异均有统计学意义(P<0.05,表2)。2.2 预后良好组和预后不良组瘦素、IL⁃18、NL⁃RP3对比 预后良好率为68.18%(90/132);预后不良组瘦素、IL⁃18、NLRP3均高于预后良好组,差异均有统计学意义(P<0.05,表3)。
2.3 预后良好组和预后不良组可能影响因素的差异对比 预后不良组性别、高血压病程、发病至手术时间、出血部位、入院高血压分级、合并糖尿病、不同手术方式患者构成比比较,差异均无统计学意义(P>0.05);预后不良组年龄>60岁、重型神经功能缺损、破入脑室、出血量>30 mL、入院GCS评分≤8分患者构成比均高于预后良好组,差异均有统计学意义(P<0.05,表4)。
2.4 Logistic回归分析法分析导致预后不良的危险因素 经Logistic回归分析,年龄>60岁、破入脑室、出血量>30 mL、瘦素>16.2 ng/mL、IL⁃18>220 ng/L、NLRP3 mRNA相对表达量>3.1、重型神经功能缺损、入院GCS评分≤8分均是导致预后不良的危险因素(P<0.05,表5)。
表2 健康组和不同严重程度患者瘦素、IL⁃18、NLRP3对比Tab.2 Comparison of leptin,IL⁃18,NLRP3 in healthy groups and patients with different severity ±s
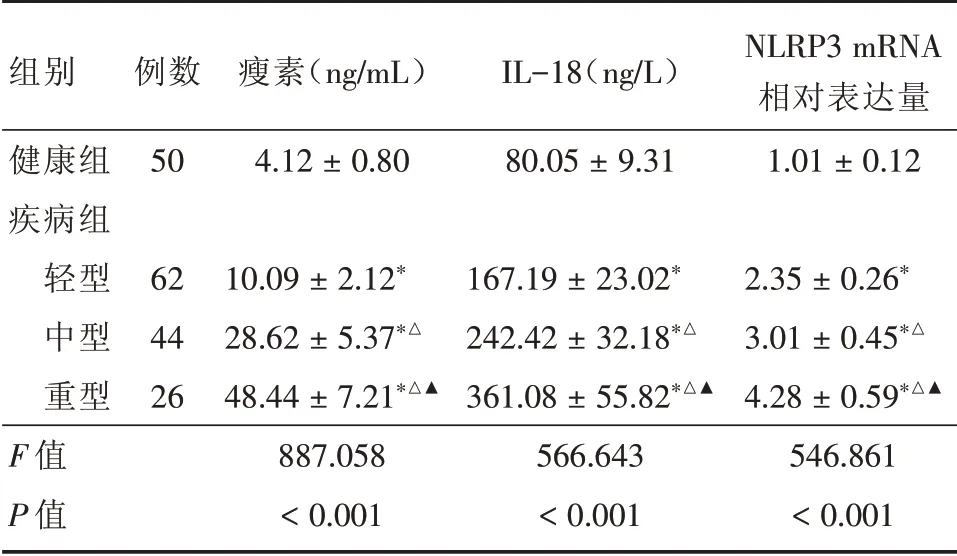
表2 健康组和不同严重程度患者瘦素、IL⁃18、NLRP3对比Tab.2 Comparison of leptin,IL⁃18,NLRP3 in healthy groups and patients with different severity ±s
注:与健康组比,*P<0.05;与轻型比,△P<0.05;与中型比,▲P<0.05
组别健康组疾病组轻型中型重型F值P值例数50 62 44 26瘦素(ng/mL)4.12±0.80 10.09±2.12*28.62±5.37*△48.44±7.21*△▲887.058<0.001 IL-18(ng/L)80.05±9.31 167.19±23.02*242.42±32.18*△361.08±55.82*△▲566.643<0.001 NLRP3 mRNA相对表达量1.01±0.12 2.35±0.26*3.01±0.45*△4.28±0.59*△▲546.861<0.001
表3 不同严重程度患者瘦素、IL⁃18、NLRP3对比Tab.3 Comparison of leptin,IL⁃18,NLRP3 in patients with different severity ±s
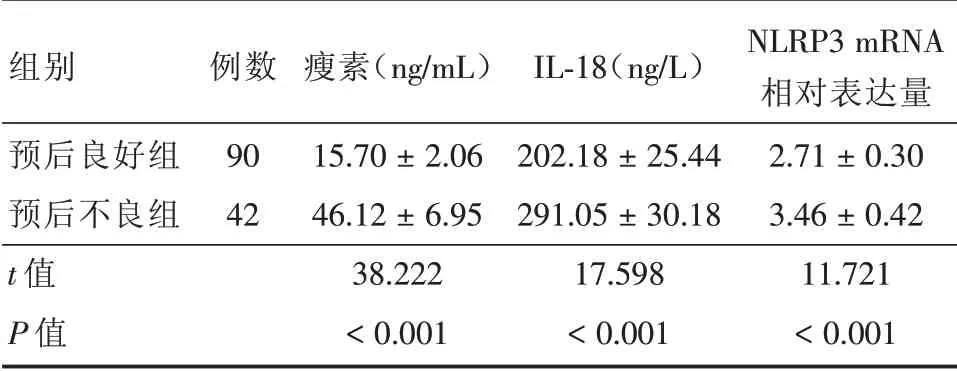
表3 不同严重程度患者瘦素、IL⁃18、NLRP3对比Tab.3 Comparison of leptin,IL⁃18,NLRP3 in patients with different severity ±s
组别预后良好组预后不良组t值P值例数90 42瘦素(ng/mL)15.70±2.06 46.12±6.95 38.222<0.001 IL⁃18(ng/L)202.18±25.44 291.05±30.18 17.598<0.001 NLRP3 mRNA相对表达量2.71±0.30 3.46±0.42 11.721<0.001
2.5 瘦素、IL⁃18、NLRP3对预后不良的预测效果分析 ROC结果显示,瘦素、IL⁃18、NLRP3对预后不良预测最佳截断点分别为41.7、265.4 ng/L、3.3,AUC分别为0.755、0.801、0.852(表6、图1)。
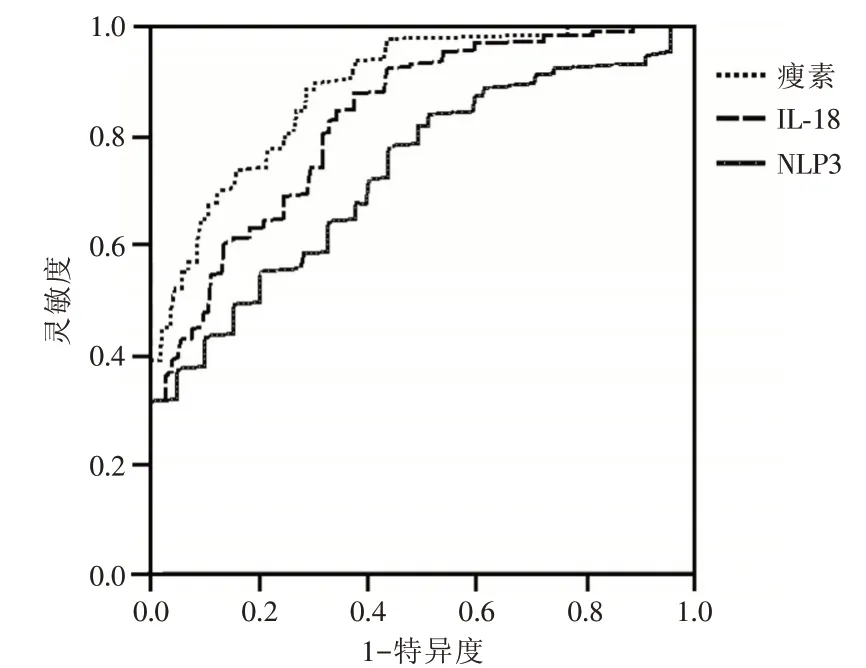
图1 瘦素、IL⁃18、NLRP3预测预后不良ROC曲线Fig.1 ROC curves of poor prognosis predicted by leptin,IL⁃18,and NLRP3
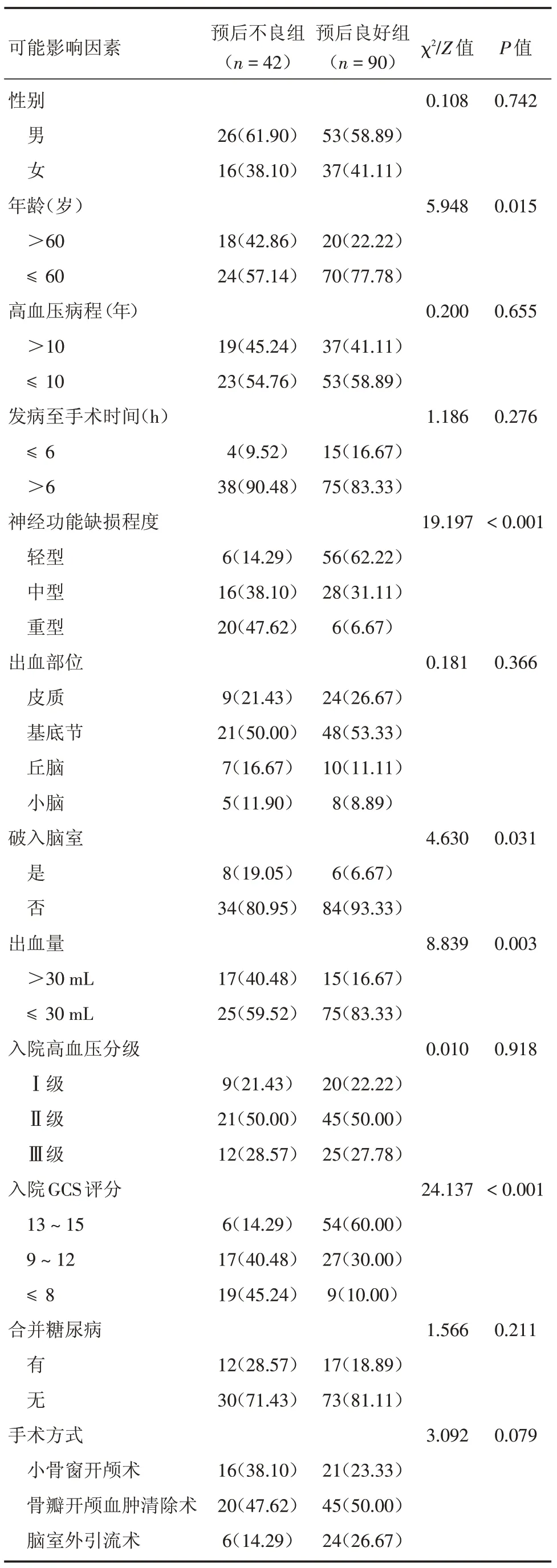
表4 预后良好组和预后不良组可能影响因素的差异对比Tab.4 Comparison of possible influencing factors between good prognosis group and poor prognosis group 例(%)
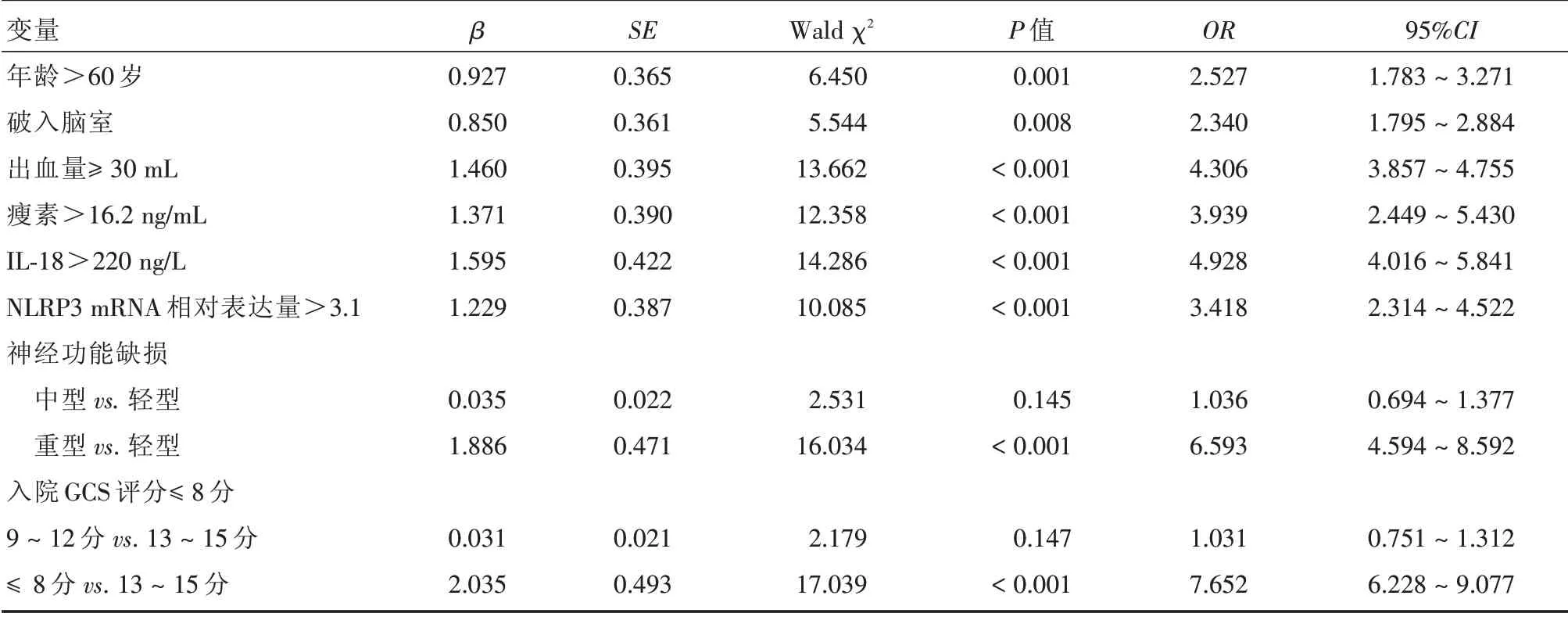
表5 Logistic回归分析法分析导致预后不良的危险因素Tab.5 Analysis of risk factors leading to poor prognosis by Logistic regression analysis
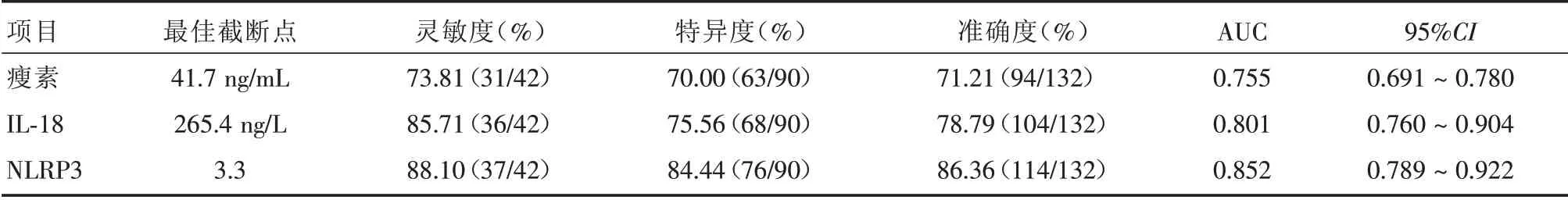
表6 瘦素、IL⁃18、NLRP3对预后不良的预测效果分析Tab.6 Prediction effect analysis of leptin,IL⁃18,NLRP3 on poor prognosis
3 讨论
HICH是由高血压引发的源于脑实质的颅内出血,具有起病急、病情复杂、进展迅速等特点,在给予及时有效的治疗措施的同时,寻找可靠的实验室指标对预后做出客观和准确的评估,对患者治疗策略的调整有重要意义。高血压和脑动脉粥样硬化是导致HICH首要原因[10-11],血压骤升导致脑动脉破裂,随之血肿形成及血肿占位效应可直接和继发性损伤脑组织,一方面,脑出血后补体、凝血酶等血肿成分直接损伤脑细胞;另一方面血肿占位效应可激活周围血管系统的防御反应及全身系统炎症反应,以及时清除细胞碎片及凋亡细胞。继发性脑损伤是影响HICH预后的关键,而炎症反应是继发损伤的重要部分[12-13]。因此,本研究对既往收治的HICH患者的临床资料进行回顾,通过分析瘦素、IL⁃18、NLRP3在外周血中的表达情况,重点分析其与预后的关系,探讨其在HICH预后评估中的价值。
本研究发现,不同严重程度疾病组外周血瘦素、IL⁃18、NLRP3均高于健康组,且重型组大于轻型和中型组,中型组大于轻型组,提示外周血瘦素、IL⁃18、NLRP3与HICH患者病情严重程度关系密切。瘦素主要由脂肪细胞分泌,研究表明,中枢系统中广泛存在瘦素受体,HICH后机体处于应激状态,脂肪细胞大量合成和释放,导致外周血中瘦素水平升高,瘦素可通过血脑屏障与瘦素受体结合,通过下丘脑-神经肽通过参与病情进展[14]。另有研究证实[15],瘦素是导致HICH发病的危险因素,主要通过激活交感神经系统、促进脂肪细胞血管紧张素原表达、与血管内皮细胞中瘦素受体结合改变血管张力等途径引起血压升高,参与HICH发生、发展。本研究中HICH患者外周血瘦素水平随病情严重程度加重而升高,提示瘦素水平与HICH病情严重程度有关。NLRP3是广泛分布于细胞质中的感受器蛋白,当识别危险信号时,其蛋白结构改变,与衔接蛋白(ASC)、效应蛋白半胱氨酸天冬氨酸酶1前体(Pro⁃caspase1)组成蛋白复合物,即炎症小体,激活的炎症小体通过促进IL⁃18合成和分泌,诱导细胞程序性死亡[16-17]。高血压和脑动脉粥样硬化导致的脑出血发生后,NLRP3炎症小体激活,内皮细胞、脑胶质细胞合成和分泌大量IL⁃18,IL⁃18可破坏血脑屏障进入外周血,加速细胞程序性死亡过程,病情加重。
此外,本研究中,预后不良组年龄>60岁、重型神经功能缺损、破入脑室、出血量>30 mL、入院GCS评分≤8分患者构成比、瘦素、IL⁃18、NLRP3均高于预后良好组,且经Logistic回归分析证实均是导致预后不良的危险因素,提示瘦素、IL⁃18、NL⁃RP3是HICH预后不良的危险因素。瘦素最初常作为调节能量消耗的激素,与肥胖关系密切[18-19],随着研究的深入,发现瘦素参与多系统功能调节。BOUZIANA等研究发现[20],脑卒中患者外周血瘦素水平异常较高,且与病灶大小、GCS评分关系密切,本研究采用回归分析证实瘦素是HICH预后不良的危险因素,应用ROC曲线判定预后不良瘦素最佳截断点为41.7 ng/mL,并在预测6个月预后时呈现出较高的灵敏度和特异度,提示瘦素在HICH预后评估中较高的应用价值。HICH后继发性神经炎症反应可导致脑细胞损伤,增加脑水肿等并发症发生风险。研究表明[21],HICH后早期脑血肿周围组织内NLRP3信号通路处于激活状态,促进其下游IL⁃18的合成和释放,且通过参与补体诱导的神经炎症反应,加重脑损伤,增加迟发性脑损伤风险,不利于预后神经功能恢复。本研究ROC曲线辨别外周血IL⁃18、NLRP3最佳截断点分别为265.4 ng/L、3.3,HICH预后不良AUC分别为0.801、0.852,说明IL⁃18、NLRP3在HICH预后评估中有重要应用价值,可作为HICH预后评价的实验室指标。
综上所述,外周血瘦素、IL⁃18、NLRP3与HICH患者病情严重程度有关,有助于早期判断HICH患者的预后,在预后评估中有重要应用价值,提示临床中应加强HICH患者外周血瘦素、IL⁃18、NLRP3水平的检测,并及时实施有效治疗策略,以期最大限度改善患者预后。本研究不足之处在于纳入样本量较少,且由于研究成本的局限性,仅开展了单中心研究,在进一步的研究中应扩大样本量并开展多中心、前瞻性研究,为本研究结论提供更充分的数据支持。
