龙胆苦苷对糖尿病周围神经痛大鼠神经保护作用
2020-04-18鲁义姚嘉茵王保陈陈燕劳俊铭刘栋尧新华
鲁义 姚嘉茵 王保 陈陈燕 劳俊铭 刘栋 尧新华
1广州市中医医院麻醉科(广州510130);2中山大学附属第六医院(广州510126)
糖尿病周围神经痛(diabetic peripheral neurop⁃athy,DPN)以疼痛、感觉障碍、感觉丧失为特征,是糖尿病患者最为常见的并发症[1-2]。其发病机制未完全明确,治疗手段有限,是目前麻醉镇痛领域中极具挑战的研究[3-4]。龙胆苦苷是从中草药龙胆草中分离得到的一种环烯醚类化合物。近年来国内外研究发现,龙胆苦苷(gentiopicroside,Gent)对中枢系统有一定的镇痛作用,但机制不明确[5]。作者前期研究已成功通过四氧嘧啶链脲佐菌素(STZ)构建糖尿病神经痛大鼠动物模型[6-8],并且证实龙胆苦苷对DPN大鼠模型有确证的镇痛作用。然而,其镇痛的机制尚不明确。神经传导以及运动功能的有效实现依赖神经血流供应,糖尿病患者通常合并血脂代谢紊乱,血脂沉积在血管壁导致管腔狭窄,影响外周神经血供,从而影响神经功能。这是目前广泛认可的血脂代谢在DPN致病中的作用,而PPAR⁃γ/AMPK/ACC是体内血脂代谢的重要信号通路。龙胆苦苷保护周围神经的作用是否通过调节此通路影响血脂代谢而实现,这个问题亟需解答。因此,本研究将延续STZ诱导的DPN大鼠动物模型,以血脂代谢紊乱、神经传导功能为切入点,探索营养神经血流以及其相关的PPAR⁃γ/AMPK/ACC信号通路的内在联系,从而探讨龙胆苦苷治疗DPN的可能分子机制,为有效防治DPN提供新的理论和药物新靶点。
1 材料与方法
1.1 实验动物及分组 SPF级雄性SD大鼠共45只(根据成组设计定量资料的样本含量计算公式,计算出每实验组需要大鼠15只),体质量180~220 g,称重量后进行编号,随机均分为3组,实验分组如下:空白对照组(15只);STZ诱导的DPN模型组(15只);龙胆苦苷治疗组(20 mg/kg·d Gent灌胃+STZ)(15只)。
1.2 实验准备 采用链脲佐菌素(streptozotocin,STZ;Sigma,St.Louis,MO,USA)法构建DPN大鼠模型,禁食不禁水24 h,禁食12 h后按55 mg/kg腹腔注射STZ溶液。腹腔注射48 h后用血糖分析仪(北京中生生物)测定大鼠尾静脉血糖>16.7 mmol/L的大鼠成为DPN大鼠模型,共得到30只DPN大鼠,全部大鼠造模成功。龙胆苦苷治疗组在造模成功后给予龙胆苦苷20 mg/(kg·d)灌胃,大鼠剂量计算公式=(X mg/kg×70 kg×0.018)/0.2 kg=6.3 X mg/kg。X代表人体有效药物剂量,70 kg是人的标准体质量,0.2 kg是大鼠的标准体质量,0.018是大鼠与人根据体表面积比的换算系数[9]。空白对照组则腹腔注射相同体积柠檬酸/柠檬酸钠缓冲液,共得到15只。空白对照组以及DPN模型组大鼠均使用相同体积的生理盐水灌胃处理。
1.3 检测指标及方法
1.3.1 行为学分析 在造模后第1、7、14天,观察3组大鼠有无自发性疼痛行为。内容包括歩态、抬脚、舔脚、腿着地性或抗重力行为、自残等。
1.3.2 刺激试验(1)热辐射刺激。采用HARG⁃REAVES等[10]所描述的方法,在造模成功后第1、7、14天每组大鼠均接受热辐射热刺激试验3次,间隔5 min,持续30 s。观察并记录大鼠后肢抬脚的潜伏期。(2)冷板试验。在造模成功后第1、7、14天进行冷板试验。使用JASMIN等[11]所描述的方法。冷板(PanlabHavard LE⁃7420,Spain)温度为4℃。观察并记录大鼠足趾缩腿反应潜伏期,同时记录5 min内总缩腿次数。(3)触觉过敏试验。在造模成功后第1、7、14天进行触觉过敏试验。将大鼠放置于铁网上,下方使用Semmes⁃Weinstein Monofilaments A 835仪器(Sammons Preston,USA)代表不同压力的Von Frey针刺激足底,使用DETLOFF等[12]所改良的上下调整法,记录最小能诱发其缩腿的阈值。
1.3.3 激光多普勒血流仪检测下肢血流 在造模后第14天采用多普勒激光测速仪(Perimed 5000,Sweden)检测下肢血流。大鼠腹腔麻醉后,下肢剔毛,取其足踝内侧上方2 cm处,测定血液灌注量(Perfusion,PU),每次连续测定5 min,得出PU平均值。
1.3.4 采集坐骨神经传导速度 在使用激光多普勒血流仪检测完下肢血流后直接手术分离坐骨神经。采用生物信号采集系统(Medlab⁃U/4C,USA)测定运动及感觉神经传导速度。刺激点定位在坐骨结下0.5 cm,刺激强度从弱开始,缓慢增强到强刺激。计算复合动作电位出现的潜伏期与传导距离的比值来表示神经传导速度。
1.3.5 采用RT⁃PCR检测PPAR⁃γ/AMPK/ACC信号通路各因子定位表达 完成以上实验后,小心完整取出大鼠腰膨大组织,采用RT⁃PCR检测各组大鼠腰膨大脊髓组织各因子表达的变化。采用Gel⁃Pro Analyzer 4.0软件(Media Cybernetics,USA)根据电泳条带的面积和亮度计算出每个条带的积分光比值,该比值表示该细胞因子mRNA的相对表达水平。
1.4 统计学方法 数据采用SPSS 13.0软件进行统计学分析,计量资料以均数±标准差表示,组间差异采用t检验分析,计数资料采用率表示,χ2检验分析组间差异。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学分析以及刺激试验 造模后每天观察各组大鼠行为学变化。在造模后第7天开始,DPN模型组大鼠比空白对照组和龙胆苦苷治疗组大鼠显得最为烦躁不安,少动,到第14天这种组间大鼠行为学差异尤为明显。本研究进一步在造模后第7、14天采用刺激试验量化各组大鼠的冷刺激、热刺激以及机械刺激的疼痛阈值。结果提示,与对空白对照组相比较,DPN模型组以及龙胆苦苷治疗组大鼠的冷刺激、热刺激以及机械刺激的疼痛阈值明显下降(P<0.05);龙胆苦苷药物干预后,各刺激试验的疼痛阈值较DPN模型组升高,结果说明DPN大鼠存在痛觉过敏,而龙胆苦苷有效缓解疼痛,提高疼痛耐受阈值(图1)。
2.2 各组大鼠血脂水平比较 DPN模型组大鼠总甘油三酯(TG)、总胆固醇(TC)以及低密度脂蛋白(LDL)较空白对照组大鼠显著升高(P<0.05);低密度脂蛋白(HDL)较空白对照组下降(P<0.05)。结果提示DPN大鼠存在血脂代谢紊乱。龙胆苦苷干预后,有效下调TG、TC及LDL,上调HDL的水平(P<0.05)。龙胆苦苷有效纠正DPN大鼠的血脂代谢紊乱。见图1。

图1 各组大鼠血脂水平以及刺激试验比较Fig.1 Blood fat level and stimulation tests in each group
2.3 各组大鼠下肢胫前动脉神经血流速度比较采用多普勒彩超评估营养神经的血流速度,结果提示,DPN模型组大鼠神经血流速度显著下降,龙胆苦苷治疗后神经血流速度较DPN模型组升高(表1)。大鼠神经传导速度与营养神经的血流速度有显著正相关性,龙胆苦苷有效增加神经血流速度,营养神经,从而改善神经传导功能。
2.4 各组大鼠干预后坐骨神经运动与感觉传导速度的比较 通过检测运动以及感觉神经传导速度,可以反应神经传递功能变化。结果显示,DPN模型组大鼠不管感觉还是运动神经的传导速度均较对照组明显下降,存在神经功能损伤。龙胆苦苷干预后,感觉及运动神经的传导速度较DPN模型组增加(P<0.05),但仍低于空白对照组(P<0.05,表1)。结果说明,龙胆苦苷一定程度上改善神经功能,但未能完全逆转糖尿病周围神经病变导致的神经损伤。
表1 各组大鼠神经血流速度、运动和感觉神经传导速度的比较Tab.1 Blood flow velocity,motor and sensory nerve conduction velocity in each group ±s
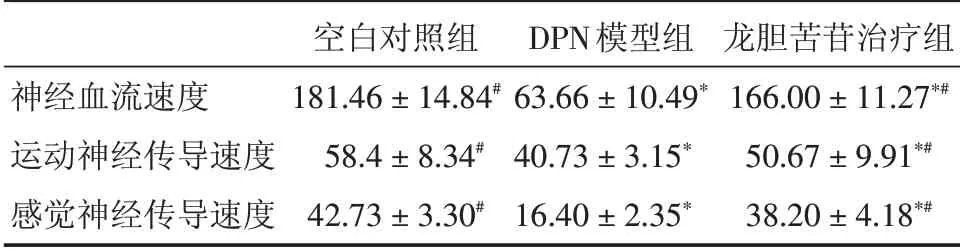
表1 各组大鼠神经血流速度、运动和感觉神经传导速度的比较Tab.1 Blood flow velocity,motor and sensory nerve conduction velocity in each group ±s
注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05
神经血流速度运动神经传导速度感觉神经传导速度空白对照组181.46±14.84#58.4±8.34#42.73±3.30#DPN模型组63.66±10.49*40.73±3.15*16.40±2.35*龙胆苦苷治疗组166.00±11.27*#50.67±9.91*#38.20±4.18*#
2.5 各组大鼠腰膨大脊髓组织PPAR⁃γ/AMPK/ACC各因子表达的变化 采用RT⁃PCR检测大鼠脊髓组织PPAR⁃γ/AMPK/ACC各因子基因表达量的变化。结果显示,DPN模型组大鼠PPAR⁃γ与AMPK表达量较对照组下降,而ACC表达量较对照组升高(P<0.05)。龙胆苦苷治疗组大鼠PPAR⁃γ与AMPK表达量较DPN模型组升高,而ACC表达量较DPN模型组下降。其中,龙胆苦苷组大鼠ACC表达量高于对照组,差异有统计学意义(P<0.05,图2)。

图2 各组大鼠腰膨大脊髓组织PPAR⁃γ/AMPK/ACC各因子表达的变化Fig.2 Expression of genes in PPAR⁃γ/AMPK/ACC signaling pathway in each group
3 讨论
DPN对于患病时间较长的糖尿病患者而言,是最为常见并发症[13]。根据KISOZI等[14]报道,50%以上的糖尿病患者会出现周围神经病变,主要表现为下肢疼痛、肢端麻木,极大地影响糖尿病患者的生存质量,部分患者因为长期慢性疼痛的刺激与困扰甚至会出现失眠、抑郁,耗费大量的医疗与社会资源。因此,预防以及治疗DPN是麻醉镇痛领域中的新挑战。
目前DPN的发病机制尚不明确,慢性高血糖、继发血脂代谢紊乱以及由此导致的无菌性慢性炎症导致外周神经的功能障碍是DPN致病的重要因素[15]。近年来,国内外研究的热点更为关注神经损伤本身[16-17]。外周神经的两大功能包括感觉传导以及运动传导功能的正常运作是基于神经结构以及血流供应正常的情况下实现的。但长期高血糖、血脂紊乱导致营养神经的血管管腔脂质沉积,管腔变窄,神经血流速度变慢,从而影响神经的血供,导致神经功能障碍[18-20]。本研究从最新的血脂代谢紊乱、神经血供角度,探索DPN的致病机制。结果提示,DPN模型大鼠的确存在显著的血脂代谢紊乱以及神经功能异常,表现为感觉传导速度以及运动传导速度显著下降,与行为学和刺激实验的结果相符合。笔者进一步通过多普勒彩超监测神经血流速度,结果显示DPN模型大鼠下肢胫前动脉神经血流速度下降,与神经功能障碍成显著相关性,从而验证了神经血流速度与神经功能的关系,与国外研究结果一致。
DPN的有效治疗药物非常有限。临床常用的药物包括抗抑郁药、抗惊厥药、抗痉挛药,但上述药物都具有一定的毒副作用,而且缓解疼痛的效果欠佳,限制了其在临床的广泛应用。由于缺乏有效的药物,大约有50%~60%的患者最终被迫选择了神经离断术以缓解疼痛。近年来,随着祖国医学的进一步发展,中医中药在治疗疼痛痹症上取得明显突破[21]。基于“消渴痹证”、“血痹”、“厥证”等理念,中医在治疗DPN上多以活血化瘀、健脾补肾、益气养阴等治疗手段。龙胆苦苷是龙胆泻肝汤的主要活性成分,而且其化学结构已经明确。本镇痛研究中心既往研究数据显示,龙胆苦苷对DPN患者有治疗作用。本文进一步采用龙胆苦苷干预DPN大鼠模型,结果发现,龙胆苦苷有效改善DPN大鼠外周神经的运动以及感觉传导功能,增加冷热刺激以及机械刺激的疼痛阈值,有效发挥镇痛作用。
然而龙胆苦苷的治疗DPN的分子机制仍未明确,本文结果提示龙胆苦苷治疗组大鼠的外周神经血流速度较DPN模型组增加,通过改善神经血供实现神经保护作用可能是龙胆苦苷的治疗机制。既然血脂代谢紊乱导致血管脂质沉积会直接影响血管管腔直径,乃至血流速度的变化,本研究进一步从血脂代谢的分子机制探索龙胆苦苷的神经保护作用。PPAR⁃γ/AMPK/ACC信号通路是比较成熟的血脂代谢通路。PPAR⁃γ通过促进AMPK,抑制ACC共同调节血脂代谢平衡。已有研究报道,糖尿病患者存在胰岛素抵抗,PPAR⁃γ表达量显著下降,使用罗格列酮,PPAR⁃γ的激动剂可以有效改善胰岛素抵抗,同时改善血脂紊乱[22]。本研究结果表明,龙胆苦苷药物干预可以促进腰膨大脊髓组织中PPAR⁃γ以及下游AMPK的基因表达,抑制ACC的基因表达,起到与罗格列酮相类似的作用。因此,龙胆苦苷对DPN大鼠的神经保护作用可能是通过PPAR⁃γ/AMPK/ACC信号通路介导。
本研究存在一定的局限性,对于PPAR⁃γ/AMPK/ACC信号通路的研究仅局限在基因水平。因此,未来将进一步深入研究,完善信号通路蛋白水平的检测,开展离体细胞实验,通过添加PPAR⁃γ、AMPK、ACC各自的激动剂与抑制剂深入探索信号通路的内在关系。本研究结果表明龙胆苦苷可有效治疗DPN大鼠模型,其神经保护机制可能是通过调节PPAR⁃γ/AMPK/ACC信号通路,维持血脂代谢平衡,增加营养神经血流而实现的。
