IL⁃18通过调控PI3K/AKT与NF⁃κb信号通路激活肿瘤免疫抑制结肠癌的机制
2020-04-18刘立盖金娜尹作文陈琴华
刘立 盖金娜 尹作文 陈琴华
1华中科技大学协和深圳医院(广东深圳518000);2湖北医药学院附属东风医院实验中心(湖北十堰442000)
结肠癌(colon cancer)是最常见的恶性肿瘤之一,在世界范围内造成严重的人口和经济负担[1-2]。近年来,随着癌症筛查和癌前腺瘤切除手术的改善,全球结肠癌的发病率和病死率水平基本稳定,但结肠癌占全球恶性肿瘤发病、死亡的比例均有所增加[3-5]。免疫治疗已成为近些年肿瘤研究的热点[6-8],为结肠癌的临床治疗提供了新的希望[9-10]。但目前尚无十分有效的治疗靶点和治疗策略。因此,进一步了解结肠癌的免疫学分子机制,有助于寻找更加有效的新的免疫治疗靶点。
白细胞介素-18(IL⁃18)的结构与IL⁃1β相似,可由活化的免疫细胞、树突状细胞、单核细胞和巨噬细胞、T和B淋巴细胞、自然杀伤(natural killer,NK)细胞和中性粒细胞产生[11]。报道指出,IL⁃18与IL⁃12联合应用可激活细胞毒性T细胞(cytotoxic T cells,CTLs)和NK细胞[12]。IL⁃18也可调节Th2和Th17细胞反应,以及CD8细胞毒细胞和中性粒细胞的活性[13]。此外,肿瘤来源的IL⁃18可诱导NK细胞产生PD⁃1,与三阴性乳腺癌患者的预后呈负相关[14-15]。而关于IL⁃18在结肠癌中的作用与机制尚无报道。本次研究发现结肠癌患者血清及肿瘤组织中IL⁃18的水平均显著增高。此外,IL⁃18能激活PI3K/AKT与NF⁃κB信号通路并影响结肠癌的免疫水平。IL⁃18可能通过调控PI3K/AKT与NF⁃κB信号通路激活肿瘤免疫从而发挥抑制结肠癌的作用。
1 资料与方法
1.1 一般资料 本次研究共纳入华中科技大学协和深圳医院胃肠外科于2018年3月至2019年5月收治的96例结肠癌患者作为研究对象进行回顾性研究;患者的平均年龄为(58.2±14.4)岁,介于41~80岁;所有患者中男56例,女40例。所有纳入本次研究的患者均为首次被诊断为结肠癌,所有患者均经病理学或影像学(或内镜)确诊。排除标准:复发性结肠癌;有放化疗史;并发其他恶性肿瘤;近期服用影响机体免疫药物;伴有全身感染性疾病;临床资料不全;伴有严重脏器功能障碍;妊娠期或哺乳期女性。另选取同期在我院进行体检的健康者30例作为对照组;平均年龄(57.8±15.1)岁,介于35~66岁;男18例,女12例。所有纳入者均签署知情同意书,均知晓本次研究的目的与方法,研究获得医院伦理委员会批准。
1.2 材料与设备 本次研究的主要试剂包括人结肠癌细胞株HT29和小鼠结肠癌细胞株CT26(武汉大学细胞库)。DMEM培养基(美国Gibco公司)、胎牛血清(FBS)(美国Hyclone公司)。青霉素、链霉素(美国Hyclone公司)。人IL⁃18 ELISA试剂盒(武汉华美)。重组人IL⁃18蛋白(上海美迪西生物)。Lipofectamine®2000转染试剂(美国Thermo Fisher公司)。SDS⁃PAGE试剂(上海生工)。IL⁃18、p⁃ERK1/2抗体(美国Santa Cruz公司);p⁃β⁃catenin抗体(美国Santa Cruz公司);p⁃PI3K、p⁃AKT、p⁃NF⁃κB(美国CST公司);β⁃catenin、PI3K、NF⁃κB抗体(美国Abcam公司);ERK1/2、AKT、β⁃actin抗体(武汉三鹰)。流式抗体如下:FITC⁃CD4抗体、APC⁃CD8抗体、FITC⁃CD56抗体、PE⁃CD16抗体(美国BioLegend公司)。pLVX⁃Tight⁃Puro质粒(美国Invitrogen公司)。Taq酶(武汉擎科生物)。内切酶BamH I与EcoR I(美国Thermo Fisher公司)。T4 DNA连接酶(日本TaKaRa公司)。C57小鼠购自武汉大学实验动物中心。主要设备有生物安全柜、CO2培养箱、垂直电泳仪、化学发光成像系统、流式细胞仪、Tecan酶标仪等。
1.3 酶联免疫检测 分别抽取结肠癌患者和健康者的空腹静脉血5 mL,置于促凝管中,自然凝固,1 000×g离心15 min,取上清储存于-80℃备用。使用商业化的IL⁃18 ELISA试剂盒检测血清的IL⁃18水平,检测过程严格按照产品说明书进行。用Tecan酶标仪测量450 nm处的OD值。
1.4 Western Blot检测 患者肿瘤组织、癌旁正常组织或小鼠肿瘤组织经碾磨、裂解、超声后离心取上清。贴壁细胞用RIPA裂解液进行裂解,超声后离心取上清。用BCA试剂盒(上海生工)测蛋白浓度。SDS⁃PAGE电泳用5%的浓缩胶与12%的分离胶进行。电泳后将蛋白转至PVDF膜,用5%BSA封闭。分别加IL⁃18、β⁃catenin、PI3K、NF⁃κB抗体(1∶2 000);ERK1/2、AKT抗体(1∶3 000);p⁃ERK1/2、p⁃β⁃catenin、p⁃PI3K、p⁃AKT、p⁃NF⁃κB抗体(1∶1 000);β⁃actin抗体(1∶5 000)4℃孵育过夜。洗涤,二抗(美国Abcam公司)室温孵育,洗涤,DBA显色。
1.5 免疫组织化学染色 采用SP法检测组织中IL⁃18的表达。石蜡切片常规脱蜡至水,加0.01 mol/L枸橼酸缓冲液(pH 6.0),用高压锅进行抗原热修复,加3%H2O2室温避光孵育30 min,PBS洗涤3次。滴加10%的正常非免疫羊血清,37℃孵育60 min,PBS洗涤3次。滴加IL⁃18一抗工作液(1∶50),4℃孵育过夜,PBS洗涤3次。滴加二抗工作液(稀释比例为1∶200),37℃孵育60 min,PBS洗涤3次。滴加辣根过氧化物酶(HRP)标记的链霉卵白素,37℃孵育60 min,PBS洗涤3次。用DAB显色、苏木素复染、脱水、二甲苯透明、中性树胶封片。显微镜下每个切片随机选取5个视野进行拍照。Image Pro Plus软件计算阳性染色的平均光密度。根据染色结果,以所有患者的平均光密度值为分界值将所有患者分为IL⁃18高表达组(IL⁃18High)和IL⁃18低表达组(IL⁃18Low)。
1.6 质粒构建与稳定表达细胞株建立 根据人IL⁃18的mRNA序列(NM_001243211.2)和pLVX⁃Tight⁃Puro载体图谱,设计上下游引物:上游引物5′⁃CC⁃GGGATCCATGATGGCTGCTGAACCAG⁃3′(BamHI);下游引物5′⁃CCCGGTAGAATTCGTCTTCGTTTTGA⁃AC⁃3′(EcoR I)。从人结肠癌细胞株HT29的cDNA为模板进行PCR扩增。用BamH I和EcoR I酶对pLVX⁃Tight⁃Puro质粒进行双酶切。根据T4连接酶的说明书将cDNA扩增产物与酶切质粒连接。质粒构建成功后根据说明书包装慢病毒,感染HT29或CT26细胞,并用嘌呤霉素筛选。
1.7 小鼠移植瘤模型的建立 将30只C57小鼠随机分为IL⁃18过表达组和对照组。将过表达IL⁃18或对照CT26细胞消化计数后调整细胞浓度至1.0×107/mL,无菌条件下接种于C57小鼠左前肢腋窝结合部皮下,每只0.1 mL。接种后第3天起隔天记录各小鼠的肿瘤大小,持续记录60 d。用Western Blot分析各组小鼠肿瘤组织中IL⁃18、p⁃PI3K、p⁃AKT与p⁃NF⁃κB的表达。用流式细胞术检测移植瘤中CD4+T、CD8+T与CD56+CD16+NK细胞比例。
1.8 流式细胞术 分离小鼠结肠癌移植瘤组织,消化、研磨后过不锈钢网,PBS洗涤后制成单细胞悬液。计数并将细胞浓度调整到1.0×107/mL,取0.5 mL细胞悬液加入离心管。根据说明书将待测抗体(CD4、CD8、CD56或CD16)以适当比例加入离心管中。涡旋混匀后避光室温孵育30 min。PBS洗涤后重悬,上流式细胞仪检测。
1.9 统计学方法 采用SPSS 20.0和Graph Pad Prism 5.0进行数据分析与作图。计数资料用频数和百分比[例(%)]表示,计量资料用均数±标准差表示。采用t检验或Mann⁃WhitneyU检验分析两独立样本之间的差异,采用χ2检验或Fisher确切概率法检验进行计数资料分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者的基本信息 研究初期共纳入108例结肠癌患者,其中12例不符合纳入标准。最终96例结肠癌患者中56例(58.3%)为男性,平均年龄(58.2±14.4)岁。对照组40例健康者中18例(60.0%)为男性,平均年龄(57.8±15.1)岁。两组的年龄与性别相比差异无统计学意义(P>0.05)。患者的基本信息见表1。
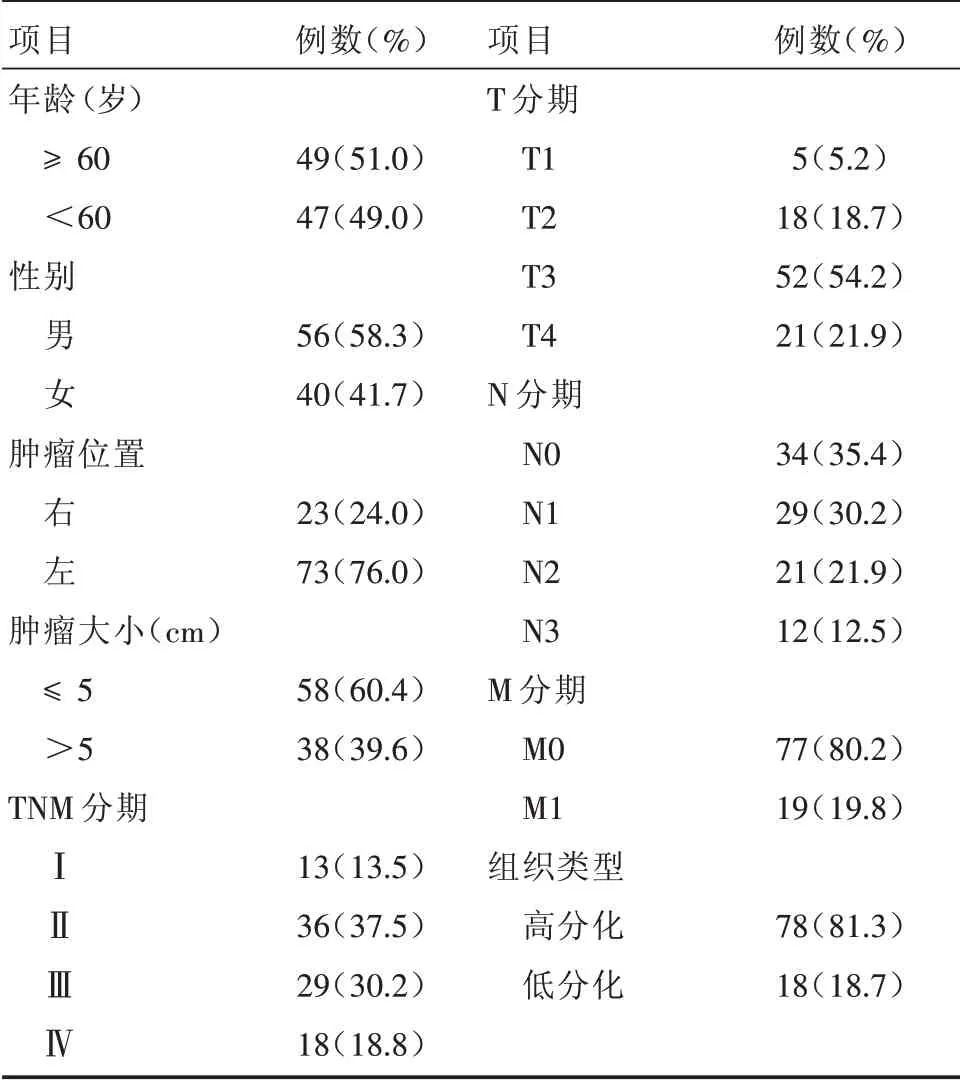
表1 结肠癌患者的基本信息Tab.1 Basic data of patients with colon cancer
2.2 结肠癌患者血清及组织IL⁃18水平分析ELISA分析显示结肠癌患者的血清IL⁃18水平为(178.5±23.9)pg/L,显著高于健康者的(32.8±6.1)pg/L(P<0.05)。免疫组化分析显示IL⁃18在正常肠腺细胞和结肠癌肿瘤细胞中均有阳性表达,Western Blot与免疫组化分析均显示结肠癌肿瘤组织中的IL⁃18水平显著高于癌旁正常组织(P<0.05),见图1。
2.3 肿瘤IL⁃18水平与临床特征的关系 IL⁃18高表达组57例(59.4%),IL⁃18低表达组39例(40.6%)。结肠癌患者中IL⁃18高表达与IL⁃18低表达组的年龄、性别、肿瘤部位、肿瘤大小、N分期与组织学分型相比差异无统计学意义(P>0.05)。IL⁃18低表达组患者的T分期、M分期与TNM分期均显著高于IL⁃18高表达组(P<0.05),见表2。
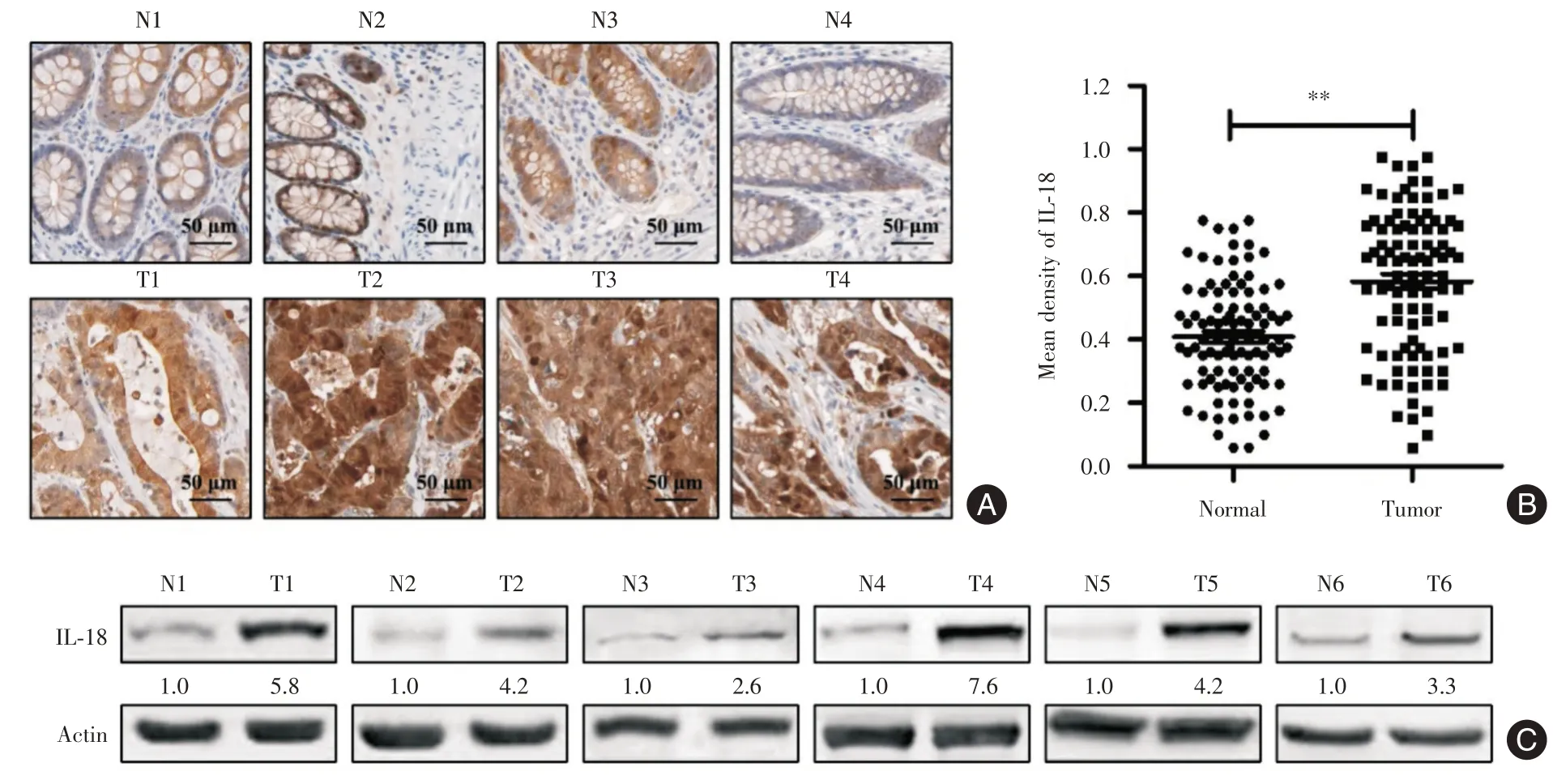
图1 结肠癌患者肿瘤(T)与癌旁正常组织(N)中的IL⁃18水平分析Fig.1 Expression of IL⁃18 in tumor(T)and adjacent normal(N)tissues of patients with colon cancer
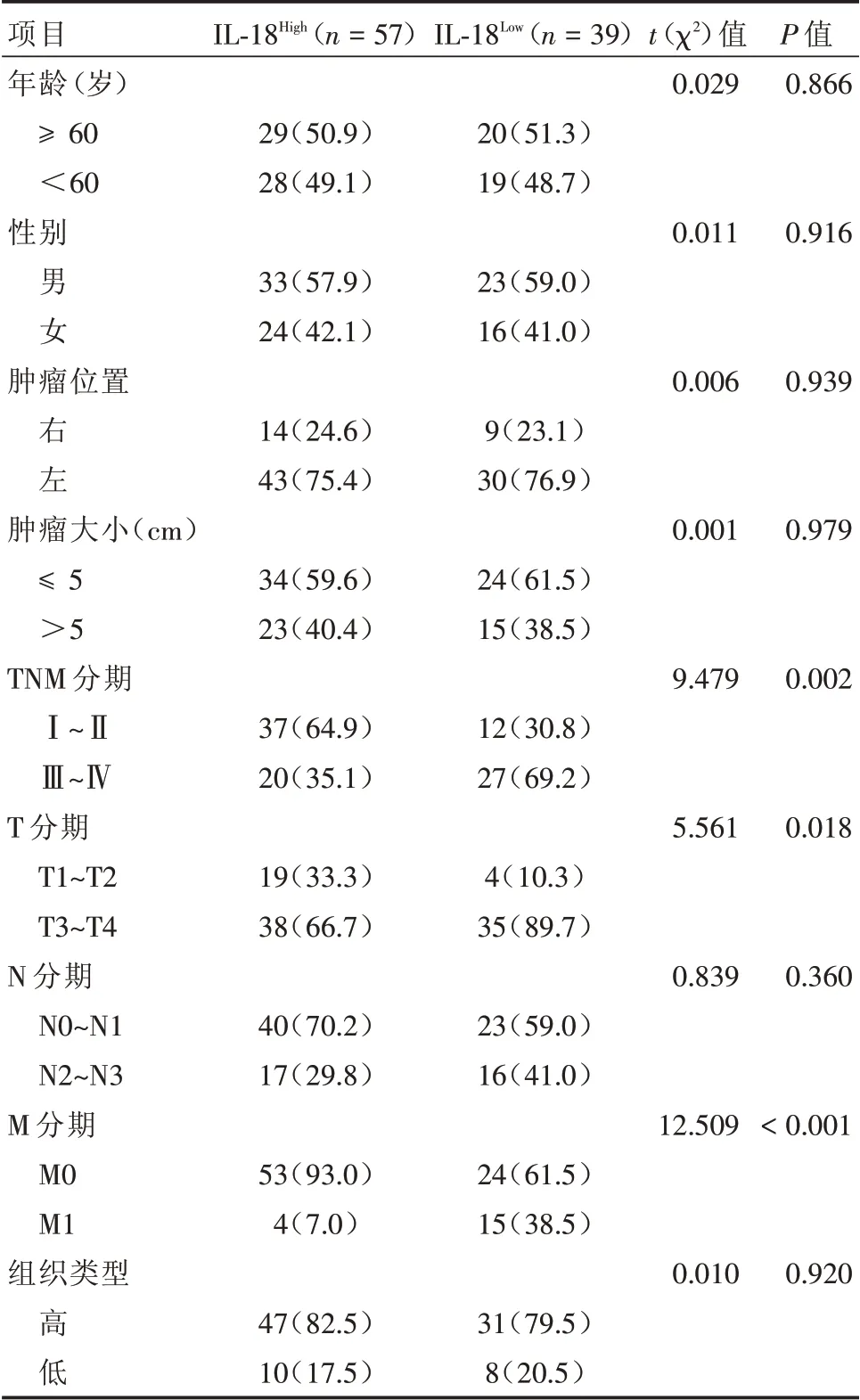
表2 肿瘤组织IL⁃18与临床特征的关系Tab.2 Relation between IL⁃18 level in tumor tissues and clinical characteristics 例(%)
2.4 IL⁃18对结肠癌细胞信号通路的影响 IL⁃18过表达能显著增加HT29与CT26细胞p⁃PI3K、p⁃AKT与p⁃NF⁃κB水平,而不影响p⁃ERK与p⁃β⁃catenin水平。进一步分析显示,重组IL⁃18蛋白(rIL⁃18)也能增加HT29与CT26细胞p⁃PI3K、p⁃AKT与p⁃NF⁃κB水平,见图2。
2.5 小鼠模型的建立与分析 小鼠模型显示IL⁃18过表达组小鼠的肿瘤生长曲线显著低于对照组(P<0.05),生存曲线显著优于对照组(P<0.05)。IL⁃18过表达组小鼠肿瘤组织中p⁃PI3K、p⁃AKT与p⁃NF⁃κB的表达水平均显著低于对照组。此外,IL⁃18过表达组小鼠肿瘤组织中CD4+T、CD8+T与CD56+CD16+NK细胞数量均显著高于对照组(P<0.05),见图3。
3 讨论
近期研究指出IL⁃18也参与了Th2的分化,这为IL⁃18对Th1和Th2炎症反应的双重作用提供了新的线索[12-15]。本次研究的结果显示,结肠癌患者血清与肿瘤组织中的IL⁃18水平均出现显著升高。同时,IL⁃18过表达组结肠癌移植瘤小鼠的肿瘤生长曲线显著低于对照组小鼠,生存曲线显著优于对照组小鼠。提示IL⁃18可能参与结肠癌的发生与发展机制。
IL⁃18能与IL⁃18Rα和IL⁃18Rβ形成三聚体,使MyD88与IL⁃18Rα和IL⁃18Rβ的Toll⁃IL⁃1受体(TIR)结构域结合,激活NF⁃κB与ERK/MAPK信号通路,这些信号能诱导Th1细胞产生IFN⁃γ,促进细胞增殖[16-17]。IL⁃18刺激还能诱导PI3K/Akt信号通路,该信号对NK细胞的增殖和存活以及对非免疫系统细胞的存活至关重要[18]。本研究中,IL⁃18过表达与重组IL⁃18蛋白处理均能显著增加HT29与CT26细胞的p⁃PI3K、p⁃AKT与p⁃NF⁃κB的表达水平,不影响p⁃ERK与p⁃β⁃catenin的表达水平。
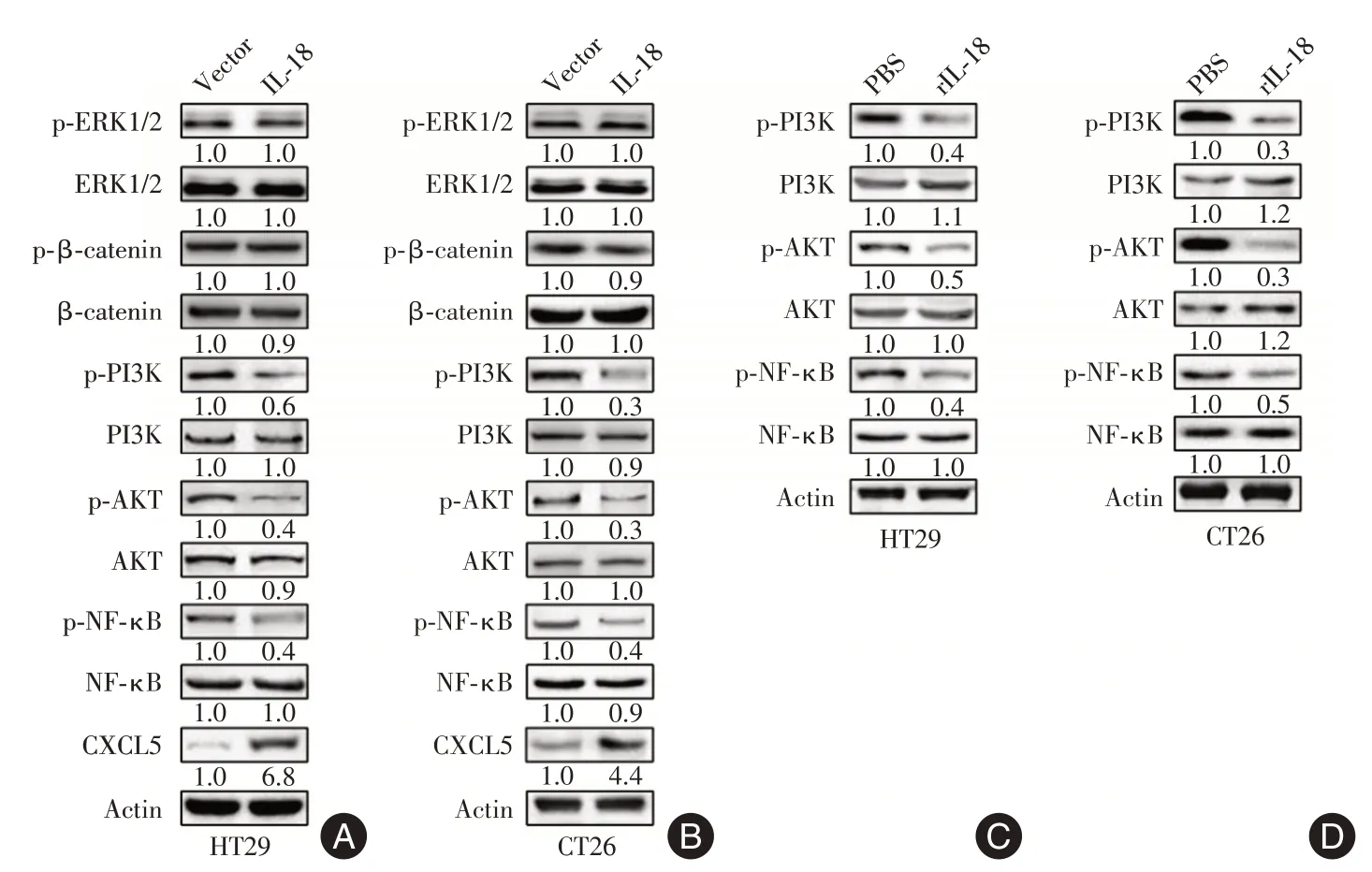
图2 IL⁃18对结肠癌细胞信号通路的影响Fig.2 Effect of IL⁃18 on signal pathways of colon cancer cells
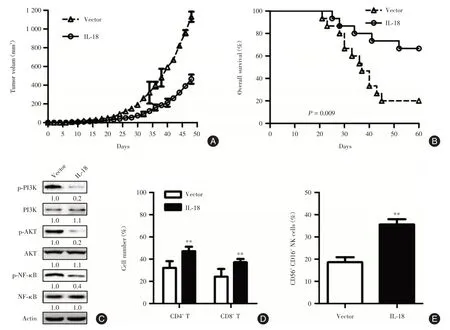
图3 结肠癌移植瘤小鼠模型分析Fig.3 Analysis of xenograft model of colon cancer
肿瘤免疫治疗近年来发展迅速,对多种癌症的临床疗效显著[9,19]。细胞毒性T淋巴细胞相关抗原4(CTLA⁃4)的特异性抗体(Ipilimumab)已被用于晚期黑色素瘤患者一线或二线免疫治疗[20]。2015年FDA批准了程序性死亡受体-1(PD⁃1)抗体(nivolumab和pembrolizumab)用于晚期非小细胞肺癌的治疗[21-22]。尽管迄今为止还没有结肠癌的免疫疗法获批,人们已经开发出不同的免疫导向疗法,如基于DC的疫苗和基于基因工程的嵌合抗原受体T细胞免疫疗法[9]。一种基于免疫检查点抑制剂的免疫治疗已经在结肠癌的治疗中取得了可观的二期临床数据[23]。日益增多免疫学相关分子被发现,可能成为结肠癌免疫治疗的潜在靶点,如GUCY2C、HHLA2、OR7C1和MAGE⁃D4等[24]。因此,寻找更多的用于结肠癌免疫学治疗的靶点至关重要。本次研究中,IL⁃18过表达组结肠癌移植瘤小鼠的肿瘤组织中CD4+T、CD8+T与CD56+CD16+NK细胞的数量均显著高于对照组。因此,IL⁃18可能发挥激活结肠癌肿瘤免疫的作用。
本次研究仍存在一定的局限性。首先,本次纳入的患者缺乏生存期数据,IL⁃18与结肠癌患者生存预后的关系仍需进一步研究。其次,本次研究关于IL⁃18抑制结肠癌的具体机制仍需进一步确认和深入研究。尽管如此,本次研究仍为后续的研究提供了一定的思路和基础。综上所述,结肠癌患者肿瘤组织及血清中的IL⁃18水平均出现显著升高,IL⁃18可能通过激活PI3K/AKT与NF⁃κB信号通路激活结肠癌的肿瘤免疫活性进而发挥抑制结肠癌的作用。
