circRNA RBM39与miR⁃5088⁃5p在缺氧诱导的滋养细胞自噬中的作用
2020-04-18吴琪瑞王艳华柴丽芬张辉李淑霞刘林英石青吴凯张慧萍
吴琪瑞 王艳华 柴丽芬 张辉 李淑霞 刘林英 石青吴凯 张慧萍,4,5
宁夏医科大学1临床医学院,2基础医学院(银川750004);3宁夏医科大学总医院(银川750004);4国家卫生健康委代谢性心血管疾病研究重点实验室(银川750004);5宁夏血管损伤与修复研究重点实验室(银川750004)
子痫前期(preeclampsia,PE)是妊娠过程中的一种特发疾病,其主要症状包括妊娠20周后出现高血压和肾功能障碍[1]。据统计,全世界3%~7%的孕妇会发生PE,然而其发病机制至今仍不明确[2]。自噬是一种高度保守的自我消化过程,可通过降解细胞器和蛋白质等来维持细胞功能和生存,从而使细胞在营养缺乏、缺氧等恶劣环境中继续生长;但当自噬过度时,则会引起细胞的程序性死亡[3]。研究[4-5]证明,滋养细胞自噬在PE的发生发展中发挥着重要作用,但作用机制有待进一步研究。环状RNA(circular RNA,circRNA)是一类具有稳定环状结构的非编码RNA,其参与调控细胞自噬、增殖、凋亡等多种生理或病理过程[6]。前期文献[7]报道circRNA RBM39在PE胎盘组织中差异性表达,但关于其在PE发生、发展过程中的具体作用尚未进一步探讨。本研究以滋养细胞株HTR⁃8/SVneo为实验对象,观察缺氧诱导滋养细胞自噬的变化情况,进一步分析circRNA RBM39及其结合的miR⁃5088⁃5p的变化,旨在探讨PE的发病机制,为PE早期预测及诊断提供新的依据。
1 材料与方法
1.1 材料 人源胎盘滋养细胞株(HTR⁃8/SVneo)来源于上海复旦细胞库(上海瑞鹿生物科技有限公司);胎牛血清、RPMI⁃1640培养基(美国Gibco公司);青链霉素、胰蛋白酶消化液(碧云天生物技术研究所);总蛋白提取试剂盒(上海贝博生物科技公司);LC3B兔抗人一抗(CST公司,2775);P62兔抗人一抗(abcam公司,ab109012);β⁃actin(Santa公司,sc⁃47778HRP);RNA提取试剂盒(北京天根生化科技有限公司);逆转录试剂盒、荧光定量试剂盒(Takara生物公司);PARISTMKit(Invitrogen公司);circRNA RBM39和miR⁃5088⁃5p引物由广州锐博公司合成。
1.2 方法
1.2.1 细胞培养 滋养细胞采用含10%胎牛血清、100μg/mL青链霉素的RPMI⁃1640培养基培养,在37℃、5%CO2的培养箱中进行孵育,每2~3天用0.25%胰蛋白酶消化传代1次,取对数生长期的细胞用于后续实验。
1.2.2 实验设计及分组 待培养瓶中细胞长至60%~70%融合度时分为2组:(1)正常组:在37℃、5%CO2的条件下培养;(2)缺氧组:在NAPCO Series 8000WJ培养箱中以37℃、1%O2和5%CO2的条件下培养。继续培养48 h后收取细胞进行后续实验。
1.2.3 生物信息学分析 使用TargetScan生物信息学软件对circRNA靶基因miRNAs进行预测,选取特异性miRNAs,检测其在缺氧诱导滋养细胞中的表达。
1.2.4 Western Blot测定LC3B和p62的蛋白表达 收集正常组和缺氧组细胞,按照总蛋白提取试剂盒说明提取蛋白,定量,加入上样缓冲液煮沸变性。每孔取30μg蛋白样品进行SDS⁃PAGE凝胶电泳,半干转、5%脱脂奶粉封闭2 h后,PBST洗膜10 min×3次,分别加入按比例稀释后LC3B(1:1 000)、p62(1∶10 000)、β⁃actin(1∶10 000)一抗,4℃摇床孵育过夜,第2天用PBST洗膜10 min×3次,然后辣根过氧化物酶标记的二抗(1∶10 000)室温下摇床孵育2 h,PBST洗膜10 min×3次,ECL化学发光试剂显色,应用Image Lab软件对检测结果的灰度值进行分析。分别以LC3BⅡ灰度值与LC3BⅠ灰度值比值作为LC3B蛋白的表达量,p62灰度值与内参β⁃actin灰度值比值作为p62蛋白的表达量,实验重复3次。
1.2.5 Real⁃time PCR检测 按照总RNA提取试剂盒说明书提取正常组和缺氧组细胞的总RNA,然后逆转录合成cDNA,置于荧光定量PCR仪进行扩增,总体系为20μL。PCR扩增条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,共40个循环;熔解曲线95℃15 s,60℃1 min,95℃15 s,结果使用2-ΔΔCt法表示基因的相对表达量,ΔΔCt=(Ct缺氧组目的基因-Ct缺氧组内参基因)-(Ct正常组目的基因-Ct正常组内参基因)。
1.2.6 circRNA的胞核、胞浆定位 按照胞浆胞核RNA分离试剂盒说明书提取正常组和缺氧组细胞的胞浆、胞核RNA,并用分光光度计测定RNA浓度和纯度,然后逆转录合成cDNA,置于荧光定量PCR仪上扩增进行半定量分析。
1.3 统计学方法 所有实验至少重复3次,结果以表示,用Prism 7.0统计软件处理数据。采用两独立样本t检验比较正常组和缺氧组自噬相关蛋白LC3B、p62和circRNA⁃RBM39、miR⁃5088⁃5p表达水平的差异,相关性分析采用pearson相关系数,P<0.05表示差异有统计学意义。
2 结果
2.1 缺氧诱导滋养细胞后自噬的改变 与正常组相比,HTR⁃8/SVneo经缺氧处理48 h后,自噬标志蛋白LC3BⅡ/Ⅰ表达水平明显升高,而p62表达水平则明显降低,差异均有统计学意义(P<0.001),提示缺氧诱导滋养细胞自噬升高,见图1。
2.2 circRNA RBM39在缺氧诱导滋养细胞中的表达 HTR⁃8/SVneo经缺氧处理48 h后,使用circRNARBM39特异性引物在缺氧诱导的滋养细胞中检测发现,与正常组相比,缺氧组中的circRNA RBM39表达上调(P<0.05),提示缺氧促进了滋养细胞中circRNA RBM39的表达,见图2。
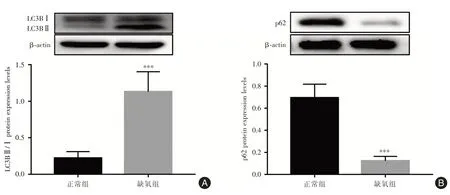
图1 缺氧诱导HTR⁃8/Svneo细胞后自噬的改变Fig.1 Changes of autophagy in HTR⁃8/Svneo cells induced by hypoxia
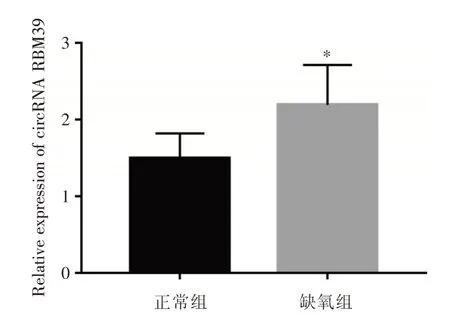
图2 缺氧诱导HTR⁃8/Svneo细胞后circRNA RBM39的表达Fig.2 Expression of circRNA RBM39 in HTR⁃8/Svneo cells induced by hypoxia
2.3 circRNA RBM39的胞浆胞核定位分析 cir⁃cRNA发挥功能主要取决于其在细胞中的位置,位于细胞核的circRNA主要起转录调节作用,而位于细胞浆的circRNA主要起转录后调节作用。以GAPDH基因作为胞浆RNA的标志物,U6基因作为胞核RNA标志物,对circRNA RBM39进行胞浆胞核定位分析发现,circRNA RBM39主要在胞浆中表达,见图3。
2.4 生物信息学分析circRNARBM39与miR⁃5088⁃5p的结合关系 为进一步研究circRNA RBM39转录后调控机制,使用TargetScan生物信息学软件分析发现,circRNA RBM39与miR⁃5088⁃5p存在互补配对序列,提示circRNA RBM39可竞争结合miR⁃5088⁃5p,见图4。
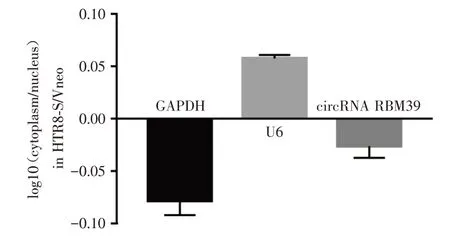
图3 胞浆胞核分离实验检测circRNA RBM39在滋养细胞内的分布Fig.3 Detection of circRNA RBM39 distribution in trophoblasts by cytoplasmic nucleus isolation assay
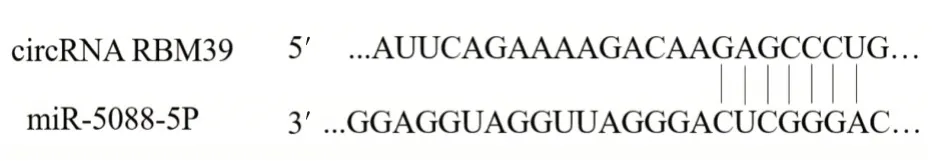
图4 circRNA RBM39与miR⁃5088⁃5p的预测结合位点Fig.4 Predictive binding sites between circRNA RBM39 and miR⁃5088⁃5p
2.5 miR⁃5088⁃5p在缺氧诱导滋养细胞中的表达 基于TargetScan生物信息学分析的结果,qRT⁃PCR检测发现与正常组比较,缺氧组中的miR⁃5088⁃5p表达下调,与circRNA RBM39表达趋势正好相反,差异有统计学意义(P<0.05),见图5。
2.6 circRNA RBM39及miR⁃5088⁃5p与自噬标记蛋白LC3B和p62的相关性分析 如图6所示,cir⁃cRNA RBM39表达水平与自噬标记蛋白LC3B呈正相关(r=0.783 2);而与p62呈负相关(r=-0.792 8)。相反,miR⁃5088⁃5p表达水平与LC3B呈负相关(r=-0.846 6),与p62呈正相关(r=0.838),差异均具有统计学意义(P<0.01),以上提示circRNA RBM39的表达水平与自噬水平呈显著正相关,而miR⁃5088⁃5p的表达水平与自噬水平呈显著负相关。
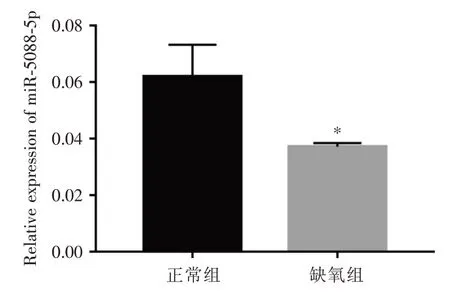
图5 缺氧诱导HTR⁃8/Svneo细胞后miR⁃5088⁃5p的表达Fig.5 Expression of miR⁃5088⁃5p in HTR⁃8/Svneo cells induced by hypoxia
3 讨论
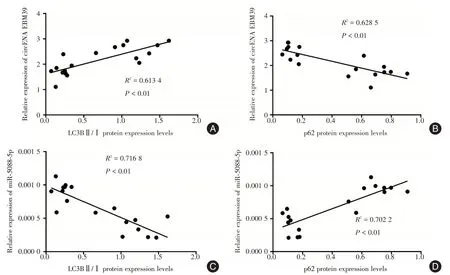
图6 滋养细胞中circRNA RBM39和miR⁃5088⁃5p的表达与自噬标记蛋白LC3B和p62的相关性分析Fig.6 Analysis of the relationship between the expression of circRNA RBM39 and miR⁃5088⁃5p and autophagy marker proteins LC3B and p62 in trophoblasts
目前,PE的病因及发病机制尚不明确,终止妊娠是治疗PE的唯一方法[8]。因此,探讨PE发病机制、制定防治策略成为产科亟待解决的问题之一。现有研究表明,妊娠早期阶段,胚胎发育及胎盘形成是在相对缺氧的条件下进行的,滋养细胞阻塞子宫螺旋动脉造成缺氧环境,可以促进血管重铸、滋养细胞分化侵袭,从而保证正常妊娠的进行;但当缺氧过度时,则会使妊娠后期胎盘慢性缺血缺氧,导致PE、胎儿生长受限、流产、死胎等不良妊娠结局[9-10]。自噬作为近些年来研究的热点,能在营养缺乏、缺氧时维持细胞正常功能,越来越多的证据表明,自噬不仅在正常妊娠的胎盘形成过程中发挥重要作用,而且在PE、胎儿宫内生长受限等产科并发症中亦不可或缺[11-13]。既往研究表明,体外缺氧诱导人滋养细胞后自噬增加,同时与PE患者胎盘组织自噬水平一致;另外,NAKASHIMA等[14]通过敲除自噬相关基因,在缺氧培养时发现,滋养细胞自噬减弱,侵袭力降低,这进一步说明缺氧诱导的自噬在维持滋养细胞功能发挥重要作用。因此,本研究利用缺氧在体外诱导人胎盘滋养细胞模拟PE发生发展微环境,发现与正常组相比,缺氧组自噬水平增加,这与文献报道的一致,暗示自噬参与了PE的发病过程,但具体机制仍存在争议,需要进一步研究。
circRNA是最近发现的一个新的非编码RNA成员,因具有普遍性、稳定性、特异性等特点,成为近些年研究的热点[15]。目前已发现,circRNA可通过作为miRNA的海绵体、调节可变剪接、与RNA结合蛋白结合及调节亲本基因转录等方式参与自噬、凋亡、发育、稳态维持等多种生物学过程,与多种疾病的发生发展密切相关[16-18]。研究表明,PE患者胎盘组织较正常妊娠孕妇存在大量差异性表达的circRNA,提示circRNA可能参与PE发病机制的调控[19-20]。到目前为止,只有少数circRNA在PE中的作用被研究,仍有大量circRNA在PE发生发展中的作用尚不清楚。因此,笔者通过qRT⁃PCR检测circRNA RBM39发现,circRNA RBM39在缺氧诱导的滋养细胞自噬中上调,提示该基因可能参与自噬过程。为进一步探究circRNA RBM39在缺氧诱导滋养细胞自噬中的作用,首先对其表达位置进行了分析,发现该基因主要在胞浆中表达,提示其主要在转录后发挥调控功能。
miRNAs是一类在转录后水平调控基因表达的短非编码RNA,越来越多的证据表明,circRNA能够竞争性结合miRNAs位点,从而影响miRNAs及下游靶基因的表达[21]。最近一项研究[22]发现,在PE胎盘中circRNA TNRC18表达上调,其通过上调Grhl2抑制miR⁃762,从而导致滋养细胞迁移和上皮间质转化。因此,作者通过对circRNA RBM39进行生物信息学分析发现,其可竞争性结合miR⁃5088⁃5p,同时,miR⁃5088⁃5p在缺氧诱导滋养细胞中表达下调,这正好验证了circRNA与其结合的miRNAs表达水平的负性调控关系。最后,分别将circRNA RBM39及miR⁃5088⁃5p表达水平与自噬蛋白LC3B和p62表达水平作相关性分析发现,circRNA RBM39与自噬水平呈正相关,而miR⁃5088⁃5p呈负相关。因此,笔者推测circRNA RBM39可能通过结合miR⁃5088促进自噬相关基因在PE患者胎盘中高表达,因此自噬标记蛋白LC3B表达增高,p62表达降低。但是,人胎盘滋养细胞株并不能完全替代PE原代滋养细胞,且在PE发生发展过程中胎盘滋养细胞受到多种因素的调控,因此,后续笔者将分离原代滋养细胞进行验证,并在动物模型中进一步探索circRNA RBM39在PE发生发展中的具体机制。
综上所述,本研究结果提示了circRNA RBM39及miR⁃5088⁃5p与滋养细胞自噬水平升高密切相关,而circRNA RBM39可能通过竞争性结合miR⁃5088⁃5p在调节缺氧诱导的滋养细胞自噬中发挥重要作用,进而引起PE的发生发展。这为PE的发病机制提出了一个新的方向,为进一步探究PE胎盘滋养细胞自噬过程中circRNA的调控机制提供了新的线索,并且由于circRNA的组织特异性及稳定性,circRNA RBM39有望成为PE的预防和诊断的分子标记物。
