包裹吲哚菁绿的靶向脂粒在肝癌骨转移诊疗中的应用
2020-04-18李天博高磊王江宁
李天博 高磊 王江宁
首都医科大学附属北京世纪坛医院矫形外科(北京100000)
我国是肝癌高发病的国家,由于其恶性程度高,其病死率在世界排首位[1-4]。患者初次诊断时已进入肿瘤进展期,进展期肝细胞癌常发生骨转移,且发生率逐年上升,给肝细胞癌患者造成剧烈骨骼疼痛和病理性骨损伤[5]。脊柱是骨肿瘤好发部位,调查显示,脊柱骨肿瘤占全身骨肿瘤的7%左右,并且50%以上患者为转移瘤[6-7]。良性脊柱骨肿瘤患者其临床症状往往轻微,疾病进展缓慢,病程较长,发病人群多集中于青少年[8];而恶性脊柱骨肿瘤患者则进展快速,肿瘤可累计椎体及附近组织,患者可见疼痛、局部肿块、脊柱畸形以及神经功能障碍等症状,部分患者还可见全身症状,严重威胁患者健康[9]。
肝细胞癌对骨骼系统的影响直到最近几年才被报道,由于对骨转移认识的欠缺,对发生肝细胞癌骨转移的肝细胞癌患者,治疗手段局限。骨骼被认为是各种肿瘤第三好发的部位,仅次于肺和淋巴结,肝细胞癌大约有20%的患者会发展成骨转移[10]。
近年来,利用光学作为诊断治疗的方式已经成为研究的热点[11],近红外荧光成像以及光热治疗发展迅速,有望为肝癌骨转移的诊疗提供新的思路和方法。吲哚菁绿(indocyanine green,ICG)是被美国食品及药物管理局(Food and Drug Adminis⁃tration,FDA)批准用于临床的近红外成像试剂之一[12],已广泛用于疾病的光学成像等多个方面[13-15]。同时,其也是1种优良的光敏剂,能够吸收可深入穿透组织但不产生明显热能的700~800 nm的光,但ICG水稳定性差、易与脂蛋白结合,注射后24 h在肿瘤组织及其细胞内基本无滞留,因此在光热治疗中的应用受限[16-17]。研究发现将其包载入的纳米颗粒可克服上述问题。纳米颗粒的靶向研究一直是目前的研究热点,精氨酸—甘氨酸—天冬氨酸整合素(Arg⁃Gly⁃Asp,iRGD)[18]作为整合素αvβ3的一种靶向配体,这种受体在肿瘤新生血管的内皮细胞及多种肿瘤细胞表面均有高表达,这种多肽链长较短,由精氨酸-甘氨酸-天冬氨酸组成,易于修饰在纳米材料表面用于靶向研究[19-20]。
本实验利用仿生材料脂质体(Liposome,LIP)包载ICG修饰RGD,制成ICG/Lip纳米探针,通过在肝癌细胞HepG⁃2骨转移模型上诊断和治疗的研究,证明ICG/Lip纳米探针能够用于提高肝癌骨转移的诊疗。
1 资料与方法
1.1 实验动物 5~6周雄性BALB/c裸鼠,体质量约25 g(北京维通利华公司)。肝癌细胞HepG⁃2(协和细胞库购买);二棕榈酰磷脂酰胆碱(Dipa⁃lmityl phosphatidylcholine,DPPC),生物素化磷脂酰乙醇胺(DSPE⁃PEG2000⁃Biotin),DC胆固醇(DC cholesterol,DC⁃chol)和链霉亲和素均购买于美国Sigma公司,三氯甲烷(Trichloromethane,CCl3)和PBS购买于国药集团,iRGD购于美国Abcam公司,注射用ICG购于辽宁天医生物制药股份有限公司。
1.2 研究方法
1.2.1 靶向脂质体纳米颗粒的制备 将质量比5∶2∶1的DPPC、DSPE⁃PEG 2000⁃Biontin及DC⁃chol按照配制50 mg,加入25 mL CCl3中充分溶解后在55℃下减压蒸发2 h,随后加入10 mL PBS备用;将200μL ICG溶液与200μL PFP混匀后使用超声震荡15 min;将上述溶液混合后反应,离心洗涤即得到LIP⁃ICG;取200μL LIP⁃ICG加入10μL链霉亲和素10μL iRGD 4℃孵育30 min,PBS离心洗涤2次,去除过量抗体,即得到靶向脂质体纳米颗粒。
1.2.2 LIP⁃ICG 一般特征评价配置100μg/mL的LIP⁃ICG溶液,使用ZS90测定其粒径及电位;在TEM下观察其形态及分布情况。
1.2.3 光热效应检测 取2、4、6、8 mg/mL LIP⁃ICG各100μL,置于96孔板内,利用808 nm波段的激光器以1.4 W/cm2和2 W/cm2两种功率激光在不同的时间(0、2、4、6、8、10 min)照射,并用红外热成像仪记录其温度。
1.2.4 细胞毒性验证 将104个/孔HeptG⁃2细胞种在96孔板中24 h。将含有不同浓度纳米粒的培养基(30、50、100、150、200、250、300、350、400μg/mL)加入到培养板中培育24 h。向每个孔加入20μL MTT溶液继续培养4 h。然后吸出所有培养基,每孔加入150μL二甲基亚砜,震荡5 min后,检测490 nm处的吸光度值。
1.2.5 动物模型构建 取5只BALB/C小鼠,向小鼠皮下注射100μL肝细胞癌HepG⁃2悬液(约2.5×106个细胞)注射到小鼠背脊,制备肝癌骨转移的原位模型,用于光学成像;成像后去病理切片,验证探针的靶向性。取18只BALB/C小鼠,向小鼠皮下注射100μL肝细胞癌HepG⁃2悬液(约含细胞2.5×106个)注射到小鼠皮下,制备皮下肿瘤模型,用于光热治疗。当平均肿瘤体积大约到达50 mm3时,随机分为3组,每组6只:实验组尾静脉注射纳米颗粒溶液并进行激光辐照,对照组1尾静脉注射PBS并进行激光辐照,对照组2注射纳米颗粒溶液不进行辐照。测量并记录肿瘤大小和小鼠质量。
1.2.6 体外显像实验将 0.5 mg/mL的LIP⁃ICG通过尾静脉注射肝癌骨转移的原位模型鼠,利用光声成像仪模式下采集纳米粒的光声显影图像。
2 结果
2.1 LIP⁃ICG一般特性 TEM显示纳米颗粒的透射形貌呈现球状,如图1A显示为(93.85±17)nm;此外,该纳米颗粒在细胞中Z平均电位为(-5.37±4.29)mV,说明其在体安全性高。通过紫外可见分光光度计验证,该纳米粒在808 nm处有很好的吸收峰(图1B)。这些特性证明了LIP⁃ICG纳米颗粒具有良好的分布及光学特性,能够为后续活体的光声成像及光热治疗提供良好的特性。
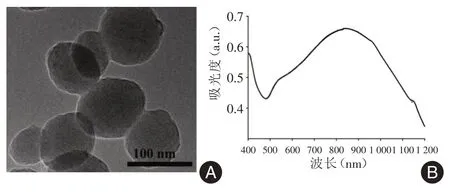
图1 LIP-ICG纳米颗粒的特性验证Fig.1 The characteristics ofLIP-ICG nanoparticles
2.2 LIP⁃ICG 纳米颗粒的光热效应LIP⁃ICG纳米颗粒的具有良好光热效应。对1 mg/mL的LIP⁃ICG溶液,通过1.4 W/cm2808 nm的激光辐照时,温度随时间增大升高,在同一激光功率条件下,辐照不同浓度LIP⁃ICG,温度随浓度增加而升高(图2A)。笔者针对不同的浓度下0(PBS)、2、4、6、8 mg/mL的LIP⁃ICG纳米颗粒,利用1.4 W/cm2和2 W/cm2激光器进行辐照,通过12 min的温度收集发现,温度和时间在前2 min具有线性关系,2 min后,高浓度及强激光辐照的溶液,温度升高较快。其中,在浓度6 mg/mL、功率1.4 W/cm2激光辐照2 min时,其温度可升至55℃(图2B),达到了细胞致死浓度,该温度及功率适合用于肿瘤的治疗。
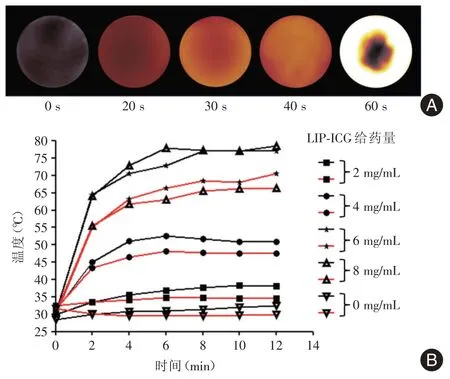
图2 LIP⁃ICG纳米颗粒的光热特性验证Fig.2 Photothermal properties of LIP⁃ICG nanoparticles
2.3 LIP⁃ICG的细胞生物学安全性 纳米颗粒的生物安全性是其引用语活体的重要指标,因此,通过细胞层面验证了LIP⁃ICG的生物安全性。如图3所示,不同浓度的纳米颗粒作用于肝癌细胞HepG⁃2,作用时间为12 h,通过细胞学验证可以发现,细胞整体存活率较高,但随着LIP⁃ICG的浓度升高,细胞存活略有下降,这是由于细胞渗透压等原因,因此,该数据证明,在无荧光辐照的环境下,该纳米颗粒LIP⁃ICG具有良好的生物安全性,这为LIP⁃ICG在体治疗提供了重要的安全性保障。
2.4 体外光声显影定位骨转移的肿瘤位置 通过生物安全性验证后,针对肝癌骨转移原位肿瘤进行成像,旨在准确定位转移病灶的位置,从而为治疗提供可靠的位置信息。通过尾静脉注射LIP⁃ICG后,利用光声成像设备进行成像,如图4A所示,箭头指向为LIP⁃ICG富集区。取富集区边缘组织进行苏木精-伊红染色法(hematoxylin⁃eosin staining,HE)染色,从图4B看出,该富集LIP⁃ICG区为肿瘤细胞所在,利用倒置荧光显微镜进行激发可以观察到LIP⁃ICG对肿瘤组织进行了良好的定位(图4C)。
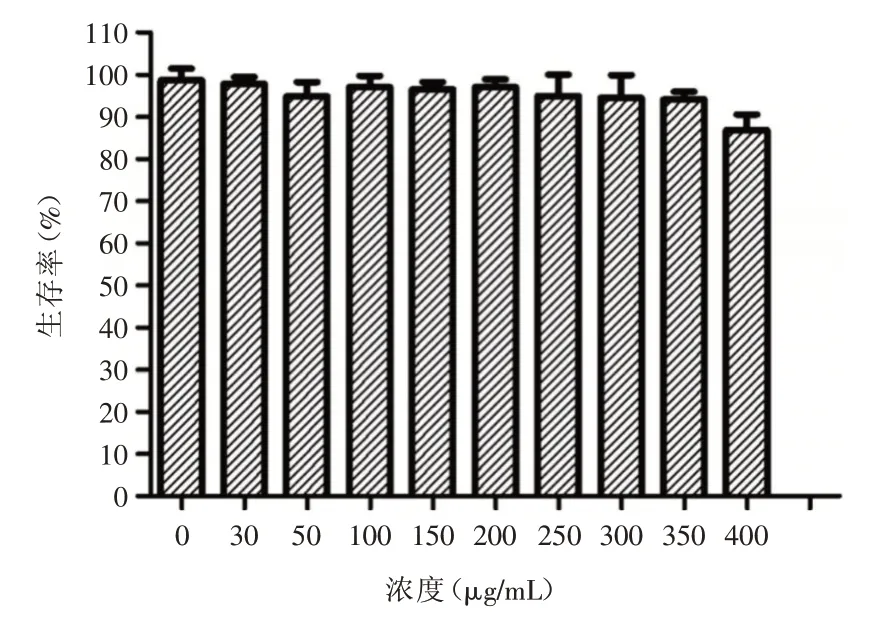
图3 不同浓度的LIP⁃ICG对细胞的杀伤毒性实验Fig.3 Cytotoxicity of different concentrations of LIP⁃ICG
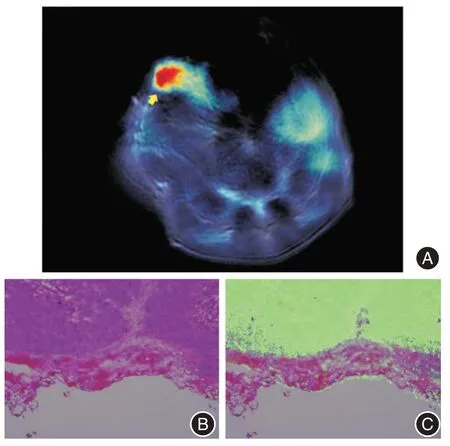
图4 体外光声显影及肿瘤验证Fig.4 Photoacoustic imaging in vitro
2.5 LIP⁃ICG对肿瘤的光热治疗研究 利用皮下瘤进行光热治疗的验证。实验组LIP⁃ICG通过尾静脉注射到小鼠体内后,利用808 nm的激光器,在1.4 W/cm2条件下进行辐照,收集辐照时间0、1、2 min的温度变化,如图5A所示,发现体内能够产生温度的升高,2 min后可以升高到61.9℃,达到了肿瘤细胞死亡温度。实验组和对照组经过治疗3 d后的肿瘤图片,其中利用LIP⁃ICG+808 nm激光辐照2 min的肿瘤已经明显开始肿瘤细胞凋亡并结痂;PBS+808 nm激光辐照2 min组肿瘤收到辐照后有轻微的凋亡和结痂,未经过辐照的LIP⁃ICG组肿瘤没有明显变化(图5B)。在治疗后的20 d内,收集肿瘤体积数据,可以发现LIP⁃ICG+激光组能够明显的治疗肿瘤(图5C)。
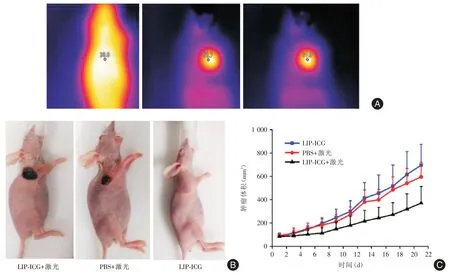
图5 光热治疗研究Fig.5 The study of photothermal therapy
3 讨论
双亲性的磷脂双分子定向排列组成的脂质体纳米颗粒,由于具有良好的生物相容性,可广泛应用于药物载体及成像领域[21-22]。在水中溶解时可形成分散结构,可以组装成为小尺度的颗粒。ICG是FDA批准的可用于临床近红外荧光成像的小分子造影剂,由于其具有荧光在820~840 nm近红外谱段的特点,已经广泛使用与近红外手术导航、眼底血管等多种近红外成像技术中。由于ICG具有吸收近红外光的特点,在本实验中,笔者利用其吸光特性,利用光声成像这种穿透深度更高的技术用于检测肝癌骨转移[21-23]。利用ICG能够吸收近红外光转化为热能的特点,进行局部激光辐照光热治疗肝癌骨转移。笔者成功合成93 nm左右的LIP⁃ICG纳米颗粒,表现出呈现负电位,根据电位优势,纳米颗粒能够在体安全性大大提高;此外,表面的iRGD能够靶向到肿瘤新生血管进入肿瘤组织。由于ICG对808 nm的光具有较强的吸收产生声信号,在光声成像领域已得到广泛应用;其双亲特性使其在脂质体中可达到较高包封率,LIP⁃ICG可以用于光声成像及光转化为热治疗。此外,光转化为热治疗的治疗方式是物理热疗,能够大大降低由化学药物治疗产生的毒副作用。通过对辐照的功率以及给药浓度的研究,选取最优的参数用于活体应用。
纳米颗粒的生物安全性是纳米药物以及纳米造影剂在活体研究的重要指标。因此,本实验在LIP⁃ICG成功合成后,活体研究前开展了细胞层面安全性验证,通过在细胞中加入不同浓度的LIP⁃ICG,验证细胞毒性。MTT实验结果发现,LIP⁃ICG的具有低的生物毒性,细胞生长良好,高浓度环境下细胞活度略有下降,考虑为细胞渗透压造成的活性降低。因此,LIP⁃ICG具有良好的生物安全性,可以用于活体应用。通过活体给药之后,在肝癌骨转移的模型中,利用光声成像,能够准确找到肿瘤位置。通过病理检测发现,在光声中显影的组织同样具有荧光信号,且为肿瘤区域。因此,笔者利用该纳米颗粒可用于肝癌骨转移靶向的特点,开展了肿瘤治疗。通过光声定位肿瘤位置后,利用近红外激光进行定点照射,从而在肿瘤局部产生热量,杀灭肿瘤细胞。结果也表明,这种方法具有一定的肿瘤杀灭效果。
本文利用一种生物安全性高的诊疗一体化纳米颗粒LIP⁃ICG,通过光声成像对肿瘤进行准确的定位,利用光热作用开展肿瘤的治疗,有望为肝癌骨转移的肿瘤提供一种新的治疗方式。
