废旧锂电池中有价金属的湿法回收技术研究进展
2020-04-18高瑞,王继芬
0 引言
随着全球经济迅速发展,目前国家和人民最为关注的两大问题是能源短缺和环境污染。如今石油资源的过度开发利用以及人类对其过分的依赖,若按照目前石油资源的开发和消耗速度,石油资源将在40多年后面临枯竭[1]。所以,积极开发利用新能源已成为世界各国的紧急任务,也促使能源的消费发生改变。近几年,世界各国将开发新能源汽车作为一项极为重要的工作。我国推出的《关于2016—2020年新能源汽车推广运用财政扶持政策的通知》以及《关于开展个人购买新能源汽车补贴试点运行的通知》等政策推动了电动汽车产业的快速发展,同时也促进了动力电池产业的发展[2]。预计到2020年,我国纯电动汽车年产量将超过200万辆,产销量累计达到500万辆[3]。
锂电池由于质量小、密度大受而到市场青睐,虽然目前锂电池还未到大规模报废阶段,但近几年锂电池的产量和销量都在大幅提升,预计未来几年动力锂电池的报废量也将大幅增长。预测到2020年,中国的电池报废量将达到50万t[4]。
废旧锂电池的主要结构及组成如表1所示[5]。由表1可知,锂电池内含有大量的Ni、Co、Mn等有价金属,且平均含量高于原生矿石中的平均含量,具有很好的回收前景。据行业格局估计,2020年从废旧锂电池正极材料中回收Ni、Co、Li、Mn、Fe、Al等有价金属所创造的回收市场规模将超过100亿元,2023年将达250亿元[6]。

表1 锂离子电池主要结构和组成Tab.1 Main structureand composition of lithium ion battery
废旧锂电池不应随意丢弃,因为其中含有电解液及有机溶剂等有害物质,随意丢弃会对人类的生活环境造成严重污染,电池若发生泄露,会危害人类的健康和生态;同时废旧锂电池含有Li、Ni、Co等贵重金属,随意丢弃将造成资源浪费。
1 湿法浸出工艺
废旧锂离子电池正极材料资源化即废旧锂离子电池的深度处理,此过程在废旧锂离子电池的回收过程中起着非常重要的作用,是实现废旧锂离子电池中有价金属回收的关键阶段。目前,废旧锂电池正极材料资源化最常用的浸出技术为湿法浸出工艺,主要包括化学浸出工艺、氨浸出工艺以及生物浸出工艺等。
1.1 化学浸出工艺
通常,正极材料中的Ni、Co、Mn等金属氧化物粉末的纯度很高。金属离子可以通过化学浸出的方法从固体金属氧化物粉末中转移至浸出溶液,从而为后续的直接回收利用或分离提纯提供原料液。化学浸出工艺主要有一步浸出法和两步浸出法。
1.1.1 一步浸出法
一步浸出法通常采用无机酸配合H2O2和还原性有机酸。无机强酸有H2SO4、HCl和HNO3,作为有价金属的浸出酸,H2O2作为还原剂与无还原性的无机强酸联用。
Swain等[7]采用H2SO4-H2O2体系浸出废旧锂离子电池正极材料的有价金属Co和Li。得到最优条件:在75℃条件下,2 mol/L H2O2,5%浓度的H2O2,固液比为100 g/L,反应时间为30 min,Co、Ni的浸出率可以分别达到93%和94%。Chen等[8]在80℃条件下,2 mol/L H2SO4-2%H2O2体系浸出正极材料中的有价金属2 h,随后用分步沉淀法和萃取法实现了多种金属离子的分离和提纯。Jouli´e等[9]研究了HCl、H2SO4、HNO3对锂离子动力电池的浸出效果,研究发现,HCl做浸出酸时浸出效率最高,Co、Ni的回收效率分别为100%和99.99%。Nayl等[10]研究采用“H2SO4+H2O2”浸出剩余金属,实验优化后采用2 mol/L H2SO4和4%H2O2混合溶液进行酸浸。在温度为70℃,固液比为100 g/L,搅拌反应120 min,最终Li、Co、Mn的浸出率分别为98.8%、95.9%、97%。Li等[11]采用2.5 mol/L H2SO4-H2O2体系从废旧电池中浸出有价金属Co。经过多次实验对浸出参数进行了优化,在70℃、固液比为50 g/L的条件下反应1 h,Co的浸出率可以达到97.58%。
在无机酸浸取废旧正极材料中有价金属离子的过程中,H2SO4、HNO3和HCl都是强酸,具有很强的腐蚀性,因此无机酸-还原剂体系的浸取过程对浸出设备的要求比较高,所以近年来开始考虑和探索采用有机酸代替无机酸,如柠檬酸[12]、苹果酸[13]、草酸[14]、琥珀酸[15]和抗坏血酸[16]等浸取废旧正极材料中的有价金属。
周涛等[17]采用苹果酸-H2O2体系浸取废旧电池正极材料,其中苹果酸作为浸出剂,H2O2作为还原剂,探究结果表明在温度为80℃的条件下反应30 min,Li、Co、Ni和Mn的浸出率分别达到98.9%、94.3%、95.1%和96.4%。Li等[18]利用丁二酸-H2O2体系浸取废旧电池正极材料。结果表明,1.5 mol/L丁二酸、4%的H2O2、固液比为15 g/L,在温度为70℃的条件下反应40 min,浸出液中Co和Li的浸出率分别达到100%和96%。Zeng等[19]利用单一的草酸作为浸出剂浸出废旧钴酸锂电池的正极材料,反应结束后过滤,发现草酸作为浸出剂浸出的过程属于液固相非催化反应,浸出反应过程中主要受化学反应控制,多次实验最终Li和Co的回收率分别达到约98%和97%。Nayaka等[20]研究了酒石酸结合抗坏血酸的混合物作为正极材料钴酸锂的浸出酸,0.4 mol/L的酒石酸和0.02 mol/L的抗坏血酸,在80℃下反应5 h,最终Li和Co全部浸出。施平川等[21]利用有机酸葡萄糖酸-H2O2体系对废旧电池正极材料进行浸出,探究过程中发现葡萄糖氧化酶催化氧化葡萄糖,C6H12O7可作为酸浸的浸取剂,H2O2作为浸出的还原剂,实验结果表明,酸浸过程中酸浓度、还原剂量以及温度对浸出效率的影响比较明显,葡萄糖酸对三元正极材料具有良好的酸浸效果和普适性。Zhang等[22]用具有还原性的三氟乙酸为浸出酸,得到的最优实验条件为:在60℃下反应30 min,适当搅拌,其中酸溶液浓度为3 mol/L,固液比为50 g/L,最终Ni、Mn、Co、Li的浸出率分别为
93.0 %、89.8%、91.8%、99.7%。Golmohammadzadeh
等[23]利用不同的有机酸(柠檬酸、Dl-malic酸草酸和乙酸)从废锂离子电池中回收Co、Li。利用反应表面方法(RSM)优化了浸出参数,结果表明温度是最具影响的参数。
综合以上文献可知,有机酸-还原剂浸出体系操作方法简单,对设备腐蚀性小且对环境相对友好。无机酸-还原剂浸出体系具有反应速率快、浸出率高的优点,可运用于工业上处理废旧锂离子电池的主要浸出工艺。
1.1.2 两步浸出法
两步浸出法是在酸浸废旧锂电池正极材料前将其置于NaOH溶液中进行碱煮的一个过程,该方法能够有效地将电极活性物质和Al进行分离,从而减少后续分离纯化过程的影响[24]。
王洪彩[25]将正极材料浸泡至1 mol/L的NaOH溶液15 min以去除正负极集流体铝箔,而后用筛网过滤分离集流体铜箔和活性物质。过滤后得到的产物用H2SO4-H2O2体系浸出,而后在浸出液中分别加入沉淀剂草酸和碳酸钠回收Co和Li。丁欣[26]用NaOH溶液溶解集流体上的Al,使其以NaAlO2的形式进入浸出液溶液中,而后酸浸出,最后Co的回收率可达到99%以上。韩小云等[27]用0.4 mol/L的NaOH溶液溶解废旧磷酸铁锂电池的铝箔和正极材料,固液比为100 g/L,浸泡10 min,最终铝箔与正极材料得以完全分离。
两步浸出法能够有效地将电极活性物质和Al分离,但是碱浸过程中回收到的氢氧化铝质量及本身价值都不高,碱浸后的废液需要用酸处理。
1.2 生物浸出工艺
微生物浸出废旧锂电池正极材料中有价金属的工艺主要是利用特定的微生物以及微生物代谢产物的络合、还原、氧化。微生物浸出工艺可以分为直接作用和间接作用[28-29],直接作用主要是利用微生物分泌酸性物质来提供H+,使得正极材料中有价金属离子得以溶解浸出,同时胞内的氧化酶系统产生氧化的氛围;间接作用主要是利用微生物优先氧化部分金属离子,再利用氧化的离子提供氧化氛围,促使废旧锂离子电池正极材料中有价金属离子浸出溶解。
Mishra等[30]以氧化亚铁硫杆菌为能量源,在浸出培养基中以硫单质和Fe2+为能量源,产生H2SO4、Fe3+等代谢物,这些代谢物有助于分解废电池中的金属。实验研究了废电池生物浸出过程中Fe2+初始浓度、初始pH和固液比对浸出率的影响。实验结果表明Co的生物溶解速度比Li快,同时实验中发现了Fe3+与浸出残渣中的金属沉淀,较高的固液比阻止了这一过程中的细菌活动,因为通常认为金属浓度较高会对细胞产生毒性。Xin等[31]采用氧化硫硫杆菌和氧化亚铁硫杆菌混合浸出废锂离子电池中的Co和Li。结果发现,以氧化硫硫杆菌为能量源时,Li的最高释放值出现在pH值最低的1.54,以氧化亚铁硫杆菌为能量源时,Li的最低释放值出现在pH值最高的1.69。代谢过程中该体系通过产生H2SO4和Fe3+而实现对Co的浸出反应。邓孝荣等[32]用氧化亚铁硫杆菌对锂离子电池正极材料进行浸出。优化后的最佳条件为,Fe2+初始浓度为45 g/L,固液比为3%,接种量5%,在35℃,160 r/min下振荡10 d,Co浸出率达到48.5%。辛亚云[33]运用生物淋滤的方法回收正极材料中的有价金属,主要采用硫-氧化硫硫杆菌体系和混合能源底物-混合菌体系,其中固液比为1%,优化实验并对其反应机理进行分析,结果表明Li在前者体系中的浸出率最高,Ni、Co和Mn在后者体系中的浸出率最高,最终Ni、Li、Co和Mn的平均浸出率均在95%以上,具有很高的回收率。Zeng等[34-35]通过添加催化剂Cu、Ag对正极材料的Co进行生物浸出工艺回收。实验表明,未添加催化剂时Co浸出率只有43.1%。在添加0.75 g/L的Cu2+的条件下,浸出6 d后Co浸出率可以达到99.9%,在添加0.02 g/L的Ag+的条件下,7 d后Co浸出率可以达到98.4%,说明适量的添加Ag+或Cu2+能够提升废旧锂电池中Co的浸出率。
微生物浸出工艺回收废旧锂离子电池正极材料中的有价金属具有浸出率高、对环境友好、工业要求少、工艺简单且浸出成本低等优点,有很好的应用前景[36]。但是,由于微生物浸出工艺中细菌在较高的金属浓度下容易中毒失活,所以只能在低浓度金属离子溶液中反应,导致浸出效率受限制。同时,微生物具有生产周期长,菌种容易被污染、不容易培养且分离浸出液中有价金属比较困难等缺点,将其用于大规模的工业化还有一定的局限性,目前仍处于研究阶段[37]。
1.3 氨浸工艺
研究表明,氨水常作为选择性浸出Cu、Ni、Co的浸出剂,在此过程中不会产生二次浪费,氨浸工艺对复杂电子垃圾的湿法处理具有重要意义[38]。其原理为Co2+和Ni2+能够和氨水形成氨配合物[39],反应方程式为:
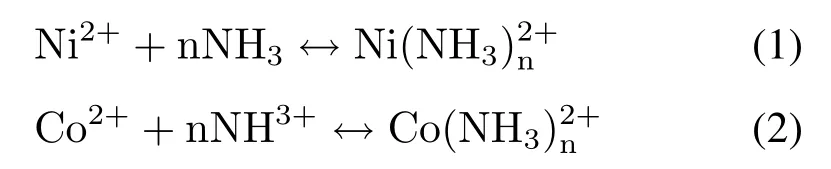
Zheng等[40]采用氨-硫酸铵-Na2SO3体系浸出正极材料,得到Ni、Co、Li的浸出率均达到98.6%,而Mn的浸出率仅为1.36%。经研究发现,Mn4+以(NH4)2Mn(SO3)2的形式络合,最终Ni、Co、Li和Mn分别以金属离子和胺络合物的形式留在溶液中,从而将Ni、Co、Li与Mn分离。Ku等[41]以氨、碳酸铵和亚硫酸铵为氨浸出剂浸出LiMn2O4、LiCoxMnyNizO2、Al2O3和C的正极活性复合物。其中亚硫酸铵作为还原剂,在Ni和Co的氨浸过程中,碳酸铵可以作为pH缓冲液,使浸出液的pH值在浸出过程中变化不大。最后Co和Cu可以完全浸出,Ni的浸出效率中等,Mn和Al的浸出率较低。通过氨浸出回收Co,成本比NaOH低,同时通过添加氨提高浸出溶液的pH值,可以使Mn和Al分离,使得氨浸出工艺具有一定的竞争优势。
2 金属离子分离技术
在湿法冶金技术中,废旧锂离子电池正极材料浸出后,有价金属元素均以离子态存在于浸出液中,如进一步资源化,需选择性地将不同的有价金属Ni、Mn、Co、Li等进行分离。目前,主要的分离提取方法有电化学工艺、萃取工艺、沉淀工艺等。
2.1 电化学工艺
电化学工艺主要依据电解原理,阴极为废旧正极材料,阳极为铅板,通过电解的方式浸出废旧正极材料中的Ni、Li、Co、Mn等有价金属。电解时阳极会发生氧化反应,阴极发生还原反应(替代H2O2的作用),同时铝箔在还原性氛围中无法发生溶解。在回收过程中无需其他的萃取剂和添加剂,为提取有价金属创造了条件。
常伟等[42]采用恒流电解法,浸出废旧锂离子电池正极材料中的Al和Co,电解液为低酸度溶液。在45℃条件下电流密度为15.6 mA/cm2,H2SO4浓度为40 g/L、柠檬酸浓度为36 g/L,反应时间为120 min。电解过程中铝箔受阴极保护,浸出后可以直接回收,且Co和Al的浸出率分别达到90.8%和7.9%。张建等[43]通过建立热力学和动力学模型对废旧正极材料中钴的电解浸出过程进行探讨。以稀H2SO4溶液为电解质浸出废旧正极材料中的Co,热力学研究表明Co元素通过Co(OH)3还原从而得到Co2+,电解过程中,浸出液中的铝箔由于不受阴极的保护从而溶于电解质溶液中,动力学分析表明正极材料从铝箔上的剥离时间影响Co的浸出率。Myoung等[44]采用电化学沉积法回收废旧锂电池正极材料中的Co元素制备氧化钴颗粒。首先将正极材料钴酸锂溶于pH为2.6的HNO3溶液中,以Co2+的形式通过电化学沉积富集在钛电极板上,Co(OH)2经过高温处理得到Co3O4。Rao等[45]以铂电极为负极,镍电极为正极,LiOH调节溶液pH值为11,以HNO3溶解的废旧钴酸锂溶液为电解液,密封在聚四氟容器内,在温度为100℃,电流密度为1.0 mA/cm2的条件下反应20 h,Co和Li以钴酸锂的形式沉积在正极镍电极上。申勇峰[46]首先采用10 mol/LH2SO4浸出废旧锂离子电池正极材料,以浸出液电解液,钴极片为正极,钛板为负极,pH值调节为2~3,电流密度为235 A/m2,电流效率为92.08%,实验结果表明Co的回收率大于93%。
电化学工艺不需要添加其他物质,与其他工艺相比回收的物质纯度较高,但会发生共沉积且能耗较高。
2.2 萃取工艺
萃取法是指借助有机试剂萃取废旧锂电池中的有价金属,常用的萃取剂有磷酸三丁酯(TBP)[47]、膦酸酯(P204)、2-乙基己基膦酸单2-乙基己基酯(P507)[48]、二(2,4,4-三甲基戊基)次磷酸(Cyanex272)[49]、二-(2-乙基己基磷酸)(D 2EHPA)、三辛胺(TOA)、2-羟基-5-壬基苯甲醛肟(N902)[50]等。
丁欣[51]首先通过碱浸出除去Al,后采用H2SO4-H2O2体系浸出,最后浸出液通过P204萃取除杂,实验结果表明H2SO4溶液反萃Co获得高纯度的CoSO4,最后碳酸钠沉淀萃取余液中的Li获得高纯碳酸锂,溶剂萃取法除杂并分离Co、Li,使得Co回收率高达99%。
经研究发现,混合萃取剂萃取效果明显优于单一萃取剂[52]。萃取法回收废旧锂电池正极材料中有价金属的优点有:能耗低、金属分离纯度高、操作简单。但是该方法需要大量的萃取试剂,使用后的萃取溶液处理不当会造成环境污染,同时萃取剂的价格较高,因此萃取法在废旧锂电池正极材料中有价金属回收的应用方面具有一定的局限性。
2.3 沉淀工艺
沉淀法是在湿法浸出后的浸出液中加入沉淀剂,目标金属离子以不溶化合物的形式沉降,达到金属分离的目的。沉淀剂一般有草酸,高锰酸钾等。
潘晓勇等[53]用NaOH将浸出液pH值调至5.0左右,除去大部分Cu、Al、Ni后加入H2C2O4和饱和Na2CO3,浸出液中的Co和Li以CoC2O4和Li2CO3的形式沉降,Co和Li回收率分别达到99%和98%。蔡乐等[54]采用H2SO4-H2O2-过二硫酸钾体系对三元动力锂电池正极材料中的有价金属Ni、Co、Li进行浸出,并通过沉淀制备MnO2颗粒回收Mn。实验结果表明,Mn回收率达到99.5%,Ni、Co和Li的浸出率分别可达到99.8%、99.7%和99.8%。
通过沉淀法分离浸出液中的有价金属,金属的回收率较高且成本低,适用于工业。主要存在的问题是沉降产品纯度低,因此控制有价金属离子沉淀析出的顺序,从而提高产品纯度是目前急需解决的问题。
3 结 语
目前,湿法回收是废旧锂电池回收中最广泛使用的工艺之一,对比国内外锂离子电池的回收工艺可以看出,碱浸出工艺能够有效地将活性物质和Al分离,但同时也增加了废碱处理的酸用量;酸浸出工艺能有效地将锂离子电池正极材料中的有价金属离子浸出,无机酸浸出时会产生废气稍有污染,有机酸相对温和,对环境友好;生物浸出工艺耗酸量比较少,有价金属的浸出率较高但是反应周期较长,菌种易受污染且金属溶液浓度不宜过高。金属离子分离阶段,氨浸工艺过程中能够实现对废物的闭环回收,但是Mn的浸出率比较低;电化学浸出工艺过程中最终产物的纯度和回收率都很高且操作简便,但是对电解液的组成要求较高,耗电量大;萃取法往往面临的是萃取剂难获得且成本高、金属离子在萃取的过程中易流失等问题。因此,锂电池的回收面临着新的挑战和要求,进一步优化锂电池回收工艺并推广至工业化尤为重要,低成本、综合化、多元化和绿色化是废旧锂电池回收工艺的发展方向。
