基于网络药理学探讨牛膝治疗骨关节炎的作用机制
2020-04-14范梦梦范仪铭李峰郭珈宜
范梦梦 范仪铭 李峰 郭珈宜

【摘 要】目的:运用网络药理学探讨牛膝治疗骨关节炎有效成分的作用靶点及通路。方法:通过TCMSP数据库挖掘牛膝的有效成分并预测其作用靶点,利用GeneCards、OMIM等数据库筛选骨关节炎的靶标,运用Cytoscape软件构建药物-活性成分-靶点的关系网络,通过STRING数据库构建靶点蛋白-蛋白相互作用网络,并对关键靶点的生物功能注释及通路进行分析。结果:预测得到20个牛膝治疗骨关节炎的有效成分和47个有效靶点,并推测其作用机制可能与细胞凋亡信号通路、多种物种-细胞凋亡信号通路、肿瘤坏死因子信号通路、白细胞介素-17信号通路等有关,且前列腺素G/H合成酶1、雄激素受体、雌激素受体1 等靶点基因可能起关键性作用。结论:牛膝有效成分可能通过调控炎症因子及细胞凋亡等药理作用发挥治疗骨关节炎的作用。
【关键词】 骨关节炎;牛膝;网络药理学;靶点
【ABSTRACT】Objective:To explore the target and pathway of active ingredients from Niuxi(Radix Achyranthis Bidentatae)for osteoarthritis by network pharmacology.Methods:TCMSP database was used to mine the effective components of Niuxi and predict their target.Databases such as Genecards and OMIM were used to screen the targets of osteoarthritis.The relationship network of drug,active components and target was constructed by using software Cytoscape .The interaction network of target protein was constructed by STRING database.The biological function annotation and pathway of key targets were analyzed.Results:Twenty active components and 47 effective targets of Niuxi for osteoarthritis were predicted,and the mechanism of action might be related to apoptosis signaling pathway,multi species apoptosis signaling pathway,tumor necrosis factor signaling pathway,interleukin-17 signaling pathway,and prostaglandin G/H synthetase 1,androgen receptor,estrogen receptor 1and other target genes may play a key role.Conclusion:The effective components of Niuxi may play a role in the treatment of osteoarthritis by regulating inflammatory factors and apoptosis.
【Keywords】 osteoarthritis;Niuxi;network pharmacology;target
骨关节炎(osteoarthritis,OA)是临床常见的好发于中老年群体的慢性退行性关节疾病,病理表现主要为关节软骨退变损伤、骨赘形成、滑膜炎癥性反应、关节间隙变窄及软骨细胞凋亡。OA发病机制至今尚不明确,其病因涉及多种因素,如年龄、激素、肥胖、遗传、工作性质等[1]。目前,65岁以上人群约一半饱受OA的困扰,致残率可高达53%[2]。网络药理学这一概念最早于2017年由HOPKINS等提出,其通过构建“药物-靶点-疾病”网络,从而全面认识药物活性成分与疾病之间的作用关系,为药物研发提供创新性策略[3]。网络药理学的整体性、系统性特点与中医理论辨证论治、整体观及方剂的配伍原则相统一[4]。本研究在网络药理学理论指导下,研究牛膝治疗OA的作用机制,构建药物-成分-靶点网络,旨在为OA的临床治疗及实验研究提供理论支持。
1 方 法
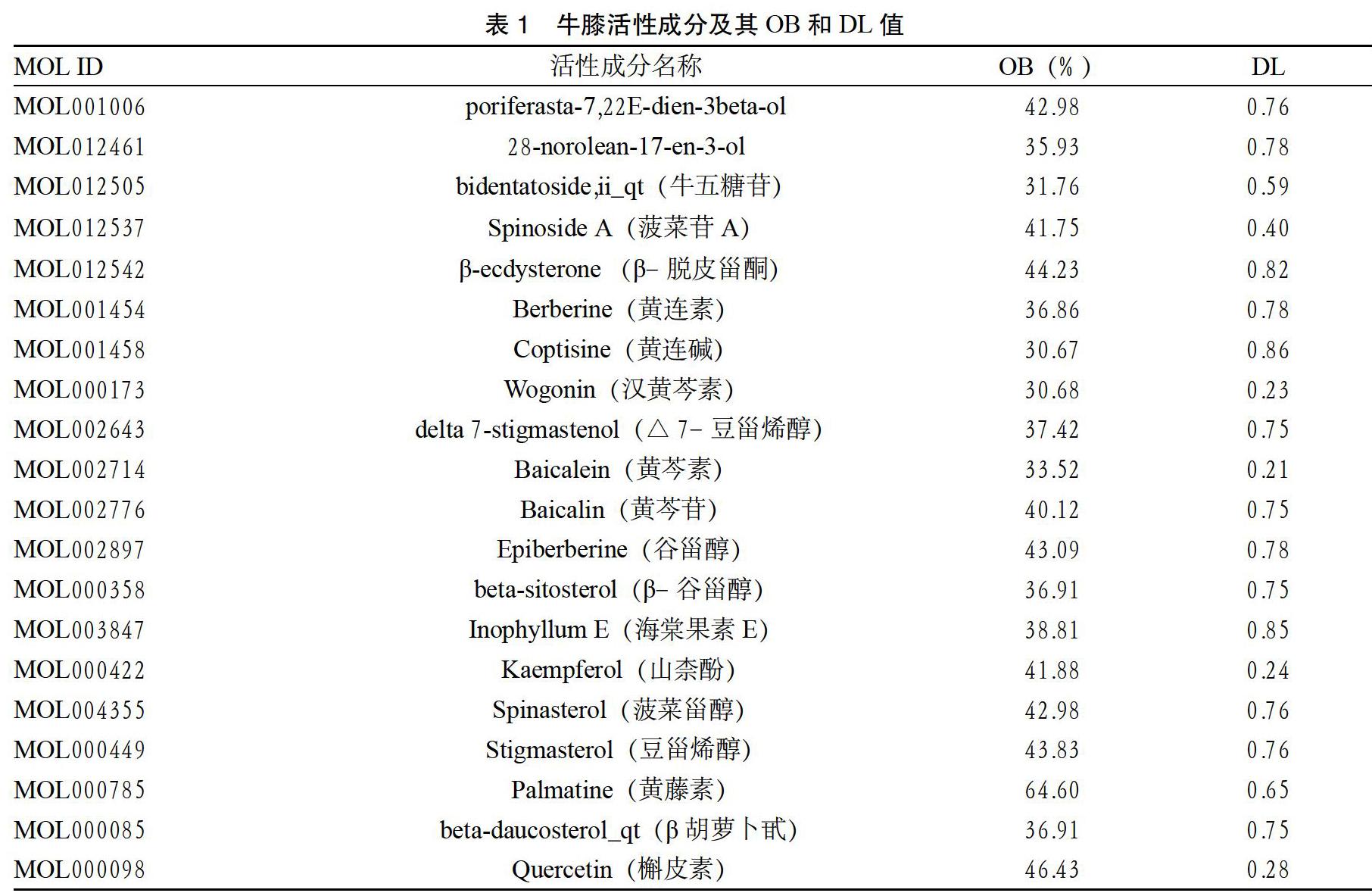
1.1 牛膝活性成分的筛选 检索中药系统药理学数据库和分析平台TCMSP(http://lsp.nwsuaf.edu.cn/ tcmsp.php),对牛膝所含成分数据进行挖掘,通过评价药物化学成分在体内的过程,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18作为筛选条件,筛选牛膝的活性成分[5]。
1.2 相关作用靶点的获取与收集 利用TCMSP数据库中的“靶点预测”功能,预测牛膝入血活性成分作用靶点,并利用perl语言(http://www.perl.org/)校正预测靶点名称。检索GeneCards数据库(http://www.genecards.org/)和OMIM数据库(http://www.ncbi.nlm.nih.gov/omim),收集与OA相关的靶点,合并2个数据库检索后获取的数据,排重后利用R语言(https://www.r-project.org/)将与牛膝有效成分相关的作用靶点和疾病靶点取交集,获得牛膝治疗OA的靶点,并制作韦恩图。
1.3 药物-成分-靶点-疾病网络构建 使用Cytoscape 3.7.1软件(http://www.cytoscape.org)构建牛膝活性成分-作用靶点网络。网络中的节点(Node)代表药物、有效成分与关键靶点;边(Edge)代表药物-成分、成分-靶点、靶点-疾病的连接。整个网络构建展示了药物-成分-靶点-疾病之间的关系,深入解读牛膝治疗OA的作用机制。
1.4 蛋白-蛋白相互作用网络(PPI)的构建与分析 运用STRING数据库(https://string-db.org)预测蛋白质间的相互作用。STRING数据库采用不同方式获取预测结果并进行评分,分值越高,PPI网络结果的置信度越高。本研究利用STRING数据库的“Multiple Proteins”功能,并设定“物种”为人类(Homo Sapiens),将牛膝治疗OA的关键靶点输入STRING数据库进行检索,设置分值 > 0.4,便可构建PPI网络。
1.5 关键靶点生物功能注释及通路分析 本研究运用perl语言工具将牛膝治疗OA的关键靶点名称转换为entrez ID,并以R语言为平台,通过Bioconductor、ClusterProfiler等工具以P < 0.05为条件,进行富集分析,并将富集结果可视化。Bioconductor是以R语言为平台,并为高通量基因组数据提供多种分析和理解方法的分析工具,其提供了含人类在内的19个物种的GO注释信息[6]。ClusterProfiler也是基因数据分析的R语言工具,其利用Bioconductor提供的GO注释信息和KEGG pathway数据库(http://rest.keggjp/link/hsa/pathway)进行信号通路富集分析。
2 结 果
2.1 牛膝活性成分的筛选 运用TCMSP数据库检索得到牛膝有效成分176个,以OB ≥ 30%和DL ≥ 0.18为筛选条件,获得牛膝的潜在活性成分20个。见表1。
2.2 牛膝入血活性成分治疗OA的潜在作用靶点预测 通过TCMSP数据库中的靶点预测筛选最终得到牛膝入血活性成分的作用靶点100个;通过GeneCards平台和OMIM平台收集OA相关靶点,合并去重后最终获得疾病靶点1301个。运用R语言“VennDiagram”程序包将牛膝和OA靶点取交集,最终得到47个交集靶点,绘制韦恩图。见图1。
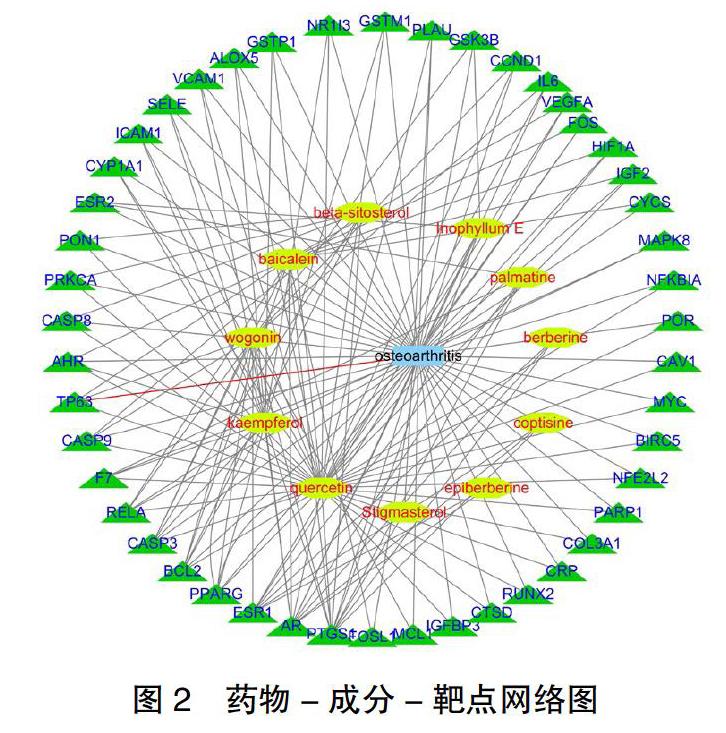
2.3 牛膝治疗OA的药物-成分-靶点网络构建 将牛膝活性成分及其治疗OA的作用靶点信息导入Cytoscape 3.7.0软件,构建药物-成分-靶点网络。见图2。图中黄色点代表牛膝的药物活性成分,绿色点代表牛膝治疗OA的作用靶点,边代表活性成分和作用靶点之间的联系,图中结果提示槲皮素(Quercetin)、黄芩素(Baicalein)、β-谷甾醇(beta-sitosterol)、前列腺素G/H合成酶1(PTGS1)、雄激素受体(AR)、雌激素受体1(ESR1)等是牛膝治疗OA的关键成分或靶点。图中同一靶点可对应多个活性成分,说明牛膝治疗OA发挥着多成分、多靶点的优势。
2.4 牛膝治疗OA的关键靶点PPI网络分析 运用STRING数据库,输入牛膝入血活性成分治疗OA的靶点,设定置信度評分> 0.4,并将游离于网络之外的蛋白予以剔除,最终得到PPI网络。见图3。
网络中的“节点”代表靶点,每个节点的连接节点越多,说明该靶点在网络中处于核心地位。运用R语言绘制网络中关键靶点的条形图,见图4。
结果表明,白细胞介素-6(IL-6)、CASP3、VEGFA、MAPK8、MYC等蛋白的邻接基因较多,说明这些蛋白在网络中占有重要的核心地位。
2.5 生物功能及通路分析 运用R语言对疾病与药物靶点47个交集基因进行GO富集分析和KEGG通路富集分析。GO富集分析结果显示,牛膝治疗OA的关键靶点富集显著表现的前10个生物学功能为DNA结合转录激活剂活性,RNA聚合酶Ⅱ特异性(12个靶点),核受体活性(6个靶点),转录因子活性,直接配体调控序列特异性DNA结合(6个靶点),RNA聚合酶Ⅱ转录因子结合(7个靶点),类固醇激素受体活性(5个靶点),激活转录因子结合(5个靶点),转录辅因子结合(4个靶点),半胱氨酸型内肽酶活性参与凋亡过程(3个靶点),E-box binding(4个靶点),组蛋白脱乙酰酶结合(5个靶点)。结果表明,牛膝有效成分能够通过调控多种生物学途径发挥治疗OA的作用。见图5。
KEGG通路富集得出104条结果,其中102条通路的P < 0.01。以P值和通路富集基因的数量作为筛选条件,取前20个通路进行分析,结果显示,基因明显富集在细胞凋亡信号通路、多种物种-细胞凋亡信号通路、肿瘤坏死因子(TNF)信号通路、IL-17信号通路、泌乳素信号通路等通路上,见图6。
3 讨 论
OA属中医学“痹证”范畴。OA产生的病因外与风、寒、湿邪侵袭,痹阻经络,气血运行失常有关;内因为肝肾亏虚,筋骨失养。本虚标实是导致OA产生的重要病机。在治疗上以补肝肾强筋骨、温经通络为主,兼以祛风散寒除湿。牛膝为四大怀药之一,具有补肝肾、强筋骨、逐瘀通经的作用,是临床治疗OA的常用中药材。在中医药治疗OA的相关文献中,牛膝的使用频次居第2位[7]。
本研究检索TCMSP数据库,以OB≥30%和DL≥0.18为筛选条件,得到20个牛膝的潜在活性成分,经与OA疾病靶点对接,得到11个活性化学成分,且均有相关文献进行报道,分别为海棠果素E[8]、黄芩苷[9]、黄连碱[10]、黄连素[11]、汉黄芩素[12]、黄藤素[13]、山柰酚[14]、槲皮素[15]、β-谷甾醇[16]、谷甾醇[17]、豆甾烯醇[18]。药物-成分-靶点网络图中可看出,槲皮素、山柰酚、β-谷甾醇是牛膝治疗OA的关键成分。其中,槲皮素又名槲皮黄素,是黄酮类化合物,其能够抑制炎症递质的释放,减少神经元细胞凋亡[19],抑制基质金属蛋白酶的表达,清除氧自由基,有效减少氧化应激引起的各种不良反应[20]。山柰酚能够抑制核转录因子-κB信号通路相关蛋白的活化和炎症介质的释放,进而发挥抗炎作用[21]。β-谷甾醇是植物甾醇类成分之一,在抗炎、抑制肿瘤、调节免疫等方面发挥着重要作用,β-谷甾醇的摄入量与慢性病发生率有一定的关系[22]。
OA发病机制复杂,疾病的产生与氧化应激反应、激素水平、炎症因子的大量释放等因素密切相关。本研究共预测到47个牛膝治疗OA的关键靶点,PTGS1、AR、ESR1是药物-成分-靶点的核心靶点。PTGS又称为环氧合酶(COX),其分为2个亚型,即COX-1和COX-2。有研究表明,自身免疫性疾病和炎症性疾病与PTGS有密切的关系[23]。AR是主要存在于睾丸间质和支持细胞内的核受体,能有效抑制氧化应激反应,调节由血管紧张素Ⅱ引发的血管收缩,且与一氧化氮的生成有着密切关系[24]。ESR1信号通路介导能够促使雌激素发挥作用,增加骨膜的骨形成,减少破骨细胞的数量,抑制骨小梁和皮质内骨表面的骨吸收[25]。
本研究将检索到的靶点运用GO和KEGG富集化分析,得到与OA密切相关的通路,如细胞凋亡信号通路、多种物种-细胞凋亡信号通路、TNF信号通路、IL-17信号通路等。这些通路与OA的产生关系密切。
本研究结果表明,牛膝治疗OA有着多成分、多靶点、多通路的特点,对所预测出来的靶点及通路需要进行科学验证。综上所述,本研究运用网络药理学方法研究牛膝治疗OA的机制,阐述了多靶点和多成分之间错综复杂的网络关系,为进一步系统研究牛膝治疗OA的临床应用及研究提供理论依据。
参考文献
[1] 马玉环,郑文伟,林平冬,等.骨关节炎软骨退变与炎症的关系[J].风湿病与关节炎,2015,4(8):50-53.
[2] 兰维娅,唐芳,马武开,等.基于经典Wnt/β-catein信号通路的中医药干预膝骨关节炎的研究述评[J].风湿病与关节炎,2018,7(3):66-69.
[3] 吴丹,高耀,向欢,等.基于网络药理学的柴胡抗抑郁作用机制研究[J].药学学报,2018,53(2):210-219.
[4] LM S,LF L,HX Z,et al.Network pharmacology-based study on intervention mechanism of Huanglian Jiedu decoction in the treatment of Alzheimer's disease[J].Acta Pharmaceutica Sinica,2017,52(8):1268-1275.
[5] 郭璐,夏道宗,骆叶姣,等.基于网络药理学探讨土茯苓治疗痛风的作用机制[J].中草药,2019,50(6):1413-1418.
[6] 王玉涛,庞雪,李安举.茵陈治疗深静脉血栓形成的网络药理学机制研究[J].中药新药与临床药理,2019,30(12):1464-1473.
[7] 李开言,张留记,屠万倩,等.牛膝有效部位含药血清联用对损伤软骨细胞的增效作用[J].中國老年学杂志,2019,39(9):2203-2207.
[8] 马涛,王琳,程桂芳,等.海棠果素(红厚壳烯酮内酯)类似物的合成及其初步抗炎活性[J].药学学报,2010,45(10):1265-1269.
[9] LIANG R,CHEN CH,AI XC,et al.Structural Origins of the Differential Antioxidative Activities between Baicalein and Baicalin[J].Chinese Journal of Magnetic Resonance,2010,27(1):132-140.
[10] 张玲,熊维建,张太君.黄连碱对慢性肾功能衰竭大鼠的治疗作用及其机制研究[J].中国现代应用药学,2017,34(1):30-33.
[11] 庾国桢,彭皓均,黄秀芳,等.黄连素对Aβ25-35诱导的HT22细胞TLR4/NF-κB信号通路的影响[J].中国实验方剂学杂志,2018,24(24):164-170.
[12] 任晓东,符伟,张晓芸,等.天然产物汉黄芩素的研究进展[J].中国新药杂志,2011,20(9):777-784.
[13] HU YJ,YU OY,DAI CM,et al.Site-selective binding of human serum albumin by palmatine:spectroscopic approach[J].Biomacromolecules,2010,11(1):106-112.
[14] XU TF,SHAN H,HUANG QR,et al.Kaempferol attenuates liver fibrosis by inhibiting activin receptor-like kinase 5[J].J Cell Mol Med,2019,23(9):6403-6410.
[15] RUIZ-MIYAZAWA KW,STAURENGO-FERRARI L,MIZOKAMI SS,et al.Quercetin inhibits gout arthritis in mice:induction of an opioid-dependent regulation of inflammasome[J].Inflammopharmacology,2017,25(5):555-570.
[16] RAHIMIFAD M,MANAYI A,BAEERI M,et al.Investigation of β-sitosterol and prangol extracted from achillea tenoifolia along with whole root extract on isolated rat pancreatic islets[J].Iran J Pharm Res,2018,17(1):317-325.
[17] DENG SS,WEI T,TAN KL,et al.Phytosterol content and the campesterol:sitosterol ratio influence cotton fiber development:role of phytosterols in cell elongation[J].Sci China Life Sci,2016,59(2):183-193.
[18] YADAV M,PARLE M,JINDAL DK,et al.Protective effects of stigmasterol against ketamine-induced psychotic symptoms:possible behavioral,biochemical and histopathological changes in mice[J].Pharmacol Rep,2018,70(3):591-599.
[19] 朱玲玲,張洋,窦勤玲,等.槲皮素对U937细胞迁移和侵袭能力及MMP-2,MMP-9表达的影响[J].中国实验方剂学杂志,2018,24(16):146-151.
[20] 超黄,黄庆华,尤荻,等.槲皮素在创伤性脑损伤治疗中潜在分子机制和临床应用的可行性[J].中国组织工程研究,2019,23(23):3760-3766.
[21] 周运江,王虎,李丽,等.山柰酚对脂多糖诱导的肥大细胞炎症反应的抑制作用[J].药学学报,2015,50(6):702-707.
[22] 张忠泉,邢煜君,胡国强,等.β-谷甾醇诱导人肝癌HepG2细胞凋亡机制研究[J].中国中药杂志,2011,36(15):2145-2148.
[23] ANYONA SB,HENGARTNER NW,RABALLAH E,et al.
Cyclooxygenase-2 haplotypes influence the longitudinal risk of malaria and severe malarial anemia in Kenyan children from a holoendemic transmission region[J].J Hum Genet,2019,10(11):1-13.
[24] YASUMASA I,KEN-ICHI A,SUMIKO Y,et al.Androgen-androgen receptor system protects against angiotensin Ⅱ-Induced vascular remodeling[J].Endocrinology,2009,150(6):2857-2864.
[25] SCALCO RC,TRARBACH EB,ALBUQUERQUE EVA,et al.ESR1 polymorphism(rs2234693)influences femoral bone mass in patients with Turner syndrome[J].Endocr Connect,2019,8(11):1513-1519.
收稿日期:2020-01-29;修回日期:2020-03-29
