补肾益髓胶囊调节实验性自身免疫性脑脊髓炎小鼠小胶质细胞的作用及其机制研究
2020-04-14王蕾孙豪计婧赵晖薛冰金良韵齐放李君玲樊永平
王蕾 孙豪 计婧 赵晖 薛冰 金良韵 齐放 李君玲 樊永平
多发性硬化(multiple sclerosis, MS)是一种自身免疫介导的中枢神经系统(central nervous system, CNS)慢性炎性脱髓鞘疾病。MS临床表现复杂,常见有肢体无力、肢体麻木疼痛、视力下降、大小便异常等症状,甚则瘫痪、失明或死亡。85%~90%的患者表现为复发缓解型MS,其高复发率和高致残率严重危害人类的健康生命[1-2]。MS以炎症、脱髓鞘和轴突损伤为主要病理特征。MS的确切发病机制尚未阐明,但与自身免疫反应有关。小胶质细胞是CNS固有的免疫细胞,小胶质细胞特异性表达钙离子结合蛋白-1(ionized calcium-binding adapter molecule-1,Iba-1)和CD68,过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptors-γ,PPAR-γ)信号通路可以调节小胶质细胞活化[3]。在MS的病理过程中,小胶质细胞激活后,炎性反应占主导,M1型小胶质细胞增多,在发挥吞噬作用的同时也释放大量促炎因子,如白细胞介素-1β(interleukin-1β,IL-1β)等,加剧炎症反应,使大量炎性细胞浸润组织,导致神经损伤,最终演变成神经退行性病变[4]。前期研究证实,补肾益髓(BushenYisui,BSYS)胶囊能明显降低MS复发率,改善其临床症状和生存率等[5-6],重建CNS免疫稳态和促进神经修复[7-8]。近期研究发现,本方可明显对MS模型——实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠有神经保护作用[9-10],但其分子调控机制尚未明确。故本实验利用EAE小鼠模型,从小胶质细胞角度,深入探讨BSYS对EAE小鼠的神经保护的作用机制。
1 材料与方法
1.1 实验动物
SPF级雌性C57BL/6小鼠,6~8周龄,体重15~17 g, 80只,由中国人民解放军军事医学科学院实验动物中心提供,合格证号为SCXK(军)2012-0004,在首都医科大学实验动物中心饲养,合格证号为SYXK(京)2015-0012。实验室温度18~22℃,相对湿度30%~50%,每12小时进行昼夜交替光照,自由饮食和饮水,每日更换干净垫料。所有实验方案经首都医科大学动物福利委员会审查批准。
1.2 实验药物
醋酸泼尼松片(prednisone acetate,PA)由天津力生制药有限公司生产。补肾益髓胶囊由北京亚东生物制药有限公司制备,其药物组成和剂量为生地黄208 g、熟地黄208 g、制何首乌208 g、浙贝母125 g、益母草208 g、水蛭69 g、全蝎42 g、酒大黄42 g、天麻69 g、连翘125 g,以上十味,浙贝母研细粉,其余九味加水煎煮两次,合并煎液,药液过滤后减压浓缩成稠膏,加入浙贝母细粉混匀,装入胶囊,制成1000粒备用。
1.3 对照组大鼠卵巢组织存在少
髓鞘少突胶质细胞糖蛋白(myelin oligodendroglia glycoprotein,MOG)35-55由北京旭和源生物科技有限公司合成;完全弗氏佐剂(complete Freund’s adjuvant,CFA),批号:SLBH7316V,购自美国Sigma公司;灭活结核分枝杆菌(mycobacterium tuberculosis,MTB,H37Ra),批号:4283842,购自美国BD公司;百日咳毒素(pertussis toxin,PTX),批号:SLBP1591V,购自美国Sigma公司。Iba-1(货号:ab15690)和CD68(货号:ab31630)均购于英国Abcam公司;IL-1β和IL-4试剂盒(货号:AE900731Mu、AE900245Mu)均购自浙江AMEKO公司。PCR引物由江苏爱必梦生物技有限公司合成;RNA检测相关试剂购于北京天根生化科技有限公司等。
1.4 EAE小鼠模型制备
用生理盐水将MOG35-55稀释为250 μg/mL,与等量 CFA乳液混合,将MTB加入到混合液中,将MTB的浓度调至2 mg/mL,并将上述液体放入注射器内反复抽推成油包水乳剂,在造模当天和第7天给予小鼠背部皮下四点注射0.2 ml抗原乳剂。造模当天及48小时内腹腔注射PTX 500 ng,建立EAE小鼠模型,从体重下降、神经评分和脱髓鞘等病理变化作为模型建立的标准。
1.5 分组及给药
将造模成功的80只小鼠随机分为4组,分别是正常组、模型组、醋酸泼尼松组及补肾益髓胶囊组,每组20只。正常组小鼠以等量生理盐水代替。造模后开始进行小鼠灌胃给药,补肾益髓胶囊组给予剂量为3.02 g生药/(kg体重),模型组和醋酸泼尼松组均灌服等量蒸馏水,待小鼠发病后,醋酸泼尼松组开始给予5 mg/(kg体重)灌胃。每天1次,连续40天。
1.6 样本处理和检测指标
分别于第23天(急性期)和第40天(缓解期)取小鼠脑和脊髓。其中,每期随机选取2~3只小鼠用2%多聚甲醛和2%戊二醛灌注,取小鼠脑及脊髓1 mm3小块,2%戊二醛固定2小时,于0.1 mol 磷酸缓冲液中4℃储存,用于透射电镜观察;另取3只小鼠用多聚甲醛灌注固定,取小鼠脑及脊髓,石蜡包埋切片,用于IHC检测;再取4只小鼠给予2%异氟烷吸入麻醉,取小鼠大脑及脊髓用于ELISA和qRT-PCR等检测。
1.6.1 小鼠体重和疾病负荷的观察 每天对小鼠进行称重和神经评分观察。采用15分评分法[11]评估小鼠尾巴和四肢的状态。尾巴分3个等级: 0分为正常,1分表示尾巴半瘫痪,2分表示尾巴完全瘫痪;四肢分四个等级(前肢或后肢要单独评估):0为正常,1分表示步态不稳,2分表示轻瘫,3分表示完全瘫痪。通过累计分数得出评分,死亡等于15分。再将小鼠每天的神经评分累加,即为疾病负荷,反映小鼠总体发病情况。
1.6.2 透射电镜观察小鼠神经髓鞘超微结构的变化 取小鼠脑和脊髓小块,清洗后,1%锇酸固定2小时,乙醇梯度脱水,包埋剂包埋样品,45℃下聚合24小时,70℃下聚合48小时,超薄切片,铅铀染色。透射电镜观察。随机选择多个视野观察,采用图像分析软件对小鼠脑和脊髓髓鞘和轴突直径进行半定量分析,计算髓鞘与轴突直径比值G-ratio[12],以评价神经损伤程度。
1.6.3 IHC法检测小鼠脑和脊髓Iba-1和CD68蛋白表达 小鼠脑和脊髓切片二甲苯脱蜡,梯度乙醇洗脱至水,柠檬酸修复抗原后,用3%H2O2室温孵育后血清封闭。去封闭液后,滴加一抗液Iba-1(1∶200)和CD68(1∶200),4℃孵育12小时。37℃复温1小时,依次加入二抗试剂,置于37℃孵育,滴加DAB显色,梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察。每张切片随机选取多个不同的视野,测定Iba-1和CD68积分光密度(integral optical density,IOD)。
1.6.4 ELISA法测定小鼠脑和脊髓IL-1β和IL-4细胞因子的表达 按照小鼠IL-1β和IL-4试剂盒说明书进行实验操作,用酶标仪测定450 nm处吸光值,根据标准曲线计算样本的浓度,所有数据除以正常值的比值表示。
1.6.5 qRT-PCR法检测小鼠脑及脊髓中PPAR-γ mRNA表达 取小鼠脑或脊髓30~40 mg,采用Trizol法提取总RNA,分光光度计测定260/280比值和RNA浓度。PCR引物采用Gene Bank Accession公布的序列,通过primier 5.0计算机软件设计,由中国江苏爱必梦生物科技有限公司合成,引物及反应体系见表1。扩增条件如下:变性1,90℃,30秒;退火温度58℃,20分钟;变性2,95℃,30秒;PCR 循环,95℃,5秒;45~48循环分别为50℃,10秒,以及74℃,15秒,收集数据,分析qRT-PCR的溶解曲线、扩增曲线,以基因GAPDH为内参对照,采用△△Ct方法分析基因的表达量。

表1 引物反应序列
1.7 统计学处理
2 结果
2.1 补肾益髓胶囊对EAE小鼠发病率、死亡率及潜伏期的影响
模型组与醋酸泼尼松组发病率均为90%,补肾益髓胶囊组为85%;造模各组死亡率均为5%;模型组小鼠潜伏期最短,为(13.7±1.1)天;醋酸泼尼松组及补肾益髓胶囊组潜伏期有不同程度的延长,分别为(13.9±1.0)天和(14.8±1.5)天,其中,补肾益髓胶囊组与模型组比较,具有统计学意义(P<0.05),见表2。

表2 各组EAE小鼠发病率、死亡率及潜伏期变化比较
注: 与模型组相比,aP<0.05。
2.2 补肾益髓胶囊对EAE小鼠体重的影响
造模前各组小鼠体重比较无统计学差异(P<0.05)。正常组体重始终呈上升趋势,造模后模型组体重缓慢上升,从第15天后体重开始明显下降(P<0.05,P<0.01)。醋酸泼尼松组及补肾益髓胶囊组造模后体重缓慢上升,于发病前第9~12天稍有下降,但从第13天起,体重呈缓慢上升,与模型组相比,具有统计学差异(P<0.05)。见图1。
2.3 补肾益髓胶囊对EAE小鼠疾病负荷的影响
采用15分评分法进行小鼠神经评分观察,将小鼠神经评分累加即为疾病负荷。与模型组比较,醋酸泼尼松组和补肾益髓胶囊组小鼠的疾病负荷显著降低(P<0.05)。见图2。
2.4 补肾益髓胶囊对EAE小鼠神经髓鞘损伤的影响
透射电镜所示,正常组小鼠脑和脊髓的神经髓鞘板层结构完整致密;模型组髓鞘板层结构松散、分离、密度下降,甚至髓鞘缺失,轴突萎缩,间隙变大且出现空泡;醋酸泼尼松组和补肾益髓胶囊组的上述病理变化均有不同程度的改善(图3~4)。G-ratio是髓鞘中内径与外径的比值,可以反映髓鞘损伤与脱失程度。在造模后第23天和40天时,模型组小鼠脑及脊髓G-ratio比值较正常组明显上升(P<0.01),而醋酸泼尼松组与补肾益髓胶囊组小鼠G-ratio比值较模型组显著降低(P<0.01)。见表3。

注:与正常组相比,aP<0.01;与模型组相比,bP<0.05。
图1各组EAE小鼠体重的变化
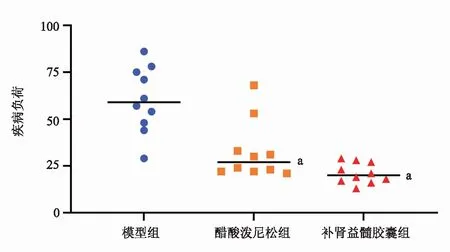
注:与模型组相比,aP<0.05。
图2各组EAE小鼠疾病负荷的变化
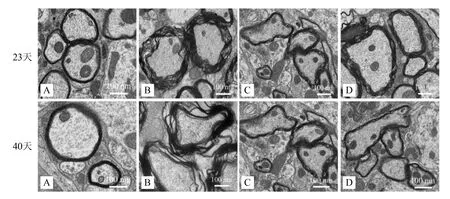
注:A 正常组;B 模型组;C 醋酸泼尼松组;D 补肾益髓胶囊组。
图3各组EAE小鼠脑的髓鞘超微结构变化(透射电镜×20,000)
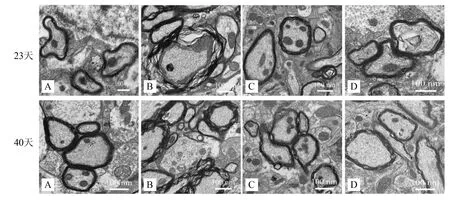
注:A 正常组;B 模型组;C 醋酸泼尼松组;D 补肾益髓胶囊组。
图4各组EAE小鼠脊髓的髓鞘超微结构变化(透射电镜×20,000)
2.5 补肾益髓胶囊对EAE小鼠脑及脊髓Iba-1表达的影响
Iba-1为钙离子结合蛋白,是MG的标志性蛋白,为观察EAE小鼠MG数量变化,采用IHC法检测了各组小鼠Iba-1蛋白表达。结果表明,造模后第23天和40天,与正常组相比,模型组小鼠脑及脊髓Iba-1表达显著升高,差异有统计学意义(P<0.01);与模型组相比,醋酸泼尼松组和补肾益髓胶囊组Iba-1表达明显降低(P<0.05或P<0.01)。见表4,图5~6。

表3 各组EAE小鼠脑及脊髓髓鞘G-ratio的变化比较
注: 与正常组相比,aP<0.01;与模型组相比,bP<0.01。
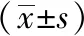
表4 各组EAE小鼠脑及脊髓Iba-1蛋白的表达比较
注: 与正常组相比,aP<0.01;与模型组相比,bP<0.05,cP<0.01。
注:A 正常组;B 模型组;C 醋酸泼尼松组;D 补肾益髓胶囊组。
图5各组EAE小鼠脑Iba-1蛋白的表达(IHC×400)

注:A 正常组;B 模型组;C 醋酸泼尼松组;D 补肾益髓胶囊组。
图6各组EAE小鼠脊髓Iba-1蛋白的表达(IHC×400)
2.5 补肾益髓胶囊对EAE小鼠脑及脊髓CD68表达的影响
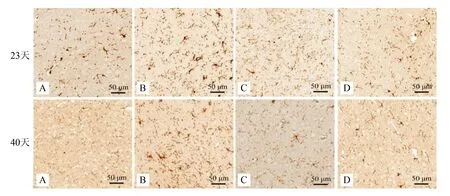
研究显示,在炎症免疫反应中,CD68阳性细胞表达增多与小胶质细胞激活相关,因此,使用IHC法检测了各组小鼠CD68蛋白表达。结果显示,造模后第23天和40天,与正常组比较,模型组脑及脊髓中CD68表达显著升高(P<0.01),与模型组相比,醋酸泼尼松组和补肾益髓胶囊组CD68表达明显下降(P<0.05或P<0.01)。见表5,图7~8。
2.6 补肾益髓胶囊对EAE小鼠脑IL-1β和IL-4表达的影响
结果表明,造模后第23天和第40天,与正常组比较,模型组脑IL-1β明显升高(P<0.05或P<0.01),而IL-4显著下降(P<0.05或P<0.01)。与模型组相比,醋酸泼尼松组和补肾益髓胶囊组IL-1β明显下降(P<0.01),而醋酸泼尼松组和补肾益髓胶囊组IL-4显著上调(P<0.05或P<0.01)。见表6。
表5 各组EAE小鼠脑及脊髓CD68蛋白的表达比较
注: 与正常组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01。
注:正常组;B 模型组;C 醋酸泼尼松组;D 补肾益髓胶囊组。
图7各组EAE小鼠脑CD68蛋白的表达(IHC×400)
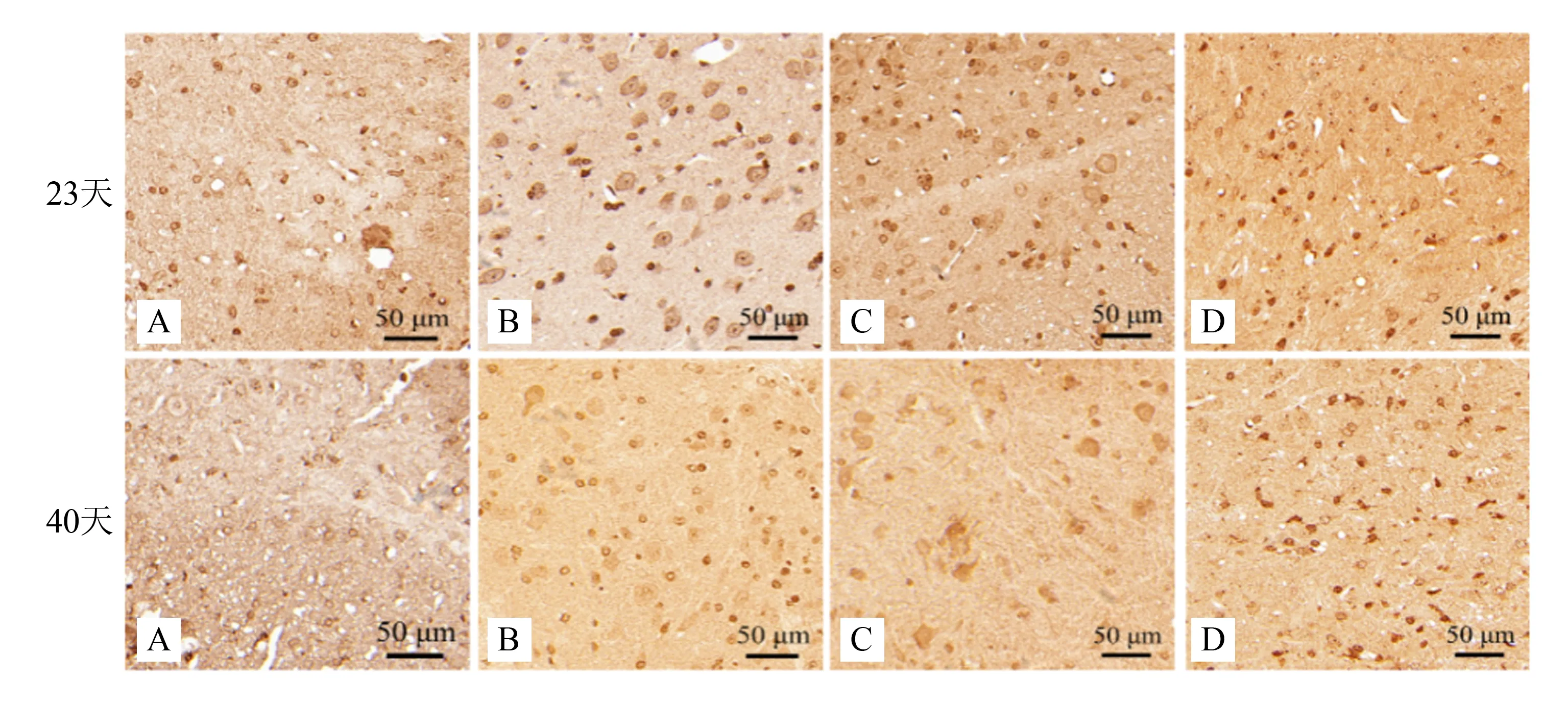
注:A 正常组;B 模型组;C 醋酸泼尼松组;D 补肾益髓胶囊组。
图8各组EAE小鼠脊髓CD68蛋白的表达(IHC×400)

表6 各组EAE小鼠脑IL-1β及IL-4的变化
注: 与正常相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01。
表7 各组EAE小鼠脑及脊髓PPAR-γ mRNA表达的变化
注: 与正常组相比,aP<0.05,bP<0.01;与模型组相比,cP<0.05。
2.7 补肾益髓胶囊对EAE小鼠脑及脊髓PPAR-γ mRNA表达的影响
采用qRT-PCR法检测了小鼠脑及脊髓PPAR-γ mRNA表达。结果显示,在第23天和第40天时,与正常组比,模型组小鼠脑及脊髓PPAR-γ mRNA表达显著降低(P<0.05或P<0.01);与模型组比,醋酸泼尼松组和补肾益髓胶囊组小鼠脑中PPAR-γ mRNA表达明显升高(P<0.05),第40天时醋酸泼尼松组小鼠脊髓PPAR-γ mRNA升高明显(P<0.05),而第23天时补肾益髓胶囊组小鼠脊髓PPAR-γ mRNA升高显著(P<0.05)。见表7。
3 讨论
本课题组基于长期对MS的临床研究,认为MS与“痿证”的“骨痿”最为接近[13],肾主骨生髓,因此本病与肾的关系最为密切,《素问·痿论篇》有云:“肾气热,则腰脊不举,骨枯而髓减,发为骨痿。” MS的病机是五脏失衡,核心在肾,肾虚髓亏是本。在分析文献报道的851例MS患者和收集的500例MS患者证候特点的基础上[14-15],总结出本病的基本病机是肝肾阴虚兼痰瘀阻络,肾虚髓亏,神经髓鞘脱失,加之痰瘀阻滞,神经髓鞘修复困难,故治宜滋补肝肾,化痰活血通络,方为补肾益髓方。本方以生地黄、熟地黄等滋阴补肾,填精益髓,辅以浙贝母等清热化痰,益母草、水蛭、全蝎等活血通络,补肾可使脑髓得充,气血通利,以增强化痰活血之功,正如《景岳全书》曰“峻补真阴,使血气流利”;化痰活血可祛除痰瘀之邪,有利于补肾作用的发挥,诸药相合,标本同治,攻补兼施,共行补肾化痰活血之功。本方制成胶囊制剂,获北京市药品监督管理局批准(临10003)。在临床研究中运用本方治疗MS患者取得了显著疗效。本课题组对补肾益髓胶囊治疗60例MS患者进行了随机、对照、盲法试验,发现本方显著降低中医症状评分、伤残等级评分、MS影响量表和修订疲劳影响量表评分,优于单独西药组;磁共振波谱及弥散张量成像发现本药能促进神经功能康复,明显改善了患者的生存质量[6]。基础实验研究证明本药对EAE小鼠也有明显的神经保护作用和促进神经再生修复[7-10]。本实验研究显示,补肾益髓胶囊能够延长EAE小鼠的潜伏期,提高小鼠降低的的体重,并减轻了疾病负荷,减少了髓鞘脱失和神经轴突损伤,极大程度上保护了神经的完整性,这些数据均为补肾益髓胶囊的神经保护作用提供了依据。但对小胶质细胞的调节作用及其作用机制还不清楚。
在MS或EAE发展过程中,几类免疫细胞均可产生IL-1β和IL-4等细胞因子。研究证实,IL-1β在MS患者的血液、脑脊液和中枢神经病变中均有明显表达,EAE小鼠的病情在IL-1R和IL-1β缺乏中明显减轻[16-17],含IL-4的细胞外囊泡对MS小鼠神经炎症具有调节作用[18]。MG是脑内固有的免疫细胞,在神经炎症中MG由静息态被激活为M1或M2型极化态[19]。MG特异性表达Iba-1抗原,M1型MG细胞表达CD68等抗原,并释放IL-1β、IL-6等因子,具有促进炎症反应和杀灭病原体等作用,过度表达对神经组织也造成损害;M2型细胞可分泌IL-4等细胞因子,可抑制神经炎症。在MS急性期的脱髓鞘区域,M1型细胞明显增多,在缓解期也表现为M1型细胞升高,造成神经损伤,并使少突胶质前体细胞分化受阻,相关髓鞘蛋白等表达减弱,从而导致髓鞘再生失败[20]。因此,降低M1型MG表达,调节M1/M2趋于平衡,是髓鞘再生修复过程的关键环节[21-22]。
本实验发现EAE小鼠脑和脊髓中的Iba-1和CD68表达明显增多,IL-1β也有明显升高,而IL-4的含量则明显降低,上述结果表明在EAE病理条件下,MG迅速激活,大量促炎因子被释放,导致CNS急性炎症反应,IL-1β通过与其同源的IL-1Rs结合,以自分泌或旁分泌的方式进一步刺激其自身产生,放大炎症损伤信号[23],这些细胞毒性物质的产生损伤了神经组织,病理表现脑和脊髓组织存在大量炎症浸润和形成袖套样改变,出现脱髓鞘和轴突变性。但经过补肾益髓方处理后,能够明显下调Iba-1和CD68表达,减少IL-1β的释放,显著增加IL-4含量,提示本方抑制CNS中MG或外周巨噬细胞的募集,在一定程度上抑制了MG的激活,抑制了过度的免疫反应,增强MG抗原递呈作用,吞噬组织及髓鞘的碎片,减轻了EAE炎性损伤,因此神经轴突和髓鞘得到了保护。
PPARs是一类由配体激活的核转录因子[24],其中激活的PPAR-γ可抑制单核细胞炎症因子TNF-α、IL-1、IL-2等生成,产生抗炎作用[25],并且还可抑制MG向M1极化,抑制促炎因子产生,发挥抗炎作用。研究发现,IL-4能诱导PPAR-γ激活,并提高MG的IL-4受体表达[26],IL-4的肠胃外给药可促使脑PPAR-γ相关基因表达,PPAR-γ激动剂可抑制EAE中的IL-12信号传导和Th1分化来减轻神经炎症和脱髓鞘。本实验结果证实,补肾益髓胶囊能够明显上调EAE小鼠脑和脊髓PPAR-γ基因表达,推测本药的抑炎作用可能与上调PPAR-γ信号通路有关。由于PPAR-γ通路复杂,其与JAK-STAT、PI3K/Akt信号通路等都有相互影响,因此,补肾益髓胶囊对PPAR-γ通路调节作用还待深入研究。
综上,补肾益髓胶囊能够调节EAE小鼠细胞免疫因子,抑制小胶质细胞向M1极化,其机制可能与调节PPAR-γ表达有关。本研究为补肾生髓、化痰活血法治疗MS的科学内涵提供了实验依据,同时也为中医药通过调节MG治疗MS提供了新思路。
